虾青素保护视网膜色素上皮细胞免受蓝光发光二极管诱导的氧化应激损伤
2021-12-02刘垚杰郭雅图李赫宇单艳琴陈云霞
刘 莹,马 宁,刘垚杰,郭雅图,李赫宇,单艳琴,陈云霞,王 浩,*
(1.天津科技大学食品科学与工程学院,天津 300457;2.承德医学院研究生学院,河北 承德 067000;3.沧州市人民医院,河北 沧州 061000;4.天津市眼科医院,天津 300020;5.天津益倍生物科技集团,天津 300457;6.江苏兴野食品有限公司,江苏 泰州 225700)
发光二极管(light-emitting diodes,LED)是一种节能光源,广泛应用于智能手机、数字显示器和计算机屏幕等电子设备中[1]。与传统光源相比,LED能够发出更高级别的蓝光,从而可以提高电子屏幕的清晰度和亮度[2]。蓝光的波长在400~495 nm之间,与其他波长的光源相比,蓝光可以穿透晶状体进入视网膜,并且可以诱导机体产生过量活性氧(reactive oxygen species,ROS),导致氧化应激,从而引起视网膜色素上皮(retinal pigment epithelial,RPE)细胞结构损伤和活力下降[3]。
RPE细胞是位于视网膜光感受器和脉络膜毛细血管之间的一种高度极化的单层色素细胞,是眼睛吸收光的主要部位[4]。RPE细胞维持着视网膜光感受器的正常生理状态,并且作为构成“血-视网膜屏障”的一部分,它可以选择性地向视网膜运送营养成分并清除代谢物质[5]。在正常的生理条件下,视网膜需要较高的氧气供应,以抵抗累积在视网膜周围大量的辐射,因此,RPE细胞极易受到氧化应激损伤[6]。ARPE-19细胞系是最常用的RPE细胞系之一,具有天然RPE细胞特有的鹅卵石形态和多种特性,因此经常被用于多种视网膜相关疾病的研究[7]。
氧化应激是由于ROS的过量产生和抗氧化防御能力降低造成的,并通过细胞脂质、蛋白质和DNA的氧化对视网膜组织造成实质性的损害。因此,保持细胞内ROS的生成与抗氧化防御系统的平衡对维持视网膜正常功能至关重要[8]。核因子E2相关因子2(nuclear factor erythroid-2-related factor 2,Nrf2)是一种应激反应转录因子,其在哺乳动物细胞抗氧化应激途径中起主要调节作用[9]。在基础条件下,Nrf2主要是与其抑制剂Kelch样ECH联合蛋白1(Kelch-like-ECH-associatedprotein 1,Keap1)结合,在细胞质中进行泛素化和蛋白酶体降解,从而限制了Nrf2的激活[10]。然而,当细胞被ROS或其他亲核试剂刺激时,Keap1通过蛋白质修饰发生构象变化,并与Nrf2解偶联,促进Nrf2的活化。活化后的Nrf2转运至细胞核中,与抗氧化剂反应元件(antioxidant responsive element,ARE)启动子结合,促进抗氧化酶和II相解毒酶的表达,从而增强细胞清除ROS的能力,抑制氧化应激[11]。
虾青素是一种类胡萝卜素化合物,主要存在于虾蟹外壳、牡蛎和雨生红球藻等海洋生物中,成人安全摄入量为6 mg/d[12-13]。虾青素的长链结构中含有2 个不饱和酮基和11 个共轭双键,具有活泼的电子效应,能够向自由基提供电子或吸引自由基的不成对电子,不饱和酮基还赋予了虾青素更高的极性,增加其对细胞膜的通透性[14]。因此,与其他类胡萝卜素(如α-胡萝卜素、β-胡萝卜素、番茄红素和叶黄素)相比,虾青素在体内能够发挥更强的抗氧化作用[15]。有研究表明,虽然虾青素在人类视网膜中非天然存在,但它能很容易地穿过“血-视网膜屏障”,对视网膜神经节细胞产生抗氧化作用[16]。此外,在糖尿病大鼠视网膜病变的模型中发现,虾青素通过改善视网膜组织结构,上调抗氧化应激酶的表达,从而保护视网膜组织细胞免受氧化应激损伤[17]。目前,虾青素对蓝光LED诱导的视网膜损伤的影响鲜见报道。因此,本研究拟采用ARPE-19细胞作为视网膜细胞模型,探讨虾青素对蓝光LED诱导的视网膜损伤的潜在保护作用及其可能的作用机制,期为其在视力保健产品领域的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
虾青素(纯度98%) 美国Sigma公司;人视网膜色素上皮细胞ARPE-19 北京鼎国生物技术有限公司;DMEM/F12培养基 美国Corning公司;胎牛血清(fetal bovine serum,FBS) 澳大利亚AusGeneX公司;2’,7’-二氯二氢荧光素二乙酸酯(2’,7’-dichlorodihydrofluoresce in diacetate,DCFH-DA) 美国Gibco公司;乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒 上海碧云天生物技术有限公司;JC-1线粒体膜电位检测试剂盒北京索莱宝生物科技有限公司;Anti-Nrf2抗体、Anti-Lamin B1抗体 美国Immunoway公司。
1.2 仪器与设备
二氧化碳培养箱 美国SHELLAB公司;酶标仪美国Thermo公司;倒置荧光显微镜 日本Nikon公司;实时定量聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Applied Biosystems公司;蓝光LED灯深圳市圣景广电有限公司;TES1330A数字照度计北京金仕特仪表有限公司;超声波细胞破碎仪 上海熙扬仪器有限公司;冷冻离心机 丹麦Labogene公司。
1.3 方法
1.3.1 ARPE-19细胞培养
ARPE-19细胞置于含有质量分数10% FBS、质量分数1%双抗(100 U/mL青霉素和100 mg/mL链霉素)的DMEM/F12培养基中,并在37 ℃、5%(体积分数)二氧化碳培养箱中培养。待细胞长至80%~90%时,进行细胞传代并接种到实验所需的培养板中。
1.3.2 蓝光LED氧化应激损伤模型的建立以及实验分组
参考Lin[1]和Chang[18]等的研究,使用蓝光LED灯建立细胞氧化应激损伤模型:将蓝光LED灯安装在96 孔板上方,使用照度计测定并确定细胞表面的光照强度,根据光照强度调整光照装置到细胞表面的距离。为了确保ARPE-19细胞有一个稳定的生长环境,将该装置放置在二氧化碳培养箱中,使温度保持在36.5~37.5 ℃。将ARPE-19细胞以每孔5×103个的密度接种于96 孔板中,细胞生长24 h后,用不同浓度的虾青素预处理1 h,然后将细胞暴露于2 500 lx的蓝光LED下24 h。当蓝光LED诱导损伤后,细胞活力显著降低,且细胞内的ROS水平显著高于未损伤的细胞时,即为氧化应激模型建立成功。
实验共分为5 组,对照组:以锡箔纸遮盖细胞培养板;蓝光LED氧化损伤组:仅蓝光LED处理;虾青素低剂量组:蓝光LED+5 μmol/L虾青素;虾青素中剂量组:蓝光LED+10 μmol/L虾青素;虾青素高剂量组:蓝光LED+20 μmol/L虾青素。虾青素浓度根据细胞活力测定结果确定。
1.3.3 细胞活力测定
采用噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide,MTT)法测定细胞活力。将ARPE-19细胞悬液(5×103个/孔)接种于96 孔板中,孵育24 h。按照上述实验分组处理细胞后,每孔中加入20 μL MTT(5 mg/mL)溶液,在37 ℃二氧化碳培养箱内继续孵育4 h,吸弃MTT溶液并加入150 μL二甲基亚砜,充分振荡,待甲瓒结晶全部溶解为紫色溶液后,在490 nm波长处测定OD值,并按照式(1)计算细胞活力。

1.3.4 LDH释放水平测定
当细胞膜的完整性被破坏时,胞浆内的LDH就会释放到培养基中。因此,可以通过测定细胞膜受损时培养基中LDH的释放率来反映干预因素对细胞的毒性。将ARPE-19细胞悬液(5×103个/孔)接种于96 孔板中,孵育24 h。以不接种细胞只存在DMEM/F12培养基的组为空白组,其余各组分别按照1.3.2节方法处理细胞后,吸弃上清液,加入150 μL LDH释放试剂,在二氧化碳培养箱中继续孵育1 h后,分别吸取各孔上清液120 μL,加入到新的96 孔板中,随即在490 nm波长处测定OD值,按照式(2)计算LDH的释放率。

1.3.5 细胞内ROS水平测定
使用DCFH-DA探针测定细胞内ROS水平。将ARPE-19细胞悬液(1.5×105个/孔)接种于6 孔板中,孵育24 h。按照1.3.2节方法分组处理细胞后,用含DCFH-DA的培养液代替细胞培养液,在37 ℃下孵育20 min。用倒置荧光显微镜采集图像,并使用Image J软件分析图像荧光强度,结果以对照组细胞荧光强度的百分比表示。
1.3.6 线粒体膜电位测定
采用JC-1染料测定线粒体膜电位的变化。将ARPE-19细胞悬液(1.5×105个/孔)接种于6孔板中,孵育24 h。按照1.3.2节方法分组处理细胞后,每孔加入1 mL细胞培养基及1 mL JC-1染色工作液,并在37 ℃孵育20 min。孵育结束后,吸弃上清液,用JC-1染色缓冲液洗涤2 次,加入2 mL DMEM/F12培养基,通过倒置荧光显微镜采集图像。
1.3.7 细胞内抗氧化酶活力及丙二醛含量测定
细胞经上述处理后,弃去培养基,磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗2 次,收集细胞并重悬于200 µL PBS中进行超声处理(功率:300 W,超声5 s间歇30 s,重复3~5 次)。将超声后的细胞匀浆分别在450、405、412 nm和523 nm波长处根据超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和丙二醛(malondialdehyde,MDA)检测试剂盒说明书提供的方法测定OD值,计算SOD、CAT和GSH-Px活力及MDA含量。
1.3.8 细胞内抗氧化相关基因表达量的测定
TRIzol法提取ARPE-19细胞中总RNA,反转录试剂盒合成cDNA,-80 ℃保存。引物设计如表1所示,按照SYBR green试剂盒说明,利用实时定量PCR仪测定Ct值,以β-actin为内参基因,采用2-ΔΔCt方法计算结果,具体操作参考本课题组前期研究方法[19]。
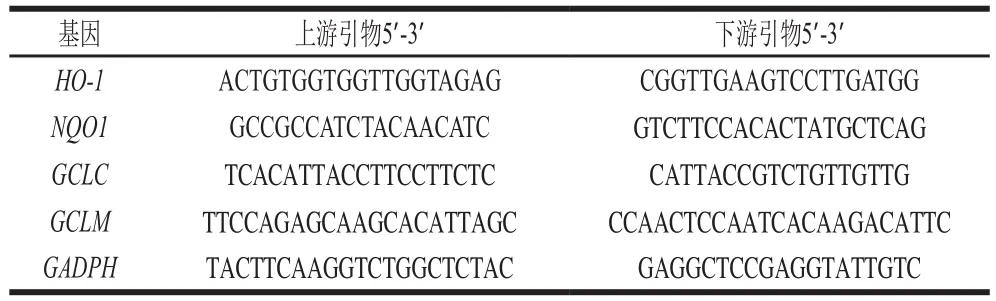
表1 细胞内相关基因引物序列Table 1 Primer sequences used for PCR in this study
1.3.9 Western blot分析
采用Western blot检测细胞核内Nrf2蛋白表达水平。使用核蛋白提取试剂盒从上述各组不同处理的细胞中提取核蛋白,并测定蛋白含量。使用质量分数10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)凝胶分离样品,然后将蛋白半干,转移至聚偏氟乙烯(poly(vinylidene fluoride),PVDF)膜(恒压110 V、60 min)。将PVDF膜在5%的脱脂奶粉中封闭1 h,然后加入一抗,4 ℃孵育过夜。TBST洗3 次后,将PVDF膜放入二抗孵育1~2 h,然后使用ECL化学发光试剂进行显色后在凝胶成像仪上观察条带,并用Image J软件对条带灰度进行定量分析,以Lamin B1作为内参蛋白。
1.3.10 分子对接
分子对接经常被用于模拟小分子与蛋白质之间可能的结合位点以及结合方式。因此,本实验通过分子对接分析虾青素与Keap1蛋白的结合能力与结合方式。Keap1蛋白(PDB:2FLU,来源:人)结构来自于Protein Data Bank(www.rcsb.org),虾青素和姜黄素(一种已知的Nrf2信号通路激活剂)小分子结构下载于网站www.chemicalbook.com。使用Discover Studio 3.5软件对小分子和蛋白质进行对接,并对小分子与蛋白质之间的相互作用力和相互作用氨基酸进行分析,具体参考本课题组前期研究[20]。
1.4 数据统计与分析
每个实验至少重复3 次,所有数据以平均值±标准偏差表示。采用GraphPad Prism 7.0软件进行数据分析,P<0.05表示差异具有统计学差异。
2 结果与分析
2.1 虾青素对蓝光LED诱导细胞损伤的保护作用
虾青素的结构式如图1A所示。采用MTT法测定虾青素对ARPE-19细胞活力的影响。结果如图1B所示,与对照组相比,不同浓度(0、1、5、10 µmol/L和20 µmol/L)的虾青素处理细胞后,细胞活力无显著变化(P>0.05),说明虾青素在小于20 µmol/L的浓度范围内对ARPE-19细胞活力无显著影响。因此,选用5、10 µmol/L和20 µmol/L的虾青素进行后续实验。
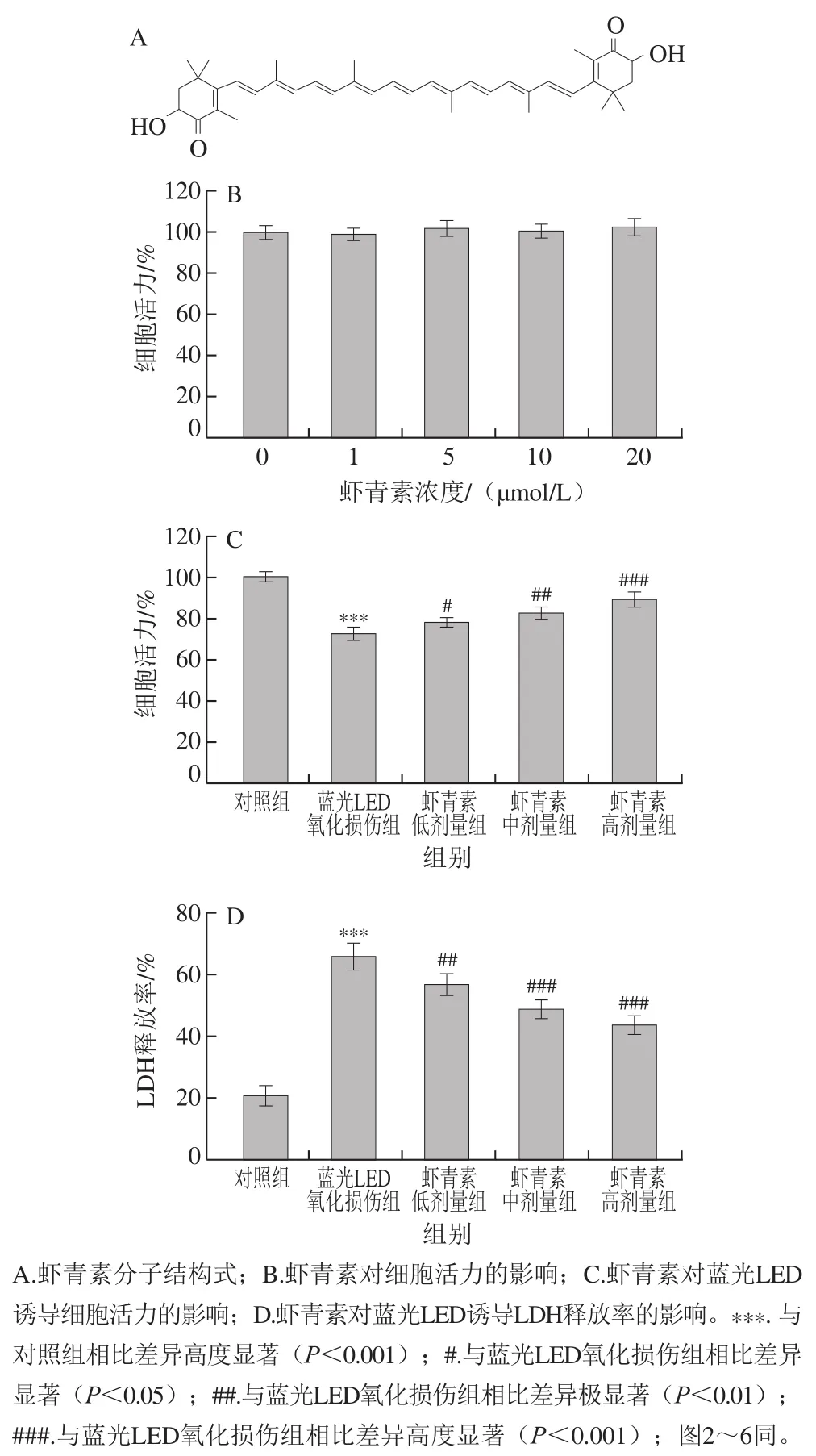
图1 虾青素对蓝光LED诱导细胞损伤的保护作用Fig. 1 Protective effect of astaxanthin on cell injury induced by blue light LED
为了评估虾青素的保护作用,将ARPE-19细胞用虾青素(0、5、10 µmol/L和20 µmol/L)预处理1 h,然后再暴露于蓝光LED下24 h。如图1C所示,MTT结果表明,蓝光LED处理后,细胞活力高度显著降低(P<0.001),证实了蓝光LED对细胞的损伤作用。然而,虾青素预处理可以以浓度依赖的方式显著抑制蓝光LED诱导的细胞活力降低(P<0.05,P<0.01,P<0.001)。为了进一步验证虾青素对蓝光LED诱导的细胞损伤的保护作用,测定了虾青素处理后细胞LDH释放水平。如图1D所示,虾青素预处理显著降低了蓝光LED诱导的LDH的释放(P<0.01,P<0.001),说明虾青素可以有效保护ARPE-19细胞免受蓝光LED处理导致的细胞毒性。
2.2 虾青素对蓝光LED诱导ARPE-19细胞内ROS产生的影响
采用DCFH-DA荧光探针染色法测定细胞内ROS水平,评价虾青素对ARPE-19细胞氧化应激损伤的保护作用。如图2A、B所示,与对照组相比,蓝光LED辐照后细胞内ROS水平高度显著升高(P<0.001)。虾青素预处理抑制了蓝光LED辐照诱导的ROS的产生,且呈浓度依赖性。结果表明,虾青素可以通过降低细胞内ROS水平来保护细胞免受蓝光LED诱导的氧化应激损伤。

图2 虾青素抑制蓝光LED诱导的ARPE-19细胞内ROS的产生Fig. 2 Astaxanthin inhibited ROS production in ARPE-19 cells induced by blue light LED
2.3 虾青素对蓝光LED诱导ARPE-19细胞线粒体损伤的影响
线粒体膜电位的变化反映了细胞氧化应激水平[21]。采用JC-1染料监测线粒体状态,红/绿色荧光强度比越低说明线粒体损伤越严重。如图3A、B所示,与对照组相比,蓝光LED辐照导致红/绿荧光强度百分比高度显著降低(P<0.001)。然而,与蓝光LED组相比,虾青素预处理以浓度依赖性方式增加了红/绿荧光强度百分比。结果表明,虾青素能够缓解由蓝光LED辐照引起的线粒体损伤。

图3 虾青素抑制蓝光LED诱导的ARPE-19细胞线粒体损伤Fig. 3 Astaxanthin inhibited mitochondrial damage in ARPE-19 cells induced by blue light LED
2.4 虾青素对蓝光LED诱导的ARPE-19细胞内抗氧化酶活力及MDA含量的影响
强光损伤能够导致过量的ROS产生,并破环内源性抗氧化酶系统,导致氧化应激的发生[22]。如图4A~D所示,蓝光LED损伤后,ARPE-19细胞内SOD、GSH-Px和CAT活力均显著降低(P<0.01,P<0.001),MDA含量高度显著升高(P<0.001)。虾青素预处理可以显著提高SOD、GSH-Px和CAT活力,显著降低MDA含量。综上,虾青素可以通过提高ARPE-19细胞内源性抗氧化酶活力抑制蓝光LED诱导的氧化应激。
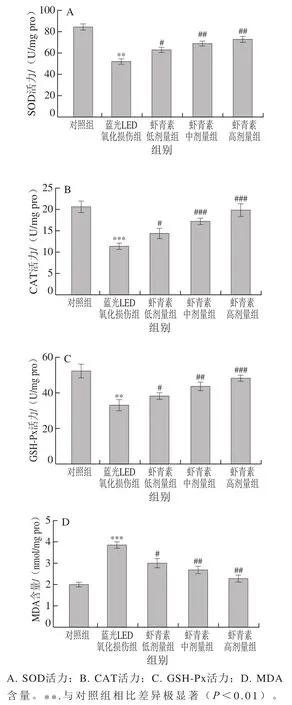
图4 虾青素对蓝光LED诱导的ARPE-19细胞内抗氧化酶活力及MDA含量的影响Fig. 4 Effect of astaxanthin on antioxidant enzyme activities and MDA content in ARPE-19 cells induced by blue light LED
2.5 虾青素对蓝光LED诱导的ARPE-19细胞内HO-1、NQO1、GCLC和GCLM mRNA表达水平的影响
为探究虾青素对蓝光LED诱导的ARPE-19细胞氧化损伤的保护机制,采用实时定量PCR检测细胞内HO-1、NQO1、GCLC和GCLMmRNA表达水平。如图5所示,蓝光LED辐照处理24 h后,细胞内HO-1、NQO1、GCLC和GCLMmRNA的表达水平均显著降低(P<0.05);然而,虾青素预处理以浓度依赖的方式提高了HO-1、NQO1、GCLC和GCLMmRNA的表达水平。这些结果表明,虾青素通过上调ARPE-19细胞中抗氧化和II相解毒基因的表达来发挥其抗氧化作用。

图5 虾青素对蓝光LED诱导的ARPE-19细胞内抗氧化相关基因表达的作用Fig. 5 Effect of astaxanthin on the expression of antioxidant genes in ARPE-19 cells induced by blue light LED
2.6 虾青素诱导ARPE-19细胞Nrf2核移位和蛋白表达
Nrf2是氧化应激的关键调节因子,它通过进入细胞核与ARE结合,从而促进内源性抗氧化酶和II相解毒酶表达[9]。Western blot分析ARPE-19细胞Nrf2核蛋白的表达结果显示,与蓝光LED组相比,虾青素处理组Nrf2核蛋白的表达量随虾青素浓度的增加而显著增加(P<0.05,P<0.01)(图6)。虾青素诱导了Nrf2核移位,可能进而激活ARPE-19细胞中抗氧化酶和II相解毒基因的表达。

图6 虾青素诱导ARPE-19细胞Nrf2核移位和蛋白表达情况Fig. 6 Astaxanthin induced Nrf2 nuclear translocation and protein expression in ARPE-19 cells
2.7 分子对接分析结果
分子对接是小分子和蛋白质通过活性中心彼此识别的过程,在此过程中,通常认为小分子与蛋白质活性中心之间的结合能越小,对接后形成的分子系统越稳定,小分子与蛋白质大分子活性中心的结合能力就越强[20]。之前的研究表明,姜黄素小分子可与Keap1蛋白的活性中心结合,并加速Keap1蛋白与Nrf2蛋白的分离[23]。本实验中,通过分子对接分析虾青素与Keap1蛋白的结合稳定性,探讨其抗氧化作用机制。如图7和表2所示,虾青素与2FLU之间的结合能为-305.055 4 kJ/mol,姜黄素与2FLU之间的结合能为-339.531 6 kJ/mol。虾青素与姜黄素在相同的活性中心对接,并且两者的对接结果具有相近的分子间能量。以上结果表明,虾青素和姜黄素可能具有相似的抗氧化作用机制,通过与Keap1蛋白结合,促进Keap1蛋白与Nrf2蛋白分离,这与细胞实验的结果一致。
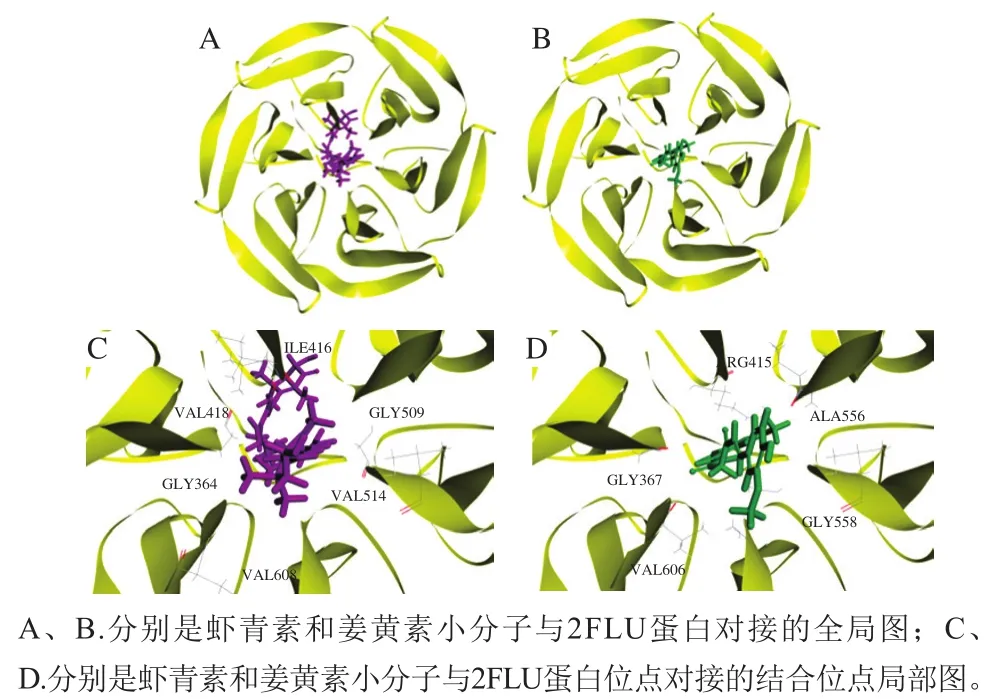
图7 虾青素和姜黄素与2FLU分子对接结果Fig. 7 Schematic illustration of molecular docking between astaxanthin or curcumin and 2FLU

表2 虾青素和姜黄素小分子和2FLU蛋白质之间的对接信息Table 2 Information about molecular docking between astaxanthin or curcumin and 2FLU
3 讨 论
LED是现代生活中广泛使用的节能光源,能发出较高水平的短波蓝光[1]。而过多的蓝光暴露会通过诱导氧化应激损害眼睛中的视网膜色素上皮细胞[3]。虾青素是一种活性很强的自由基清除剂,其共轭双键和不饱和酮基具有较活泼的电子效应,能够向自由基提供电子或吸引自由基的不成对电子,阻断自由基链式反应并产生无害的产物[14],有效淬灭氧化性较强的单线ROS,从而抑制机体的氧化损伤[24]。此外,虾青素“极性-非极性-极性”的分子结构使其可以精确地穿透细胞膜,抑制磷脂双分子层的氧化,保护细胞膜结构的完整性[25]。因此,本研究采用ARPE-19细胞评价虾青素对蓝光LED诱导的视网膜损伤的保护作用,并探讨其可能的作用机制。
氧化应激与年龄相关性黄斑变性和糖尿病、缺血性视网膜病变的发病机制有关[26-27]。先前的研究已经表明虾青素在与氧化应激相关的视网膜病变中有潜在益处[28-29]。氧化应激与蓝光诱导的视网膜损伤存在很强的相关性[30]。ROS通过对DNA、脂质、蛋白质和碳水化合物的过氧化导致组织损伤[31]。在本研究中,虾青素的抗氧化作用主要是缓解蓝光LED暴露后ROS过量产生导致的细胞损伤。线粒体是能量代谢的主要场所,其产生的能量用来维持细胞的正常生理功能,这种能量以ATP的形式存在[3]。然而,ROS可以通过中断酶的反应来抑制酶活力,减少ATP的产生,从而导致氧化应激和细胞凋亡[3]。本实验结果表明,虾青素具有稳定线粒体膜电位的能力。综上所述,虾青素处理可以减少蓝光LED诱导的ROS产生,减轻线粒体损伤,抑制细胞凋亡,从而提高细胞存活率。
机体中的氧化还原平衡依赖于抗氧化系统的调节,该系统主要包含内源性抗氧化酶系统和非酶抗氧化系统[32]。蓝光LED照射后,产生的过量ROS破环了这种防御机制,并加速氧化应激的发生[33]。SOD、GSH-Px和CAT是内源性抗氧化防御系统的重要酶系,它们可以抑制氧自由基的形成,将体内的过氧化物转换为毒性较低或者无毒性的物质[32]。在生物体内,脂质可与自由基发生过氧化反应,从而形成MDA,其具有细胞毒性[34]。本实验结果表明,虾青素预处理能显著提高细胞内源性抗氧化酶的活性,降低MDA水平,缓解蓝光LED导致的氧化损伤。
Nrf2/ARE通路在细胞抵抗氧化应激中起着重要作用[35-36]。Nrf2是一种与ARE结合并促进II相酶表达的转录因子[10]。Nrf2在正常状态下与Keap1紧密相连,当受到外界刺激时,体内氧化压力升高时,Keap1会发生构象变化,与Nrf2分离,进而转运入核,与核内ARE结合,启动II相解毒基因的转录表达,从而起到抗氧化的作用[11]。Cui Gengyuan等研究表明,虾青素通过激活Nrf2/ARE通路保护小鼠心脏免受赭曲霉毒素A暴露引起的氧化应激和线粒体凋亡[37]。Lai等研究发现,虾青素通过上调Nrf2介导抗氧化酶的表达减轻高糖诱导视网膜光感受器细胞的氧化损伤[14]。在本研究中,虾青素可以激活Nrf2/ARE通路,通过诱导Nrf2的核移位(图6),从而增加了II相解毒基因的表达(图5),最终对蓝光LED诱导的ARPE-19细胞氧化损伤起到显著的保护作用。
分子对接是小分子和蛋白质通过几何匹配和能量匹配彼此识别的过程[20]。已有研究表明,虾青素和姜黄素是两种还原性较强的物质[23,37]。并且,姜黄素能够与Keap1蛋白的活性中心结合,促进Keap1蛋白与Nrf2蛋白分离,随后Nrf2蛋白进入细胞核并激活体内抗氧化活性因子的表达[23]。分子对接结果表明,虾青素和姜黄素小分子具有相近的结合能量。因此,虾青素可能以相似的方式通过激活Nrf2信号通路来发挥其对细胞的抗氧化作用。
综上所述,本实验结果表明虾青素可能通过激活Nrf2信号通路,促进抗氧化酶和II相解毒基因的表达,降低细胞内ROS水平,缓解线粒体损伤,最终保护ARPE-19细胞免受蓝光LED诱导的氧化应激损伤。
4 结 论
本研究以蓝光LED诱导的ARPE-19细胞为氧化应激损伤模型,通过测定细胞活力、细胞毒性、细胞内ROS水平、线粒体膜电位的变化、细胞内源性抗氧化酶、II相解毒基因的转录表达水平以及Nrf2核蛋白表达水平,评价虾青素的保护作用及其机制。结果表明,虾青素以浓度依赖的方式抑制蓝光LED导致的ARPE-19细胞活力降低,缓解细胞毒性,减少细胞内ROS的产生,稳定线粒体膜电位,提高内源性抗氧化酶活力。此外,虾青素诱导了Nrf2的核转位,增加了抗氧化酶和II相解毒基因的表达,从而保护ARPE-19细胞免受蓝光LED诱导的氧化应激损伤。
