水质改良灭菌剂D7对四种对虾致病菌的作用
2021-11-27高佳朋郭冉于志文何立彬夏辉朱昱铮
高佳朋 郭冉 于志文 何立彬 夏辉 朱昱铮
摘 要:为研究水质改良灭菌剂D7对常见对虾致病菌的抑制及杀灭效果,通过抑菌圈实验及生态毒理学方法研究D7对哈维氏弧菌(Vibrio harveyi)、副溶血弧菌(Vibrio parahaemolyticus)、溶藻弧菌(Vibrio alginolyticus)、无乳链球菌(Streptococcus agalactiae)等4种常见对虾致病菌的抑制效果、最佳作用时间及不同温度对D7杀菌作用的影响。结果显示,在35 ℃条件下,哈维氏弧菌对D7高度敏感,溶藻弧菌、副溶血弧菌对D7中度敏感,无乳链球菌对D7低度敏感;D7对4种菌的最小抑菌浓度和最小杀菌浓度均为50.00 mg/L;D7对副溶血弧菌的最佳作用时间为4 h,对哈维氏弧菌、溶藻弧菌、无乳链球菌的最佳作用时间为8 h;在18、28、35 ℃条件下,D7对4种对虾致病菌的杀灭效果无显著差异(P>0.05)。可见在本试验条件下,D7对4种常见对虾致病菌具有一定的杀灭抑制效果,最佳作用时间为8 h,且杀菌效果不随温度的改变而变化。
关键词:水质改良灭菌剂;D7;对虾;致病菌;抑菌作用
D7是一款新型的高效消毒液,由美国专业消毒剂生产商Decon7 Systems与美国国家级实验室桑迪亚合作研制。研究表明D7对部分有毒有害化学品有中和、抑制效果,对病毒、部分细菌有抑制及杀灭效果[1]。此前D7广泛应用于食品车间消毒、畜牧车间消毒等,但并未在水产相关领域使用。D7杀菌的主要有效作用成分包含过氧化氢,过氧化氢是一种化学性质极为活泼的强氧化剂,在环境中容易分解为氧气和水,残留较小,对环境影响较小,是一种较为清洁的消毒剂。近年来的研究表明,过氧化氢可与其他成分如季铵盐、金属离子、表面活性剂、无机碘化物、等离子体等产生协同杀菌作用,与单独过氧化氢为杀菌成分的杀菌剂相比效果更佳[2-4]。
近年来,伴随对虾养殖业的不断扩大,其面临的环境问题也日益突出,养殖规模快速增长,水体富营养化加剧,致使养殖水体中有害藻菌滋生,有害细菌引发的对虾细菌性疾病更是成为导致养殖失败的主要病害之一[5]。在对虾养殖中常见的对虾弧菌病、肠炎病、烂鳃病、肝胰腺坏死病等疫病均是由细菌滋生感染导致的,而在众多的致病菌中,又以弧菌、链球菌、爱德华氏菌等几类病菌最为常见和难以根治[6]。
本研究以哈维氏弧菌、副溶血弧菌、溶藻弧菌、无乳链球菌等4种常见的对虾致病菌为研究对象,探究水质改良剂D7对水产养殖有害病菌的抑制及杀灭效果,提供水质改良剂D7在水产相关领域应用的数据支撑,为今后水产养殖细菌性疾病的防治提供新的思路和方法。
1 材料和方法
1.1 试验材料
试验所用水质改良剂D7购自D7生物科技有限公司,由美国专业消毒剂生产商Decon7 Systems制造生产。D7产品有效成分包括:第一部分(以下称为“P1”)烷基二甲基苄基氯化铵和表面活性剂的混合物、第二部分(以下称为“P2”)过氧化氢(浓度7.98%)和第三部分(以下称为“P3”)催化剂/增效剂。
试验所用菌种哈维氏弧菌(Vibrio harveyi,MCCC1A13958)、溶藻弧菌(Vibrio alginolyticus,MCCC1A07296)由中国海洋微生物菌种保藏管理中心提供;副溶血弧菌(Vibrio parahaemolyticus,ATCC17802)、无乳链球菌(Streptococcus agalactiae,ATCC17802)由ATCC菌种保藏中心提供。
1.2 试验方法
1.2.1 D7原液及使用液的配制 配置D7原液时先将D7试剂的P2、P3充分混匀,静置反应5 min后,加入P1,使用玻璃棒缓慢搅拌均匀,避免快速搅拌产生大量泡沫,配好后的D7原液可常温保存8 h有效,需现用现配。原液配制好后可按所需比例稀释得到D7使用液,本试验中加1 mL D7原液至1 L蒸馏水中,制成D7使用液。
1.2.2 培养基及中和剂的配制 根据食品安全国家标准[7],哈维氏弧菌、溶藻弧菌、副溶血弧菌采用TCBS培养基培养;无乳链球菌采用血琼脂平板培养基培养。菌液扩培菌使用LB培养基。
TCBS培养基配制时,将TCBS培养基粉剂加热溶化,补水到所需的总体积。按照文献[8]方法进行配制、分装、灭菌操作。灭菌完成后,将培养基冷却至50 ℃左右时倒入平板当中,待平板凝固后,放置于冰箱中待用[9]。
LB培养基配制时,按照培养基的配方比例在1 L的蒸馏水中加入10 g蛋白胨、10 g氯化钠、5 g酵母膏、3 g磷酸氢二钾、2 g蔗糖,调整培养基pH值为7。配制好后的培养基分装灭菌步骤与TCBS培养基相同。
血琼脂平板购自北京路桥生物技术有限责任公司,主要成分为蛋白胨、淀粉、氯化钠、牛羊血、琼脂等原料。
中和劑使用PBS中和剂,由2 g/L硫代硫酸钠+3 g/L卵磷脂+10 g/L氯化钠+20 g/L吐温80组成。
1.2.3 菌种培养 因购买的菌种为菌种平板,首先对4种菌种进行二次扩培,取副溶血弧菌敏感菌株,在TCBS培养基上进行划线分离,培养12 h得到单菌落。查阅相关文献后[10],以LB液体培养基代替3%氯化钠蛋白胨水,接种环挑取单菌落,接种到LB液体培养基上,在37 ℃,200 r/min的恒温摇床培养5 h,制备菌液后,用平板培养计数法[11]测定出相应细菌浓度,以便计算后续NaCl添加量;取5 mL菌液于离心管中,5 000 r/min离心2 min,弃上清,沉淀中加入5 mL 0.85% NaCl,使细菌悬浮,重复上述离心悬浮操作2次,得到最终菌悬液。将上述菌悬液与0.5的麦氏比浊管进行比对,用0.85% NaCl进行浓度调整得到麦氏浓度0.5的NaCl菌液,吸出该菌液1 400 μL,倒入210 mL LB培养基中,用于最小抑菌浓度(MIC)测定、最小杀菌浓度(MBC)的测定和抑菌圈试验。
1.2.4 抑菌圈试验
1.2.4.1 稀释菌液 取摇菌管,用移液枪吸取10 mL LB液体培养基,加哈维氏弧菌菌液100 μL,至摇菌管中,摇匀。副溶血弧菌、无乳链球菌、溶藻弧菌均同上处理。
1.2.4.2 制作含药纸片 取出若干灭菌好的纸片,用移液枪吸取D7原液10 μL至纸片上,晾干备用。
1.2.4.3 涂板 取100 μL稀释好的菌液于TCBS琼脂板(无乳链球菌为血琼脂平板),用涂布棒涂匀。
1.2.4.4 贴放纸片 将含药纸片有药液的一面贴放于涂满菌的琼脂板上,于37 ℃恒温培养箱培养16~24 h,取出观察结果。试验重复3次,分别记为1#-3#。
1.2.4.5 抑菌效果評定 水质改良剂D7抑菌效果评定标准为:若抑菌圈直径大于20 mm,为高度敏感;若抑菌圈直径在10~20 mm,为中度敏感;若抑菌圈直径小于10 mm,为低度敏感。
1.2.5 最小抑菌浓度试验 取13支灭菌后的试管并依次编号(1-13号),将准备好的LB液体培养基逐个加入试管中,1号试管加8 mL,其余每支试管加入5 mL培养基。1号试管加入配制好的D7使用液2 mL,混匀;从1号管取5 mL混合液加入2号管,摇匀;如此依次倍比稀释至11号管;最后从11号试管吸取5 mL弃去。此时1—12号管D7浓度分别为200.00、100.00、50.00、25.00、12.50、6.25、3.125、1.563、0.781、0.391、0.195、0 mg/L,12号管为不含D7的生长对照。所有试管中加入中和剂5 mL,1—12号管中分别加入菌液2 mL,13号试管中加入2 mL LB培养基并混匀,1-11号管以T1-T11表示,12号管为对照组,13号管为空白组。以37 ℃ 200 r/min摇床培养18~24 h,肉眼观察菌体生长情况,溶液最后变澄清的为最小抑菌浓度。
1.2.6 最小杀菌浓度试验 按照上述的D7最小抑菌浓度为基础,重复上述试验步骤,稀释后以对照组为基准调零,测定菌液吸光度(OD值),计算细菌浓度。以肉眼观察最为澄清且OD值接近于0的为最小杀菌浓度[12]。按照上述步骤测定1—12号管后,分别取12支管菌液在无菌的TCBS琼脂培养基平板上划线接种(无乳链球菌接种于无菌的血琼脂平板),以37 ℃恒温培养20~24 h,以平板上无菌体生长的D7浓度值标定为最小杀菌浓度,以对比验证之前的最小杀菌浓度结果。培养试验分别重复3次。
1.2.7 D7的抑菌最佳作用时间 以上述步骤得出的最小杀菌浓度进行4种对虾致病菌的培养实验。首先将3种弧菌在TCBS培养基上进行划线分离,无乳链球菌在血琼脂平板上进行划线分离,培养12 h得到单菌落,将配制好的LB培养基200 mL分别倒入4个锥形瓶中,挑取单菌在锥形瓶中培养,在37 ℃,200 r/min的恒温摇床培养5 h,平板培养计数法[13],测定菌浓度达2.0×106 CFU/mL以上;培养完成后分别加入最小抑菌浓度和最小杀菌浓度的水质改良灭菌剂D7,测定1 h、2 h、4 h、8 h、16 h、24 h的吸光度(OD值),计算细菌浓度。
1.2.8 D7在不同温度下的抑菌效果试验 参考不同养殖对象的适宜温度,探究不同温度下,D7对主要致病菌的杀灭效果。选取北方常见养殖对象大菱鲆、凡纳滨对虾的最适生长温度(18 ℃、28 ℃)以及4种致病菌的最适生长温度(35 ℃)进行试验,试验步骤参照1.2.7试验,最后测定8 h的吸光度(OD值)。
1.3 数据分析
数据统计使用IBM SPSS Statistics 26分析软件,采用单因素方差分析(one-way ANOVA),试验结果用平均值±标准差表示。单因素方差分析(P<0.05)显著性差异时,再采用Duncans进行多重比较分析。
2 试验结果
2.1 D7对4种对虾致病菌抑制作用的对比
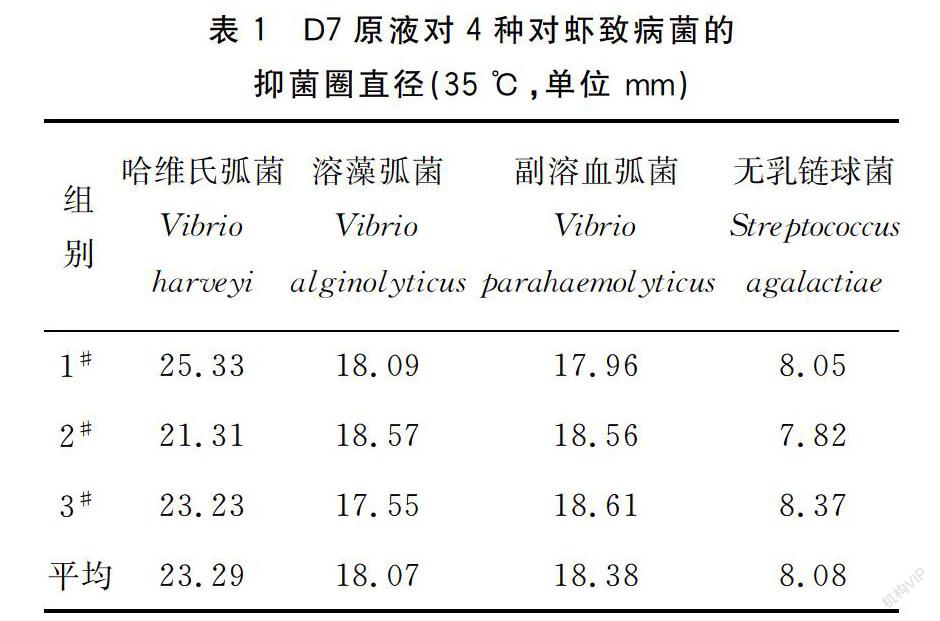
在细菌培养的最适温度35 ℃条件下,D7原液对四种对虾致病菌有不同程度的抑制作用,见表1。其中,哈维氏弧菌对D7高度敏感,溶藻弧菌、副溶血弧菌对D7中度敏感,无乳链球菌对D7低度敏感。
2.2 最小抑菌浓度(MIC)和最小杀菌浓度(MBC)的确定
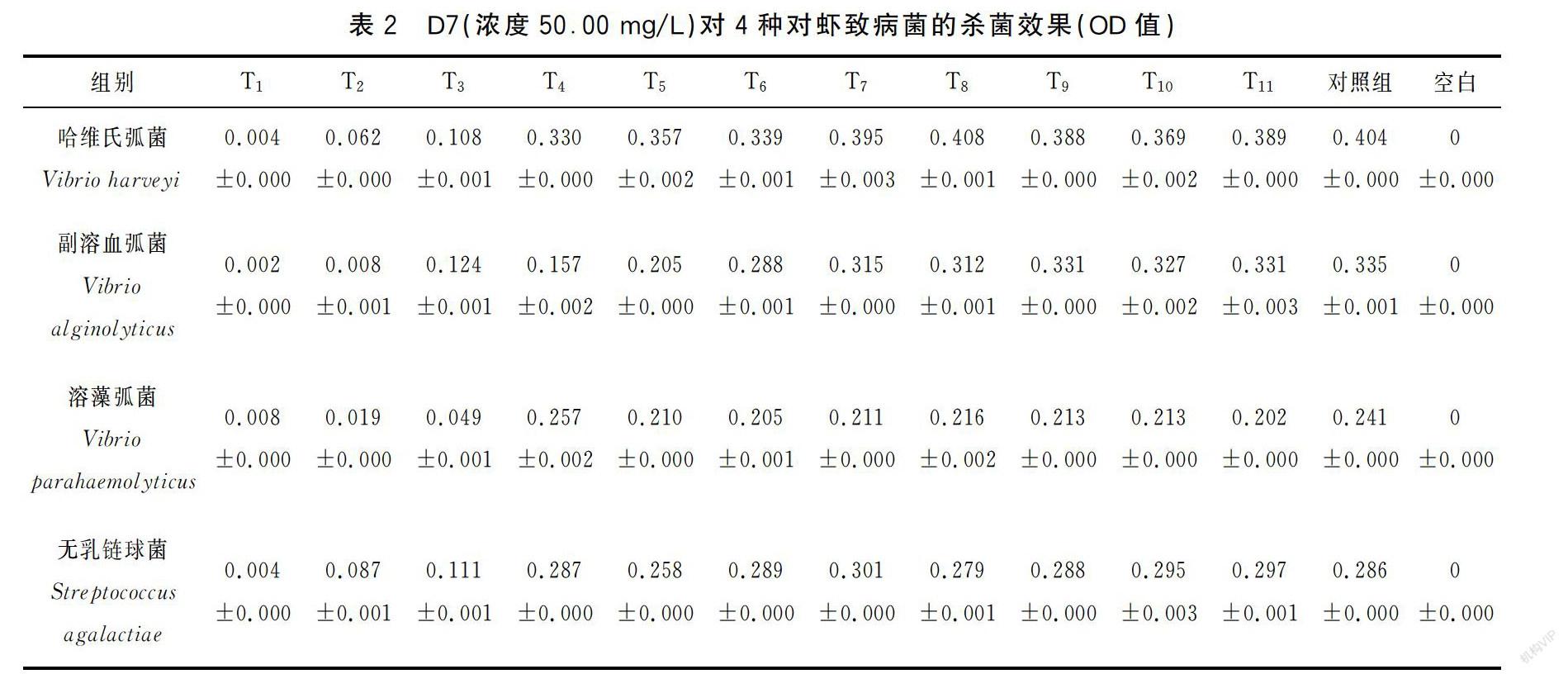
根据最小抑菌浓度试验显示,当培养基中D7浓度达到50.00 mg/L时,4种对虾致病菌的生长均明显受到抑制;由表2可知,在35 ℃条件下,四种对虾致病菌的浓度均在第4组后无显著变化,且与对照组无显著差异,即D7对哈维氏弧菌、副溶血弧菌、溶藻弧菌、无乳链球菌的最小抑菌浓度和最小杀菌浓度均为50.00 mg/L。
2.3 D7的抑菌最佳作用时间
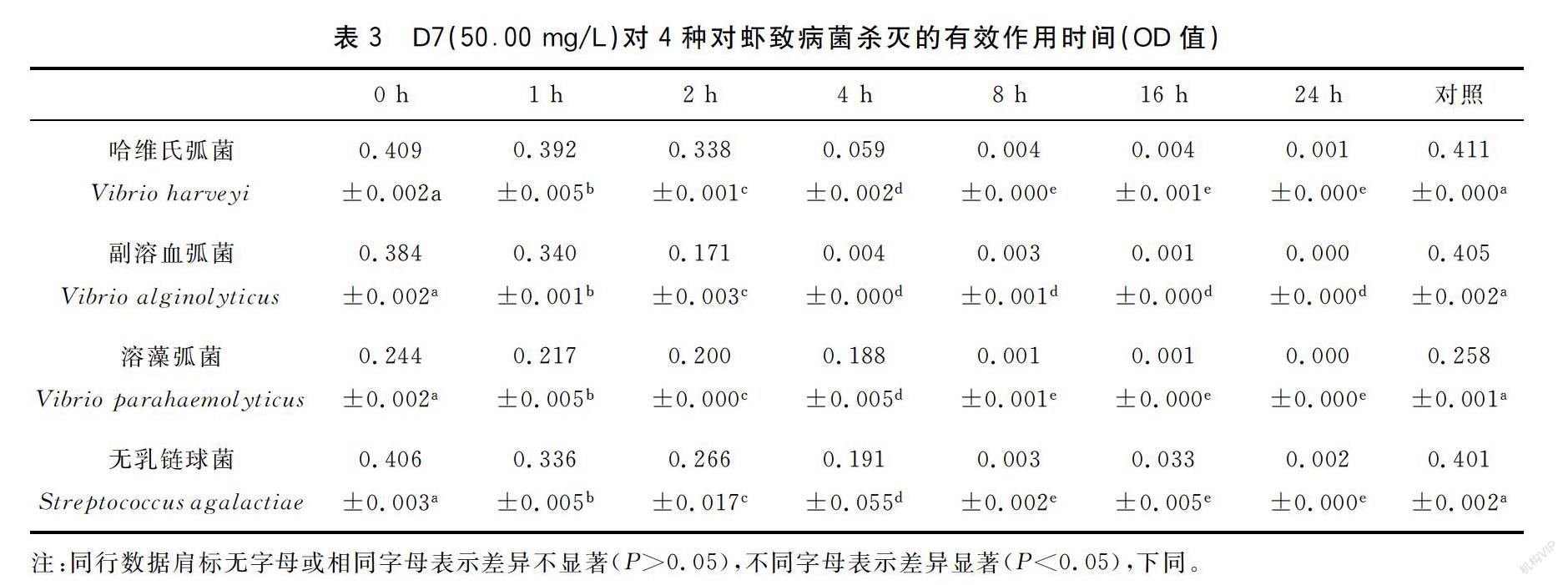
50.00 mg/L浓度D7对4种对虾致病菌的有效作用时间见表3,副溶血弧菌浓度4 h后无显著变化,故D7对副溶血弧菌的最佳作用时间为4 h;哈维氏弧菌、溶藻弧菌、无乳链球菌三种菌的浓度在8 h后无显著性变化,所以D7对这3种菌的最佳作用时间为8 h。综上所述,在使用D7(50.00 mg/L)8 h后对所有试验菌均有显著性作用,所以D7对4种对虾致病菌的最佳作用时间为8 h。
2.4 D7在不同温度下的抑菌效果试验
在3种不同温度下,D7(50.00 mg/L)对四种对虾致病菌的抑菌效果无显著性差异。见表4。
3 讨论
通过试验结果可知:在35 ℃条件下,哈维氏弧菌对D7的敏感程度为高度敏感;溶藻弧菌、副溶血弧菌对D7的敏感程度为中度敏感;无乳链球菌对D7的敏感程度为低度敏感。刘志轩等[14]、姚刚等[15]在研究中发现,弧菌相较于其他对虾致病菌对广谱性杀菌剂的耐受程度较弱,这或许与这几种弧菌的适应机制和存活策略存在差异而导致药物的有效性不同相关,其中的相关作用原理还有待今后的进一步研究。而无乳链球菌对D7的敏感程度较低,这可能与无乳链球菌的耐药性较强有关。细菌生物膜指的是存在于细菌表面,使细菌可以依附于其他物质或者使细菌之间可以相互粘连的特殊细菌结构[16],细菌生物被膜结构物质中含有藻酸盐多糖,能够保护细菌不受其他理化因子的影响,有研究表明细菌生物被膜与细菌耐药性存在密切的联系,细菌的耐药性和免疫逃逸性均与该生物结构有关[17]。丁浩[18]研究发现,无乳链球菌对药物敏感度较低,可能与无乳链球菌生物被膜有关。相关研究也表明,近年来由于水产行业抗生素类药物的滥用,使无乳链球菌的耐药性逐渐上升[19-20]。梁静真等[21]研究指出,无乳链球菌对红霉素和四环素仍较为敏感,但对硫酸新霉素和磺胺二甲嘧啶已产生了耐药性,因此,使用非抗生素类药物杀灭无乳链球菌对水产养殖的影响具有长远意义。
D7对哈维氏弧菌、副溶血弧菌、溶藻弧菌、无乳链球菌的最小抑菌浓度和最小杀菌浓度均为50.00 mg/L;D7对副溶血弧菌的最佳作用时间为4 h,D7对哈维氏弧菌、溶藻弧菌、无乳链球菌的最佳作用时间为8 h。在实际生产中,应综合考虑养殖水体中有害菌杀灭程度最大化及时间成本。在本试验条件下,水质改良灭菌剂D7对4种常见对虾致病菌具有一定的杀灭抑制效果,最佳作用时间为8 h;在正常养殖环境温度下,不同温度对D7灭菌效果无显著影响。D7的杀菌有效成分有过氧化氢、苯扎氯铵等,两成分间具有一定的协同作用。李子霞等[22]研究了过氧化氢分别与戊二醛、聚六亚甲基双胍、苯扎溴铵组成的复方消毒剂对金黄色葡萄球菌、大肠杆菌的作用,结果显示,三组混合杀菌剂在20 min内对试验对象具有良好的杀灭效果,与单方过氧化氢的杀菌效果相比较,明显较优。蔡慧玲等[23]研究表明,以过氧化氢、苯扎氯铵和起泡剂三元包装的混合即用型消毒液,其原液作用20 min对金黄色葡萄球菌、大肠杆菌、铜绿假单胞菌、溶藻弧菌和脊髓灰质炎病毒Ⅰ型疫苗株的杀灭效果均符合规范的消毒要求,这些研究与本试验得到的结果相一致,表明D7因主要成分间的协同作用而有较好的杀菌效果。
通过对水质改良灭菌剂D7的杀菌效果的研究表明,该水质改良灭菌剂在较低浓度下可快速杀灭细菌繁殖体等,使用方便,性能稳定,配方符合环保要求,且便于储存和运输,具有一定的发展前景。目前水质改良灭菌剂D7在对虾养殖生产中的具体使用场景和方法,还有待进一步探索和研究。
参考文献:
[1]
WANG R, NORASAK-NOR K, DAYNA H, et al.Effectiveness of Sanitizer D7TM against Escherichia coli O157:H7 and Salmonella biofilms[EB/OL].(2017-3-23)[2021-10-11].https://www.ars.usda.gov/research/publications/publication/?seqNo115=337624.
[2] De SCHRYVER P,DEFOIRDT T,SORGELOOS P.Early mortality syndrome outbreaks: A microbial management issue in shrimp farming?[J].PLoS Pathogens,2014,10(4):1-2.
[3] WANG D G.Rapid detection of Mycobacterium tuberculosis complex by loop-mediated isothermal amplification combined with chemosensor[J].Advanced Materials Research,2013,749:449-452.
[4] 高晓华.水产用聚维酮碘的安全性评价及其杀菌效果研究[D].上海:上海海洋大学,2013.
[5] 梁艳,郭冉,邢泽宇,等.关于唐山地区南美白对虾淡水养殖中弧菌的探讨[J].河北渔业,2018(4):27-28.
[6] 蔡完其,孙佩芳,刘至治.中华鳖爱德华氏菌病病原和组织病理研究[J].水产学报,1997,21(4):428-433.
[7] 中國国家标准化管理委员会.食品微生物学检验培养基和试剂的质量要求:GB 4789.28-2013[S].北京:中国标准出版社,2013:11.
[8] 吴芳媛,冯秋芳,林黎.食品微生物检验常用培养基配制、灭菌及贮藏研究[J].食品安全导刊,2020(36):83.
[9] 周霞霞,邱晶磊,杨广,等.传统培养法与荧光PCR法检测弧菌的方法评价[J].食品安全质量检测学报,2021,12(4):1550-1556.
[10] 赵广英,申科敏,励建荣.副溶血性弧菌增菌培养基及培养条件的改进[J].水产科学, 2010,29(3):137-140.
[11] 陈坤才,余超,李迎月,等.水产品副溶血性弧菌污染监测结果的比较分析[J].食品安全质量检测学报,2013,4(2):509-514.
[12] 刘婷,曹进,丁宏.花椒籽提取物对副溶血弧菌抑菌作用的研究[J].食品安全质量检测学报,2017,8(2):634-638.
[13] 时振东,杜洪生,苏延友.生姜、花椒及黄伞提取物抑菌效果评价[J].中国公共卫生,2009,25(1):73-75.
[14] 刘志轩,王印庚,张正,等.几种消毒剂对凡纳滨对虾致病性弧菌的杀灭作用[J].渔业科学进展,2018,39(3):112-119.
[15] 姚刚,覃映雪,邹文政,等.致病性溶藻弧菌生物膜形成特性研究[J].水产科学,2012,31(2):73-78.
[16] COSTERTOA J W.Introduction to biofilm[J].Int Antimicrob Agents,1999,11(3-4):217-221.
[17] RAMOS C, LICHT T R,STERNBERG C,et al.Monitoring bacterial growth activity in biofilms from laboratory flow chambers, plant rhizosphere, and animal intestine[J].METH ENZYMOLOGY,2001,337:21-42.
[18] 丁浩.罗非鱼无乳链球菌病防治药物的筛选[D].上海:上海海洋大学,2018.
[19] 黄艳华,马沙,韩书煜,等.2011~2016年广西罗非鱼源无乳链球菌的耐药谱型分析[J].南方农业学报,2018,49(5):1023-1031.
[20] 张行,李新圃,杨峰,等.无乳链球菌研究进展[J].中国兽医学报,2020,40(4):864-872.
[21] 梁静真,黄立春,韦慕兰,等.广西罗非鱼源无乳链球菌耐药性及其四环素耐药基因检测[J].南方农业学报,2018,49(10):2077-2086.
[22] 李子霞,辛换换,徐凤,等.三种复方过氧化氢消毒剂杀菌效果的比较[J].中国消毒学杂志,2010,27(5):535-536+539.
[23] 蔡慧玲,裴景超,胡佳,等.一種新型复方过氧化氢消毒剂的消毒效果和毒性观察[J].中国消毒学杂志,2020,37(3):161-163.
The effect of water quality improvement sterilizing agent D7 on four pathogenic bacteria of shrimp
GAO Jiapeng,GUO Ran,YU Zhiwen,HE Libin,XIA Hui,ZHU Yuzheng
(Marine College,Hebei Agricultural University,Qinhuangdao,Hebei 066003)
Abstract:In order to study the inhibitory and killing effects of water quality improvement sterilizing agent D7 on common pathogenic bacteria of shrimp, the inhibitory effect of D7 on the 4 common shrimp pathogens Vibrio harveyi,Vibrio parahaemolyticus,Vibrio alginolyticus and Streptococcus agalactiae, the best action time and the bactericidal effect of D7 under different temperature were studied through inhibition zone experiment and ecotoxicology method. The results showed that at 35 ℃, Vibrio harveyi was highly sensitive to D7, Vibrio alginolyticus and Vibrio parahaemolyticus were moderately sensitive to D7, and Streptococcus agalactiae was low sensitive to D7. The minimum inhibitory concentration and the minimum bactericidal concentration to the 4 species of bacteria were all 50.00 mg/L.The best effect time of D7 on Vibrio parahaemolyticus was 4 h, and the best effect time on Vibrio harveyi, Vibrio alginolyticus and Streptococcus agalactiae was 8 h.There was no significant difference of killing effects of D7 to the 4 species of bacteria under the temperature of 18, 28, and 35 ℃(P>0.05). It can be concluded that under the conditions of this experiment, D7 had a certain killing and inhibitory effect on the 4 common shrimp pathogens, the best action time was 8 h, and the sterilization effect did not change with the change of temperature.
Key words:water quality improvement sterilizing agent; D7;shrimp; pathogenic bacteria; antibacterial effect
(收稿日期:2021-08-20;修回日期:2021-10-12)
