中兽药复方对H9N2亚型禽流感病毒的抑制作用研究
2021-11-27黄庆华谢浩东孙世平孙守礼崔宁许传田成炳才李文峰李建和李超
黄庆华 谢浩东 孙世平 孙守礼 崔宁 许传田 成炳才 李文峰 李建和 李超
摘 要:禽流感(avian influenza, AI)是由禽流感病毒(avian influenza virus, AIV)引起的一种以侵害呼吸系统为主的疾病,是集约化养鸡场的重要疫病之一。本研究分别建立H9N2亚型AIV感染MDCK细胞和鸡胚模型,探讨研发的中兽药复方制剂对H9N2 AIV的抑制作用。结果显示,中兽药复方制剂具有良好的安全性,制剂原液和各个稀释度对鸡胚基本没有毒性,制剂原液(200 mg/mL)稀释102倍至2 mg/mL以下对体外培养的MDCK细胞基本无毒性;制剂原液(200 mg/mL)稀释104倍至0.02 mg/mL均能有效抑制H9N2 AIV在鸡胚中的增殖,稀释105倍至0.002 mg/mL仍然对H9N2 AIV在MDCK细胞上的复制具有良好的预防和治疗效果,且预防效果优于治疗效果。结果表明本研究制备的中兽药复方具有良好的抗H9N2 AIV效果。
关键词:中兽药复方;H9N2 AIV;MDCK;鸡胚
中图分类号:S853.9 文献标识码:B文章编号:1673-1085(2021)9-0005-07
流感病毒(influenza virus, IV)为RNA病毒,基因组由8条单股负链RNA构成,每个片段编码一种或两种蛋白质。表面糖蛋白血凝素(HA)和神经氨酸酶(NA)是将甲型流感病毒分为亚型的基础[1]。根据病毒HA和NA的抗原性差异,AIV可划分为18个HA亚型和11个NA亚型。H9N2亚型禽流感(avian influenza, AI)是由H9N2亚型禽流感病毒(avian influenza virus, AIV)引起的一种禽类病毒性传染病,被认为是集约化养鸡场的重要疫病之一,该病广泛分布于世界各地,威胁着养鸡业的发展,常常造成严重的经济损失[2, 3]。据统计,1996~2000年间,H9N2 AIV感染的鸡群占93.89%,这表明从19世纪末到20世纪初,H9N2是影响家禽养殖的主要亚型。直到今天,除了臭名昭著的H5N1和新兴的H7N9新秀之外,H9N2仍然是破坏家禽业的三种主要AI亚型之一。可以说,H9N2 AIV是全球家禽群体中检测到的最常见的流感病毒亚型[4]。
单纯H9N2 AIV疫苗不能100%控制发病,养殖场生物安全不到位,或者饲养管理操作不当,都会给鸡群造成一定的应激,就有可能导致禽流感爆发。同时由于病原不断产生变异,流感疫苗研发的速度往往跟不上病原变异速度,导致许多养殖场虽然免疫了疫苗,偶尔还会爆发禽流感[5]。近期,临床上出现许多呼吸道症状的家禽病例,剖检可见鸡喉头栓塞和气管环出血,通过实验室病毒分离和分子生物学检测鉴定为H9N2 AIV和其他病原如传染性支气管炎、支原体等的混合感染导致,进一步加重流感病情[6]。家禽病毒病在临床中发生后,没有特效的药物疗法,发病后及时采用对症进行治疗可显著减低动物死亡率。虽然在生产过程中适当添加抗生素可以在一定程度上降低该病病症,但应用抗生素主要是针对病毒感染引起的并发症,而且随着大量抗菌药特别是广谱抗菌药在养殖业中的广泛应用,抗菌药物的耐药性问题日趋突出[7]。我国自然资源十分丰富,中草药的使用历史可以追溯到人类文明的起源,中兽药及其副产品无疑将成为我国抗生素替代品开发得天独厚的资源。中药具有靶点多、种类多、成本低、耐药性低、副作用小等独特优势,有望在对抗AIV的过程中发挥重要作用[8]。
针对以上情况,山东省农业科学院家禽健康养殖产业技术研究院研发了一种针对家禽病毒病尤其是对呼吸系统疾病有抑制作用的中兽药复方制剂。本研究在MDCK细胞和鸡胚中评价该中兽药组方抗H9N2 AIV的作用,旨在为新药研发和临床应用提供试验依据。
1 材料
1.1 测试药物
山東省农业科学院家禽健康养殖产业技术研究院研发中兽药复方,主要由板蓝根、金银花、鱼腥草、甘草等9种中药组成,由银翘散、麻杏石甘汤、二陈汤加减,根据家禽生理特点,气管长痰液不易咳出,加强了化痰、平喘、控制炎性渗出药物;易出现肺炎、肺坏死、黑肺、肺纤维化、支气管栓塞等肺部病变,加强润肺泻肺药物;肾为生痰之根,脾为生痰之源,培土生金,补水润金,添加健脾补肾利湿药物。用传统水提法将中药复方熬制成1 mL含200 mg生药的药液(即200 mg/mL),用0.22 μm滤膜过滤除菌,以此为待测药物初始浓度。
1.2 细胞株
MDCK细胞由山东省农业科学院畜牧兽医研究所畜禽疫病防控团队病原生态学方向保存,生长液为含有5% FBS的DMEM,培养条件37 ℃含5% CO2的培养箱。
1.3 病毒株
H9N2 AIV流行株A/Chicken/Shandong/903(CK/SD/903)由山东省农业科学院畜牧兽医研究所畜禽疫病防控团队病原生态学方向分离纯化和保存。
1.4 鸡胚
SPF鸡胚购自山东省农业科学院家禽研究所SPF鸡场,在本研究室孵化至10日龄。
1.5 鸡红细胞悬液
1%鸡红血球由本研究室采集成年公鸡血液制备,用于收获的病毒液HA测定。
1.6 主要试剂、耗材和仪器
试剂包括DMEM培养基、小牛血清、青霉素(80 IU)、链霉素(100 IU)、无菌PBS等。耗材和仪器包括吸管、小试管、微量移液器、细胞培养箱、酶标仪等。
2 方法
2.1药物对细胞毒性的测定
将MDCK细胞接种于96孔板中,过夜培养,待细胞刚铺满单层,将药物用DMEM进行10倍倍比稀释,从10-1稀释到10-5共5个稀释梯度;用PBS(含双抗)溶液轻轻洗涤96孔板中的MDCK细胞3次,每孔100 μL;将不同稀释度药物加入细胞,每孔100 μL,置于37 ℃、5% CO2培养箱中维持培养3~5 d,利用CCK-8试剂盒检测细胞增殖,评价药物对MDCK细胞的毒性。
2.2药物对鸡胚的安全性评价
将药物用PBS(含双抗)进行10倍倍比稀释,从原液稀释到10-2共3个稀释梯度;按照100 μL/胚的剂量接种10日龄SPF鸡胚,去掉24 h以内死亡的鸡胚,记录鸡胚死亡情况,并在5 d后观察鸡胚发育情况,评价药物对鸡胚的安全性。
2.3 H9N2 AIV组织半数感染量(TCID50)测定
将MDCK细胞接种于96孔板中,过夜培养,待细胞刚铺满单层,将H9N2 AIV用PBS(含双抗)进行10倍倍比稀释,从10-1稀释到10-11共11个稀释梯度;用PBS(含双抗)溶液轻轻洗涤96孔板中的MDCK细胞3次,每孔100 μL;将稀释完的病毒依次接种到铺满单层MDCK细胞的96孔板中,每孔100 μL,每个病毒稀释梯度4个重复,96孔板第12排孔作为阴性对照,置于37 ℃、5% CO2培养箱中孵育2 h;吸弃96孔板中的病毒液,加100 μL PBS(含双抗)洗涤一次,弃掉洗液后每孔加入200 μL含2 μg/ml TPCK-treated 胰酶的DMEM培养液,置于37 ℃、5% CO2培養箱中培养72 h;用1%红细胞测检测细胞上清血凝效价,按Reed-Muench法计算TCID50。
2.4H9N2 AIV鸡胚半数感染量(EID50)测定
将H9N2 AIV用PBS(含双抗)进行10倍倍比稀释,从10-5稀释到10-10共6个稀释梯度,接种10日龄SPF鸡胚,每个稀释度接5枚鸡胚,每胚100 μL,去掉24 h以内死亡的鸡胚,在5 d后收集尿囊液测定病毒效价,按Reed-Muench法计算EID50。
2.5 药物在MDCK细胞上抗H9N2 AIV效果评价
根据测定的TCID50建立H9N2 AIV感染MDCK细胞模型,进行抗病毒效果评价。铺板MDCK细胞,待细胞长至80%,分为预防和治疗2个组:预防组为先在细胞中加入不同浓度中药,12~24 h接种病毒;治疗组为先接种病毒,吸附2 h后加入不同浓度中药。培养3~5 d后测定细胞上清中的血凝效价。
2.6药物在鸡胚内抗H9N2 AIV效果评价
根据测定的EID50建立H9N2 AIV感染鸡胚模型,进行抗病毒效果评价。将药物分别进行10倍倍比稀释后,与H9N2 AIV进行等量混合,按照200 μL/胚的剂量接种10日龄SPF鸡胚。去掉24 h以内死亡的鸡胚,记录鸡胚死亡情况,在5 d后收集尿囊液测定病毒血凝效价,并观察鸡胚发育情况。
3 结果与分析
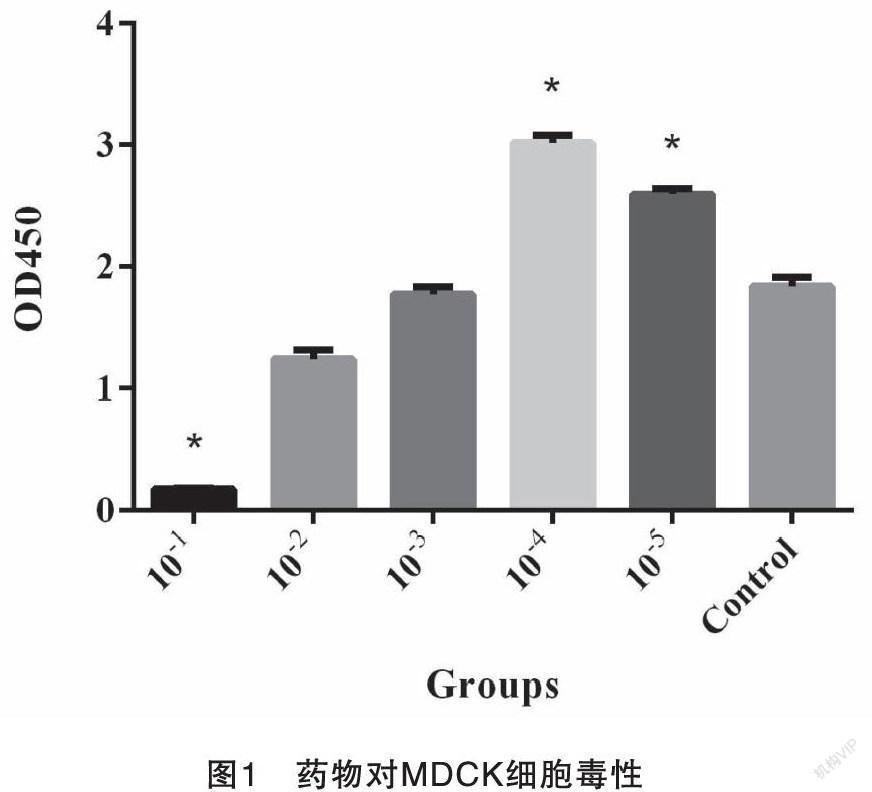
3.1 药物对MDCK细胞毒性测定结果
测定结果见图1。药物对MDCK细胞毒性作用表现为细胞折光性增加,细胞变圆、粘连、脱落、破碎,吸光值明显下降。由图1可知,该中药液进行10倍稀释对细胞毒性很大,存活细胞很少,进行102倍以上稀释未见明显的细胞毒性,进行104和105倍稀释对细胞增殖有一定的促进作用。即该中兽药复方制剂对MDCK细胞的最大安全浓度为2 mg/mL。
3.2 药物对鸡胚安全性评价
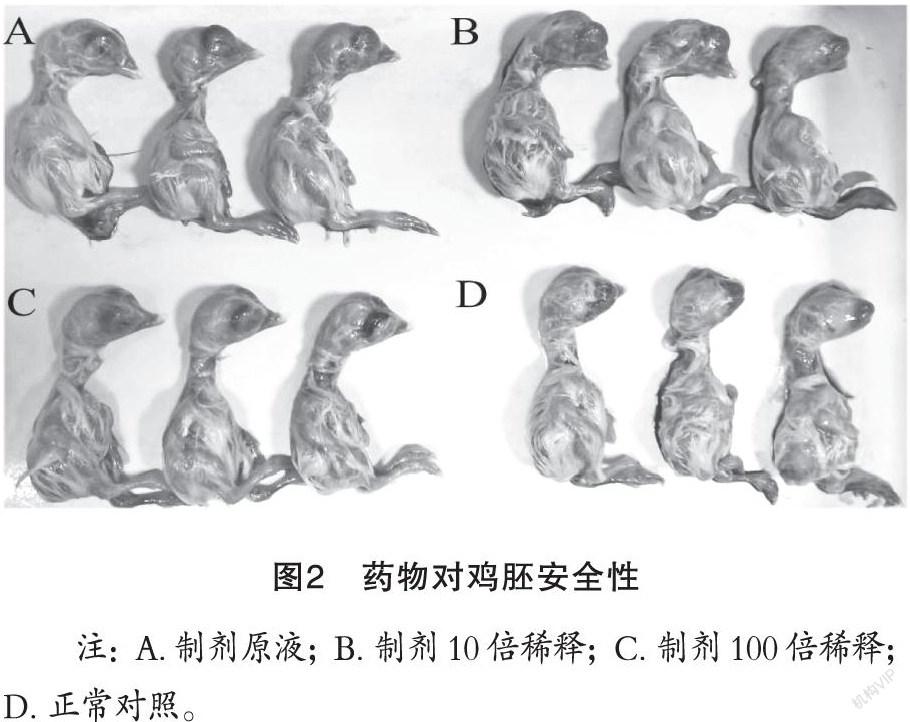
安全性试验结果见图2。与空白对照组鸡胚
(图2 D)相比,制备的中兽药制剂原液(图2 A)以及经过10倍(图2 B)和102倍(图2 C)稀释后使用,均不影响鸡胚发育,鸡胚均无死亡。由此可见,该中兽药复方制剂在200 mg/mL的剂量范围内均具有很好的安全性,对鸡胚基本没有毒性。
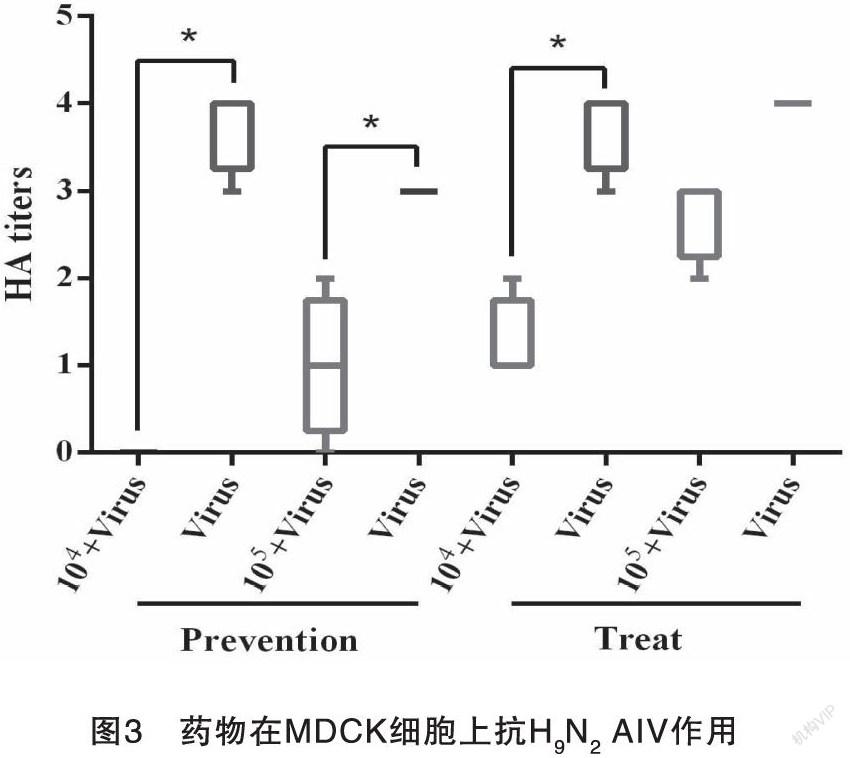
3.3 药物抑制H9N2 AIV在MDCK细胞上增殖
按照药物对MDCK细胞毒性测定结果,该中兽药制剂进行102倍以上稀释无细胞毒性。因此在MDCK细胞上进行药物抗H9N2 AIV作用评价研究需要将药物稀释102倍至2 mg/mL以上,结果见图3。在预防组中,即先加入药物后接种病毒,药物稀释104倍和105倍对病毒的预防效果分别为100%和66.7%,差异均显著(图3-Prevention)。在治疗组中,即先接种病毒后加入药物,在病毒吸附2 h后,药物稀释104倍接种MDCK细胞,药物对病毒增值的抑制率为66.7%,差异显著;病毒吸附2 h后,药物稀释105倍,接种MDCK细胞,仍然能够在一定程度上抑制病毒增值,抑制率为31.25%(图3-Treat)。结果表明该中兽药复方对H9N2 AIV的预防和治疗效果均良好。
3.4 药物抑制H9N2 AIV在鸡胚内增殖
结果如图4和表1所示,该中兽药制剂原液200 mg/mL进行101、102、103、104倍稀释后均能够有效控制H9N2 AIV在鸡胚中的复制,对鸡胚的保护率为100%,同时鸡胚发育良好,进一步说明该中兽药复方制剂具有良好的抗H9N2 AIV效果和安全性。
4 讨论与结论
本研究发明的中兽药复方组方科学严谨,在古人传统方剂基础上根据家禽生理特点和发病规律做适当加减或药效加强,理论上可以治疗多数由病毒性疾病和病原菌引起的呼吸系统疾病,H9N2 AIV引起的禽流感是造成家禽呼吸系统疾病的主要病原,它可以在MDCK细胞系和鸡胚中进行有效增殖[1],所以本研究建立H9N2 AIV感染MDCK细胞和鸡胚模型,并进一步评价了该中兽药复方对H9N2 AIV的抑制作用,旨在为呼吸系统新药研发和临床应用提供试验依据。
本研究首先评价该中兽药复方制剂对MDCK细胞的毒性作用和对鸡胚的安全性,结果表明,制备的中兽药制剂原液(200 mg/mL)进行102倍以上稀释后对细胞基本无毒性,103倍以上稀释后对细胞无毒性,中药液原液、10倍和102倍稀释后使用均不影响鸡胚发育,鸡胚均无死亡。由此可见,该中药复方具有很好的安全性,对鸡胚基本没有毒性,但进行细胞水平研究时需要进行至少102倍以上稀释。综合细胞和鸡胚的数据,该中药复方药物毒性很低,在临床应用时进行102倍以上稀释达到2 mg/mL的剂量可保证鸡群的安全性。细胞试验同时表明本研究实验方法制备的提取液对细胞有一定的毒性,这是中药普遍面临的问题[9, 10],如何去除中药中有细胞毒性的成分以获得理想的有效抗病毒成分仍有待于深入研究。
本中兽药复方是由板蓝根、金银花、鱼腥草、甘草等多种中药组方提取而成,里面的抗病毒药如板蓝根,在临床上应用广泛,具有抗菌、抗病毒的作用,可直接與流感病毒表面的血凝素结合,抑制流感病毒的活性[11],板蓝根含板蓝根总生物碱、靛玉红、落叶松树脂醇B、葡萄糖苷等活性成分,直接抑制流感病毒的核输出,通过抑制病毒介导的 NF-κB 通路的活化,抑制流感病毒诱导的炎症因子达IL-6、TNF-α、IL-8、MCP-1, IP-10等的释放[12, 13],其中的α-葡聚糖还能通过提高体液免疫和细胞免疫功能增强机体抗病毒能力[14]。金银花含木犀草苷、木犀草素等活性成分,对活化的NF-κB信号通路进行正负反馈调节,减轻炎性损伤作用,同时影响TLR信号通路及凋亡相关因子表达[15, 16]。鱼腥草和甘草含槲皮素等活性成分,通过与流感血凝素蛋白相互作用,抑制病毒与细胞融合[17]。本研究中制备的中药液原液(200 mg/mL)稀释104倍至0.02 mg/mL仍能对H9N2 AIV感染的鸡胚提供100%的保护,稀释105倍到0.002 mg/mL仍对H9N2 AIV在MDCK细胞上的复制具有良好的预防和治疗效果,且预防效果优于治疗效果。结果证实本研究制备的中兽药复方具有良好的抗H9N2 AIV效果。另外本复方根据家禽生理特点,加强了化痰、平喘、控制炎性渗出、润肺泻肺和健脾补肾利湿药物,在直接抗病毒的基础上进一步提升机体免疫力,若应用到临床应该可以收到更加显著的效果,在后续的研究中我们将通过动物实验进一步证实,并深入探讨该中兽药复方的作用机理。
综上所述,本研究制备的中兽药复方提取液对鸡胚基本无毒副作用,并能明显抑制H9N2 AIV在细胞和鸡胚中的增殖,为临床防治家禽呼吸系统疾病提供理想的抗病毒药物。
参考文献:
[1] 甘孟侯. 禽流感[M]. 第2版. 北京:中国农业出版社,2002.
[2] Swayne D E, Pantin-Jackwood M. Pathogenicity of avian influenza viruses in poultry[J]. Dev Biol (Basel), 2006,124:61-67.
[3] Chen Z, Huang Q, Yang S, et al. A Well-Defined H9N2 Avian Influenza Virus Genotype with High Adaption in Mammals was Prevalent in Chinese Poultry Between 2016 to 2019[J]. Viruses, 2020, 12(4): 432.
[4] Peacock TP, James J, Sealy JE, et al. A Global Perspective on H9N2 Avian In?uenza Virus[J]. Viruses, 2019, 11: 620.
[5] 陈照坤,鲁梅,黄小莹,等. 2016 年~2018 年山东地区25株H9N2亚型禽流感病毒分子分析[J]. 中国预防兽医学报,2019, 41(9): 958-963.
[6] Arafat N, Eladl AH, Marghani BH, et al. Enhanced infection of avian influenza virus H9N2 with infectious laryngeotracheitis vaccination in chickens[J]. Vet Microbiol, 2018,219: 8-16.
[7] 安博宇,胡蔓,徐向月,等. 兽用抗菌药耐药性风险评估研究进展[J].中国抗生素杂志,2021,46(01):27-33.
[8] 谭娅文,万海同,何昱, 等. 中药抗流感病毒的作用及机制研究进展[J]. 中国现代应用药学,2019, 36(16): 2095-2099.
[9] 郭世宁,刘天龙,李守军,等. 中药复方口服液体外抗禽流感病毒作用的研究[J].中国兽医杂志,2006(07): 41-43.
[10] 黄永霞,陈超群,MONICA ZHENG,等. 用人类诱导多能干细胞来源的心肌细胞快速检测中药毒性的方法[J].中国临床药理学杂志, 2018,34(23): 2768-2770.
[11] 吴彦霖,张媛,刘倩,等. 鸡胚尿囊膜法评价板蓝根提取液抗H1N1流感病毒活性作用[J]. 科技导报,2016, 34(13): 78-82.
[12] Zhong, Nanshan. Antiviral activity of Isatis indigotica root-derived clemastanin B against human and avian influenza A and B viruses in vitro[J]. Int J Mol Med, 2013, 31(4): 867.
[13] Li J, Liang X L, Zhou B X, et al. (+)-pinoresinol-O-β-D-glucopyranoside from Eucommia ulmoides Oliver and its anti-inflammatory and antiviral effects against influenza A (H1N1) virus infection [J]. Mol Med Rep, 2019, 19(1): 563.
[14] 文松,李倩,贾培媛,等. 板蓝根α-葡聚糖佐剂提高H1N1流感疫苗免疫小鼠体液免疫和细胞免疫功能[J].中国药理学与毒理学杂志,2014,28(06): 850.
[15] 刘晓婷,顾立刚,邓东沅,等. 黄芩苷和木犀草苷在体外对流感病毒H1N1感染A549细胞中NF-κB信号通路的调控作用[J]. 中华中医药杂志,2016,31(05): 1937.
[16] 邓东沅.木犀草素对流感病毒H1N1感染A549细胞的作用及免疫调节机制的研究[D]. 北京:北京中医药大学, 2017.
[17] Wu W , Li R , Li X , et al. Quercetin as an Antiviral Agent Inhibits Influenza A Virus (IAV) Entry[J]. Viruses (1999-4915), 2016, 8(1): 6.
