重芪结肠靶向微丸的质量控制及对DSS诱导的小鼠UC模型的干预作用研究*
2021-11-23刘天易马茂强郭功玲张学顺
刘天易,李 莉,马茂强,杨 飞,郭功玲,王 信,张学顺
(1.山东中医药大学附属医院,山东 济南 250011;2.山东中医药大学,山东 济南 250355)
溃疡性结肠炎(ulcerative colitis,UC)是一种慢性肠道炎症性肠病,发病率逐年升高,被WTO列为不治之症[1-2],其病变通常发生在乙状结肠和直肠,也可蔓延至降结肠,甚至整个结肠,病变大多局限于大肠黏膜及黏膜下层[3]。UC发病机制尚未明确,治疗策略大多采用西药治疗,西药主要由水杨酸类、糖皮质激素类、免疫抑制剂、生物制剂等组成,但UC存在病程长且易复发的特点,长期应用西药治疗毒副作用较大[4]。
重芪结肠靶向微丸(PA-CTPC)是本研究团队前期针对UC患者血性腹泻、腹痛、便血、体质量减轻等症状,以重楼总皂苷、黄芪总多糖为主要成分研制而成的中药新制剂[5]。本研究拟建立PA-CTPC中黄芪总多糖、重楼皂苷类成分的含量测定方法,并从炎症因子和黏膜屏障角度评价其对4%葡聚糖硫酸钠(DSS)诱导UC模型小鼠的干预作用,为PA-CTPC深入开发提供实验依据,为临床应用含重楼-黄芪药对治疗UC提供参考。
1 仪器与材料
1.1 试药D-无水葡萄糖对照品(批号:110833-201205,中国食品药品检定研究院);重楼皂苷Ⅰ对照品、重楼皂苷Ⅱ对照品(批号:111590-200402,111591-200402,中国食品药品检定研究院);重楼皂苷Ⅶ对照品、重楼皂苷H对照品(纯度>98%,上海源叶生物科技有限公司);PA-CTPC(自制,批号:20190410,20190515,20190618);DSS(分子量:36 000~50 000,MP biomedical公司);便潜血检测试纸(北京金华科生物技术有限公司);D-LA、DAO ELISA检测试剂盒(上海一研生物科技有限公司);IL-6、TNF-α、IL-10、IL-4 ELISA试剂盒(武汉市博士德有限公司);乙腈为色谱纯,水为纯化水,其他试剂均为分析纯。
1.2 主要仪器UV2800型紫外分光光度计(日本日立公司);DK-S24电热恒温水浴锅(上海精宏实验设备有限公司);Aglient 1260型高效液相色谱仪(美国Agilent有限公司);KQ-250型超声波清洗器(昆山市超声仪器有限公司);EP214C型万分之一电子天平(瑞士梅特勒-托利多仪器有限公司);AB135-S型十万分之一天平(瑞士梅特勒-托利多仪器有限公司);EG1150石蜡包埋机(德国Leica公司);RM2235石蜡切片机(德国Leica公司);BX50显微镜(日本Olympus公司);H1650台式高速离心机(湖南湘仪离心机仪器有限公司);DHG-9070A电热恒温鼓风干燥箱(巩义科瑞仪器有限公司);DW-86W100型超低温保存箱(北京慧龙环科环境仪器有限公司)。
1.3 实验动物6周龄SPF级雄性C57BL/6小鼠50只,体质量(20.0±1.0)g,购自济南朋悦实验动物繁育有限公司,生产许可证编号:SCXK(鲁)20140007。饲养环境:山东中医药大学附属医院动物实验中心,屏障环境饲养,使用许可证编号:SYXK(鲁)20180015。本实验经过山东中医药大学附属医院实验动物伦理委员会批准(批准号:AWE-2019-093),符合实验动物伦理标准。
2 方法与结果
2.1 黄芪总多糖的含量测定[6]
2.1.1 供试品溶液制备 取PA-CTPC适量,研细,取约2.0 g,置具塞锥形瓶中,精密加入95%乙醇溶液50 mL,超声处理(功率:250 W,频率:50 kHz)30 min,滤过,残渣挥干乙醇,取约0.5 g,精密称定,置具塞锥形瓶中,精密加入水50 mL,称定质量,超声处理(功率:250 W,频率:50 kHz)40 min,再称定质量,以水补足减失的质量,摇匀,滤过,精密量取续滤液10 mL,置25 mL量瓶中,加水稀释至刻度,摇匀,滤过,取滤液,即得。
2.1.2 对照品溶液制备 取D-无水葡萄糖对照品适量,精密称定,加水配制成约0.1 mg/mL的溶液,即得。
2.1.3 线性关系考察 精密量取0、0.2、0.4、0.6、0.8、1.0、1.2 mL的标准葡萄糖溶液(0.098 6 mg/mL),加水补至2.0 mL,加1.0 mL 5%的苯酚,再加浓硫酸10.0 mL,漩涡震荡摇匀,沸水浴加热10 min,水浴冷却后,485 nm检测吸光度(A),以葡萄糖浓度为横坐标(X),A为纵坐标(Y)绘制标准曲线。结果得到标准曲线方程:Y=0.011 5X-0.000 6,r=0.995 6,表明葡萄糖在9.86~59.16 μg/mL范围内线性关系良好。
2.1.4 测定法 精密量取供试品溶液0.5 mL,其余按照“2.1.3”项下“加水补至2.0 mL,……,485 nm检测吸光度”操作。将样品的吸光度数值代入标准曲线方程,计算黄芪总多糖含量。
2.1.5 精密度试验 精密吸取“2.1.2”项下对照品溶液1.0 mL,按“2.1.4”项下方法测定吸光度,重复测定6次,测得吸光度的RSD为0.35%,表明仪器精密度良好。
2.1.6 稳定性试验 精密吸取“2.1.1”项下供试品溶液0.5 mL,于0、2、4、8、12、24 h,按“2.1.4”项下方法测定吸光度,测得吸光度的RSD为3.45%,表明供试品溶液在24 h内稳定性良好。
2.1.7 重复性试验 取PA-CTPC(批号:20190515)适量,按“2.1.1”项下方法平行制备6份供试品溶液,按“2.1.4”项下方法测定吸光度并计算含量,结果黄芪总多糖的平均含量为150.75 mg/g,RSD为2.47%,表明测定方法重复性良好。
2.1.8 加样回收率试验 取PA-CTPC(批号:20190515)95%乙醇超声处理后的残渣6份,每份约0.25 g,精密称定,置具塞锥形瓶中,分别精密加入葡萄糖对照品约40 mg,其余操作按“2.1.1”项下方法制备供试品溶液,按“2.1.4”项下方法测定吸光度,并计算回收率。(见表1)

表1 黄芪总多糖测定加样回收率试验结果(n=6)
2.1.9 样品含量测定 按照建立的方法测定3批PA-CTPC样品中黄芪总多糖的含量,结果见表2。

表2 3批PA-CTPC样品黄芪总多糖的含量测定结果(n=3,mg/g)
2.2 重楼皂苷Ⅰ、Ⅱ、Ⅶ、H的含量测定[7-8]
2.2.1 色谱条件 色谱柱:Agilent C18色谱柱(250 mm×4.60 mm,5 μm);流动相:乙腈(A)-水(B),梯度洗脱(0~40 min,30%~60%A,40~50 min,60%~30%A);检测波长:203 nm;流速:1.0 mL/min;柱温:30℃;进样量:10 μL。
2.2.2 供试品溶液制备 取PA-CTPC适量,研细,取约0.5 g,精密称定,置于具塞锥形瓶中,精密加入乙醇25 mL,称定质量,加热回流提取30 min,放冷,再称定质量,用乙醇补足减失的质量,滤过,取续滤液,即得。
2.2.3 混合对照品溶液的制备 取重楼皂苷Ⅰ、Ⅱ、Ⅶ、H对照品适量,精密称定,加甲醇制成每1mL含重楼皂苷Ⅰ0.412 mg、重楼皂苷Ⅱ0.213mg、重楼皂苷Ⅶ0.271mg、重楼皂苷H 0.161 mg的混合溶液,即得。
2.2.4 阴性供试品溶液的制备 按处方比例,制备缺少重楼的阴性样品,并按“2.2.2”项下的方法制成阴性供试品溶液。
2.2.5 专属性试验 分别取供试品溶液、混合对照品溶液及阴性供试品溶液,按“2.2.1”项下色谱条件进行检测,结果供试品中重楼皂苷Ⅰ、Ⅱ、Ⅶ、H 4种皂苷类化学成分与相邻色谱峰的分离度均大于1.5,且保留时间与相应对照品一致;阴性供试品溶液在相同保留时间处无色谱峰,表明无其他成分干扰,方法专属性良好。(见图1)

图1 PA-CTPC中重楼皂苷类成分测定HPLC图
2.2.6 线性关系考察 取重楼皂苷Ⅰ对照品溶液(1.573 0mg/mL),重楼皂苷Ⅱ对照品溶液(0.750 4 mg/mL),重楼皂苷Ⅶ对照品溶液(0.814 0 mg/mL),重楼皂苷H对照品溶液(0.531 2 mg/mL),各精密量取0.5、1、2、4、8、10 mL,置10 mL量瓶中,用甲醇稀释配制成系列浓度,按照“2.1.1”项下色谱条件进行测定。以重楼皂苷Ⅰ、Ⅱ、Ⅶ、H对照品进样量(μg)为横坐标(X),对应峰面积(M)为纵坐标(Y),分别绘制标准曲线,得回归方程。(见表3)

表3 PA-CTPC中4种重楼皂苷类成分的回归方程及线性范围、相关系数
2.2.7 精密度试验 取“2.2.3”项下混合对照品溶液,按“2.2.1”项下色谱条件测定峰面积,重复测定6次,测得重楼皂苷Ⅰ、Ⅱ、Ⅶ、H峰面积的RSD分别为0.32%、0.48%、0.52%、1.02%,表明仪器精密度良好。
2.2.8 稳定性试验 取“2.2.2”项下供试品溶液分别于配制后的0、2、4、8、12、24 h,按“2.2.1”项下色谱条件测定峰面积,测得重楼皂苷Ⅰ、Ⅱ、Ⅶ、H峰面积的RSD分别为1.25%、0.89%、1.44%、0.69%,表明供试品溶液在24 h内稳定性良好。
2.2.9 重复性试验 取PA-CTPC(批号:20190515)适量,按“2.2.2”项下方法平行制备6份供试品溶液,按“2.2.1”项下色谱条件测定峰面积,并计算含量。结果重楼皂苷Ⅰ、Ⅱ、Ⅶ、H的平均含量分别为30.12、6.02、5.28、8.85 mg/g,RSD分别为2.58%、3.14%、1.67%、1.33%,表明测定方法重复性良好。
2.2.10 加样回收率试验 取PA-CTPC(批号:20190515)适量,研细,取6份,每份约0.25 g,精密称定,置具塞锥形瓶中,分别精密加入重楼皂苷Ⅰ对照品溶液(1.573 0 mg/mL)5 mL,重楼皂苷Ⅱ对照品溶液(0.750 4 mg/mL)2 mL,重楼皂苷Ⅶ对照品溶液(0.814 0mg/mL)2mL,重楼皂苷H对照品溶液(0.531 2 mg/mL)5 mL,按照“2.2.2”项下方法制备供试品溶液,按“2.2.1”项下色谱条件测定峰面积,并计算回收率。(见表4)

表4 重楼皂苷类成分测定加样回收率试验结果(n=6)

续表4:
2.2.11 样品含量测定 按照建立的方法测定3批PA-CTPC样品中重楼皂苷Ⅰ、Ⅱ、Ⅶ、H的含量,结果见表5。
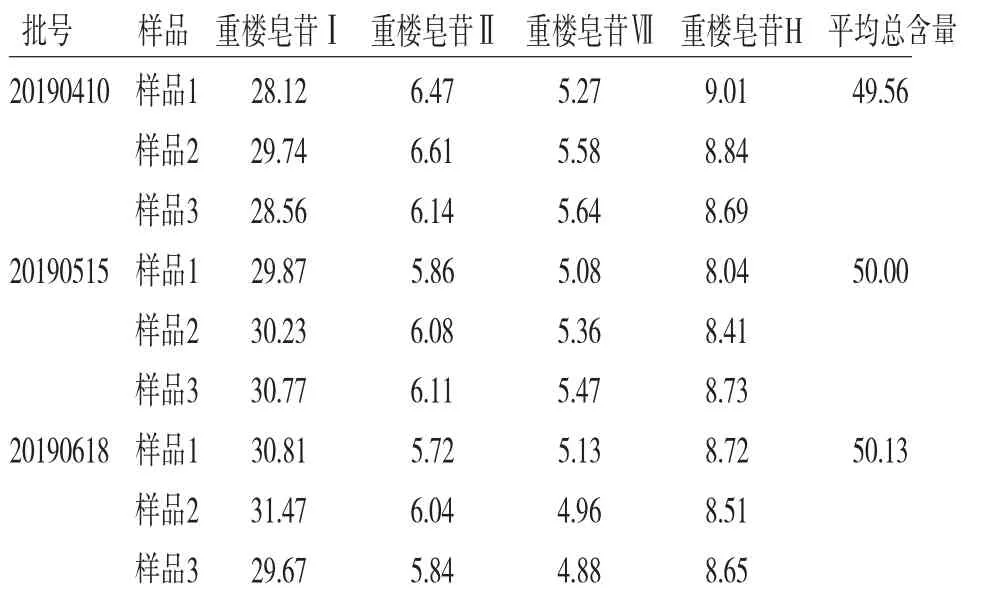
表5 3批PA-CTPC样品重楼皂苷Ⅰ、Ⅱ、Ⅶ、H的含量测定结果(n=3,mg/g)
2.3 对DSS诱导的小鼠UC模型的干预作用
2.3.1 动物造模、分组与给药6周龄雄性C57BL/6小鼠50只,适应性饲养1周后,将小鼠随机分空白组、模型组及PA-CTPC低、中、高剂量组。空白组小鼠自由饮食、饮水,第2周开始灌胃生理盐水(3 mL/d),至第2周末实验结束;模型组第1周开始以含有4% DSS的饮用水喂养小鼠,第2周开始灌胃生理盐水(3 mL/d),至第2周末实验结束;PA-CTPC低、中、高剂量组第1周开始以含有4% DSS的饮用水喂养小鼠,第2周开始每天分别灌胃给予0.1、0.2、0.4 mg/g的PA-CTPC,至第2周末实验结束。
2.3.2 统计学方法 采用SPSS 20.0统计学软件进行统计分析。计量资料以“均数±标准差”(±s)表示,多组间比较采用单因素方差分析,方差齐的采用SNK检验,方差不齐的采用Dunnet t检验,P<0.05为差异有统计学意义。
2.3.3 小鼠疾病活动指数(DAI)评分 每天观察并记录各组小鼠体质量变化情况、粪便性状、便血情况,并进行DAI评分[9]。结果表明,空白组小鼠饮食正常,粪便性状正常,毛色光亮,精神良好;模型组和PA-CTPC低、中、高剂量组小鼠在饮4% DSS后逐渐出现毛色无光、便稀的情况,部分小鼠肛门处出现红肿迹象,进而加重为腹泻、便血等症状。模型组和PA-CTPC低、中、高剂量组小鼠的食物消耗量均不同程度的减少,且存在好懒恶动的现象。与空白组比较,模型组小鼠DAI评分明显升高(P<0.01)。给药7 d后,PA-CTPC低、中、高剂量组小鼠便血、体质量下降等情况均不同程度减轻,PA-CTPC中、高剂量组小鼠DAI评分明显降低(P<0.05或P<0.01)。(见表6)
表6 各组小鼠DAI、结肠组织大体形态、病理学评分比较(±s,分)

表6 各组小鼠DAI、结肠组织大体形态、病理学评分比较(±s,分)
注:与空白组比较,aP<0.01;与模型组比较,bP<0.05,cP<0.01
组别 动物数(只)给药剂量(mg/g)DAI评分 形态评分 组织病理学评分空白组 10 - 0 0 0.14±0.04模型组 10 - 2.89±0.31a 3.41±0.53a 2.43±0.25a PA-CTPC低剂量组 10 0.1 1.85±0.27 3.24±0.62 2.13±0.66 PA-CTPC中剂量组 10 0.2 1.31±0.17b 1.99±0.47c 1.74±0.64b PA-CTPC高剂量组 10 0.4 1.10±0.18c 1.26±0.59c 0.86±0.25c
2.3.4 结肠组织大体形态及病理学评分 将小鼠脱颈椎处死后,自盲肠部位开始至肛门口处取出整个肠段,沿肠系膜缘纵向剪开,用冰生理盐水冲洗干净,滤纸吸干,进行结肠组织大体形态评分[10],结肠组织采用多聚甲醛固定48 h后,组织常规石蜡包埋、切片,HE染色,置于光学显微镜下观察小鼠结肠组织病变情况,并按照OBERMEIER F等[11]介绍的评分标准进行病理学评分。结果显示,空白组小鼠结肠外形完整,结肠黏膜腺体排列整齐,上皮细胞基本完整。与空白组比较,模型组小鼠存在结肠浮肿、充血和粒状糜烂的情况(P<0.01);与模型组比较,PA-CTPC各剂量组小鼠结肠组织病理形态均有一定程度的好转,PA-CTPC低剂量组小鼠结肠形态、组织病理评分与模型组比较,差异无统计学意义(P>0.05),PA-CTPC中、高剂量组结肠组织形态、病理评分明显降低(P<0.05或P<0.01)。(见表6、图2)

图2 各组小鼠结肠组织形态学比较(HE,×100)
2.3.5 血清IL-6、TNF-α、IL-10、IL-4、D-LA、DAO水平检测 第15天时,腹腔注射水合氯醛将小鼠麻醉,摘眼球取血,8 000 r/min离心10 min,分离血清并置-80℃冰箱中保存,按ELISA试剂盒说明书操作检测血清中IL-6、TNF-α、IL-10、IL-4、D-LA、DAO含量。结果显示,模型组小鼠血清IL-6、TNF-α、D-LA、DAO水平明显高于空白组(P<0.01),IL-10、IL-4水平明显低于空白组(P<0.01);与模型组比较,PA-CTPC中、高剂量组小鼠血清IL-6、TNF-α、D-LA、DAO水平明显降低(P<0.01),IL-10、IL-4水平明显升高(P<0.05或P<0.01),PA-CTPC低剂量IL-6、IL-10、IL-4、D-LA、DAO水平与模型组比较,差异均无统计学意义(P>0.05)。(见图3)

图3 各组小鼠血清IL-6、TNF-α、IL-10、IL-4、D-LA、DAO水平比较(±s,n=10)
3 讨 论
黄芪总多糖是重芪结肠靶向微丸的主要药效成分之一,目前其常用的含量测定方法主要为紫外分光光度法,主要有苯酚-硫酸法、蒽酮-硫酸法、3,5-二硝基水杨酸法等,本研究在对以上3种方法进行考察基础上,选用苯酚-硫酸法测定制剂中黄芪总多糖的含量,并对反应时间、反应温度、测定波长等进行了考察,建立的黄芪总多糖含量测定方法稳定、准确、可行。测定总多糖的含量只是多糖类成分质量控制的一个方面,相关学者还采用HPLC法检测多糖衍生化后单糖组成及其含量、采用高效凝胶渗透色谱法测定多糖相对分子质量及其分布、采用薄层色谱法检查游离单糖、采用气相色谱串联质谱法和核磁共振波谱对糖苷键连接位置及构型进行判断等进行多糖成分的质量控制[12],随着分析技术的不断成熟,后续将会进一步完善本制剂中黄芪总多糖的质量控制方法。
重楼主要活性成分为甾体皂苷类成分,2015年版《中华人民共和国药典》以重楼皂苷Ⅰ、Ⅱ、Ⅵ和Ⅶ作为质控指标,然而相关研究表明重楼皂苷Ⅵ在正品云南重楼或七叶一枝花中含量较低或不含,而在近缘种植物球药隔重楼及延龄草或吉林延龄草中含量较高,并建议去除重楼皂苷Ⅵ,增加重楼皂苷H作为含量测定指标[13],因此,本研究选择重楼皂苷Ⅰ、Ⅱ、Ⅵ和H作为本制剂中重楼皂苷类成分的测定指标。
本研究采用4.0%DSS水溶液给予小鼠自由饮用7 d,成功复制了UC模型。模型组小鼠DAI评分、结肠组织大体形态及病理学评分与空白组比较,差异均有统计学意义。在造模成功后给予PA-CTPC药物干预,PA-CTPC中、高剂量组小鼠DAI评分、结肠组织大体形态及病理评分明显降低,表明PA-CTPC对DSS诱导小鼠形成的UC症状具有明显的治疗作用。
细胞因子在UC的发病机制中扮演重要的角色,其中促炎因子(TNF-α、IL-1β、IL-6、IFN-γ等)和抗炎因子(IL-4、IL-10等)两者间的调节失衡与UC的发病密切相关[14]。本研究采用ELISA法测定小鼠血清IL-6、TNF-α、IL-10、IL-4水平,结果PA-CTPC中、高剂量组能明显降低模型组小鼠血清IL-6、TNF-α,明显升高IL-10、IL-4水平,表明PA-CTPC能调整小鼠UC模型促炎、抗炎因子水平,发挥抗炎作用。现代医学研究发IL-6/JAK2/STAT3信号通路可调控免疫与炎症反应,在UC的发生、发展及转归中发挥了重要作用[15-16],基于本研究结果,后续将对PA-CTPC干预IL-6/JAK2/STAT3信号通路进行研究,分析探寻其治疗UC的可能的靶点及作用机制。
UC发病过程中多种效应细胞释放细胞因子和炎症介质会促进肠黏膜损伤[17-18]。二胺氧化酶(DAO)可在肠道黏膜上皮细胞损伤时被释放入血,血清DAO水平可间接反映肠道黏膜上皮细胞损伤的程度[19]。肠道D乳酸(D-LA)可通过受损黏膜入血,血清中D-LA水平高低可间接反映肠道黏膜通透性的变化[20]。本研究结果表明中、高剂量PA-CTPC能显著降低模型小鼠血清DAO、D-LA水平,说明PA-CTPC在一定程度上可改善肠道黏膜屏障功能。
综上所述,本研究以黄芪总多糖及重楼皂苷Ⅰ、Ⅱ、Ⅶ、H的含量测量,建立了PA-CTPC的质量控制方法,并初步证明PA-CTPC可通过降低血清中促炎因子的表达,升高抗炎因子水平,改善肠道黏膜屏障功能,发挥其对UC小鼠的治疗作用。本研究为PA-CTPC深入开发提供了实验依据,为临床含重楼-黄芪药对应用治疗UC提供了参考。
