MIRA-LFD鉴别肉制品中鸭源性成分的方法研究
2021-11-17尚柯张敏张彪王巍段庆梓张玉雍溶叶梅
尚柯,张敏,张彪,王巍,段庆梓,张玉,雍溶,叶梅*
(1.成都市食品药品检验研究院,四川 成都 611135;2.湖南大学生物学院,湖南 长沙 410012)
随着市场全球化及贸易自由化的不断发展,消费者对肉制品产品质量和真实性越来越重视,肉制品安全提升到一个新的高度[1-2],食品领域经济利益驱动型掺假行为对食品安全和食品贸易造成严重危害[3]。目前,肉制品的掺假主要表现为原料肉掺假、组织替换等[4],这些真实性问题不但侵害了消费者利益,而且给肉制品食用安全带来潜在危害,同时也可能带来宗教信仰和道德标准方面的风险[5]。因此,肉制品动物源性成分检测变得越来越重要,核酸检测可以从样品中检测出痕量目标分子,具有灵敏性和特异性等诸多优势,已成为食品真实性研究中必要的技术手段[6],并在检测领域中得到广泛应用。但是,传统的核酸检测技术对实验室环境、仪器及人员要求较高,无法满足现场检测监管需求。近年来,重组酶聚合酶扩增技术(recombinase polymerase amplification,RPA)[7]发展迅速[8],在医疗诊断[9-11]、农业[12-14]、食品[15-16]等方面的应用越来越广泛,该技术的快速发展促进了核酸检测在现场中的应用,因不需要高温变性、退火等步骤,对精密仪器依赖程度大大降低,是实现现场即时检测的有效技术手段。
多酶恒温快速扩增技术(multienzyme isothermal rapid amplification,MIRA)是在RPA技术基础上发展起来的一种新型恒温核酸扩增方法,在37℃条件下,重组酶和引物形成蛋白/单链核苷酸的复合体Rec/ss-DNA,在辅助蛋白和单链结合蛋白(single strand DNA-binding protein,SSB)的帮助下,侵入双链DNA模板;在侵入位点形成D-loop区域,并开始对DNA双链进行扫描;待找到与引物互补的目的区域后,复合体Rec/ssDNA解体的同时,聚合酶也结合到引物的3′末端,开始链的延伸,依赖核酸内切酶(nfo酶)的作用,加入根据模板设计的特异性分子探针,结合胶体金核酸检测试纸条(lateral flow dipstick,LFD)从而实现扩增产物快速检测,该方法与侧流式胶体金法有机结合,不仅能达到简捷、灵敏、特异的检测目的,而且能更好地为现场动物源性成分检测提供可视化应用服务。多酶恒温快速扩增技术原理见图1。
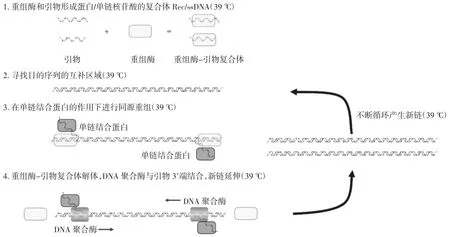
图1 多酶恒温快速扩增技术原理图Fig.1 Schematic diagram of multienzyme isothermal rapid amplification
MIRA技术在用于鸭源性检测方面具有多项优势[17]:在特殊酶的作用下,DNA模板不需要高温循环变性扩增,对仪器的要求大大降低[18];具有快速反应的特点,样本与试剂一接触便开始反应,20 min内即可获得检测结果[19];可检测单链DNA与双链DNA,检测范围较广[20];目前商品化试剂盒较多,操作简便,无需复杂的培训即可开展检测工作。因此,MIRA技术用于鸭源性检测具备良好的适用性。
本研究旨在提高肉制品中鸭源性成分检测方法的可操作性,建立健全肉制品动物源性的检测方法,针对鸭肉制品建立专属性多酶恒温侧流式扩增技术(MIRA-LFD)检测方法,为鸭源性成分现场检测提供技术支撑。
1 材料与仪器
1.1 材料与试剂
动物基因组提取试剂盒:上海捷瑞生物工程有限公司;DNA恒温快速扩增试剂盒:潍坊安普未来生物科技有限公司;侧流式胶体金试纸条:德国Milenia Biotec公司;引物及探针:生工生物工程(上海)股份有限公司。
1.2 仪器与设备
Milli-Q Academic实验室超纯水仪:美国Millipore公司;MM400行星球磨仪:德国Retsch公司;Cen-trifuge 5427 R高速冷冻离心机:德国Eppendorf公司;ME2002E电子天平:瑞士Mettler Toledo公司;BSA224S电子天平:德国赛多利斯公司;MK3涡悬振荡器:德国IKA公司;P330核酸蛋白定量仪:德国Implen公司;Thermo-Shaker BG-100干式恒温器:杭州瑞诚仪器有限公司;GelDoc-It凝胶成像仪:美国UVP公司。
1.3 样品信息
本试验所用样品包括猪、牛、羊、鸡、鸭、鹅、狐狸、貂、猫、海狸鼠共10个物种。样品采自养殖厂、研究所、农贸市场、电商、超市等。所有样品通过合成引物[21-22]进行线粒体基因测序验证,保证样品的真实性[23]。
2 试验过程
2.1 引物探针设计
鸭源性CYTB基因序列和核糖体12S基因序列来自Genbank网站(登录号为L07521.1和U59666.1),并上传至网站进行序列对比,对比结果见图2和图3。
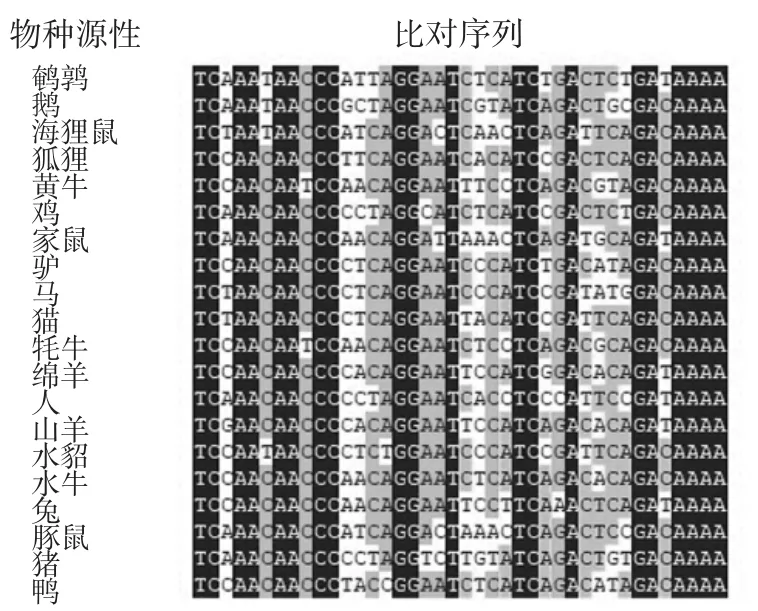
图2 鸭CYTB基因比对结果Fig.2 Comparison of duck CYTB gene
图2~图3对比结果表明CYTB基因和核糖体12S基因对于鸭源性检测有良好的特异性,可用于设计鸭源性检测的特异MIRA引物和探针。在引物设计时,选择碱基排布随机性高、鸟嘌呤和胞嘧啶所占比率在30%~70%之间的引物序列,并且在下游引物的5′端标记生物素(biotin)修饰基团;对于MIRA法的探针序列,应避免回文序列、内部二级结构和连续的重复碱基,长度一般在 46 nt~52 nt,在 5′端修饰一个 6-羧基荧光素(6-carboxyfluorescein,FAM)标记,在距 5′端约30 nt序列位置上标记一个四氢呋喃(tetrahydrofuran,THF),作为核酸内切酶的识别位点,另外THF距离3′末端约15 nt,并且3′末端标记一个C3-spacer修饰基团。
根据以上设计原则,共设计11条引物及所对应的2条探针,引物名称及序列如表1所示。

表1 引物探针信息Table 1 Details of primers and probe
按照不同目的片段来源将这些引物探针分为a组(CYTB基因)和b组(核糖体12S),在a组和b组内对这些引物和探针开展3×3试验,共15个组合,以期获得最适合的引物探针。引物探针正交组合见表2。
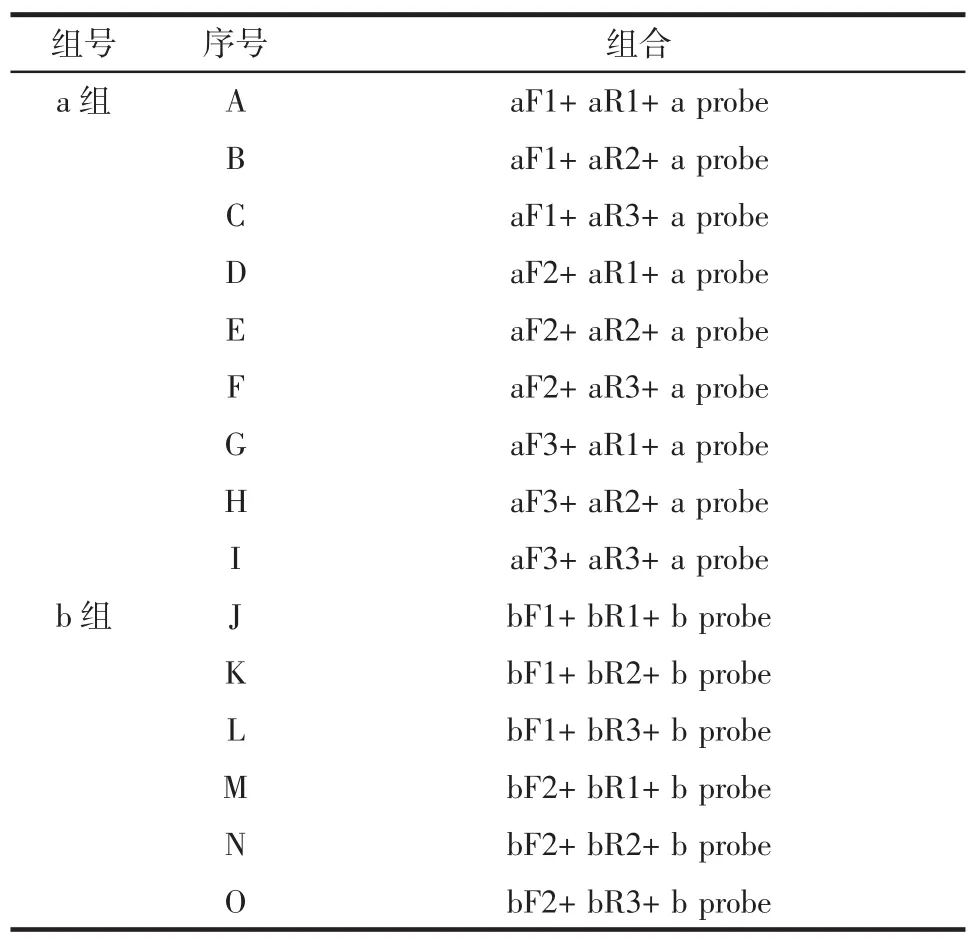
表2 引物探针正交组合Table 2 Orthogonal combinations of primers and probe
2.2 MIRA-LFD方法建立
2.2.1 DNA提取
按照DNA提取试剂盒说明书对样品进行基因组提取,用核酸蛋白定量仪确定DNA提取的效率与纯度,进行OD260/OD280值测定,测得值均在1.7~2.0之间,表明可用于后续试验。
2.2.2 阳性对照试验
MIRA阳性对照反应体系(50 L)包括29.4 L的A缓冲液,1.0 μL鸭源性核酸模板和2.5 μL B缓冲液,每套引物各 0.25 μL,并用去离子水补齐 50 μL,设立以去离子水为DNA模板的空白对照组;同时以MIRA试剂盒提供的正对照模板单元作为试验质控对照。正对照体系配制:正对照模板加入2 μL,引物加入4 μL正对照引物Mix(包含上/下游引物),其它组分如上体系配制。产物用3%琼脂糖凝胶做水平电泳,并用凝胶成像系统拍照记录结果。
2.2.3 空白对照试验
MIRA-LFD 空白对照反应体系(50 μL)包括29.4 μL 的 A 缓冲液,1.0 μL 去离子水和 2.5 μL B 缓冲液,每套引物各 0.25 μL,探针 0.075 μL,并用去离子水补齐50 μL。其中,空白对照为去离子水。
2.2.4 阴性对照试验
MIRA-LFD阴性对照反应体系(50μL)包括29.4 μL的A缓冲液,1.0 μL阴性对照核酸模板和2.5 μL B缓冲液,每套引物各 0.25 μL,探针 0.075 μL,并用去离子水补齐50 μL。其中,阴性对照分别为猪、牛、羊、鸡、鹅、狐狸、貂、猫和海狸鼠样品提取的DNA模板。
2.3 检出限试验
称取200 mg左右的鸭肉和鸡肉组织,分别转移至2.0 mL的离心管中。然后向每个离心管加入400 mg ACL溶液(由DNA提取试剂盒提供)和20 mg的蛋白酶K溶液(由DNA提取试剂盒提供)。充分振荡混匀,置于55℃过夜裂解,直至样品裂解完全。检出限试验样品信息见表3。
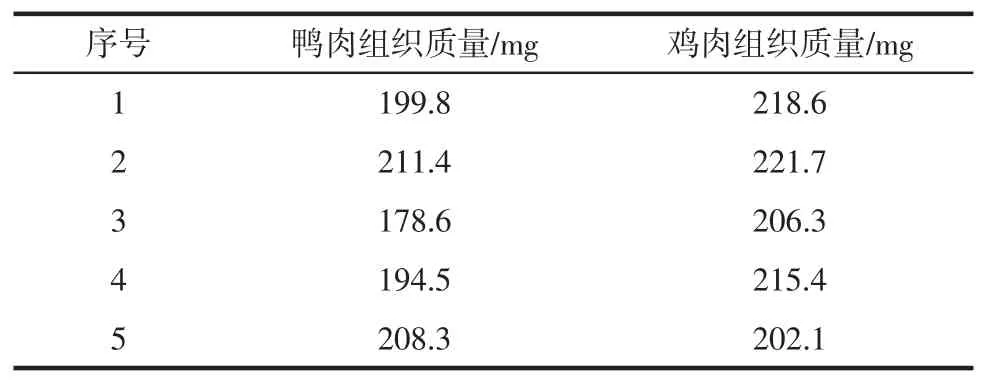
表3 检出限试验样品信息Table 3 Sample information of detection limit experimental
样品完全裂解后,按照如下公式计算1 mg相应的组织材料所对应的裂解液质量(x),以鸭肉组织裂解液为样品,以鸡肉组织裂解液为本底配制10%、1%、0.1%和0.01%(质量比)的模拟样本。分别对这些模拟样本进行DNA提取,依照建立的方法进行试验。
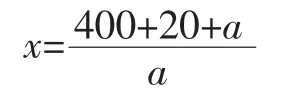
式中:x为1 mg相应的组织材料所对应的裂解液质量,mg;a为供试样品组织质量,mg。
2.4 MIRA-LFD与荧光定量PCR结果对比
荧光定量 PCR反应[24]采用 25 μL体系,包括12.5 μL的 2×MasterMix,上游引物 FP(5′-GGCCACACAAATCCTCACAG-3′,900 nmol/L)、下游引物 RP(5′-TGTGTTGGCTACTGAGGAGAAA-3′,900 nmol/L)和探针(5′-FAM-CCTACTGGCTATGCACTACACCGCAGACTAMRA-3′,250 nmol/L)各 2.0 μL,所用 DNA 模板与2.3中相同,用去离子水补齐25 μL。荧光定量PCR反应条件 50℃ 2 min→95℃ 10 min→40×(95℃ 15 s→60℃1 min)收集荧光信号。检测结束后,根据扩增曲线和循环阈值(cycle threshold,Ct)读取结果。
3 试验结果
3.1 阳性对照试验结果
鸭CYTB基因阳性对照正交试验比对结果见图4。鸭核糖体12S阳性对照正交试验比对结果见图5。
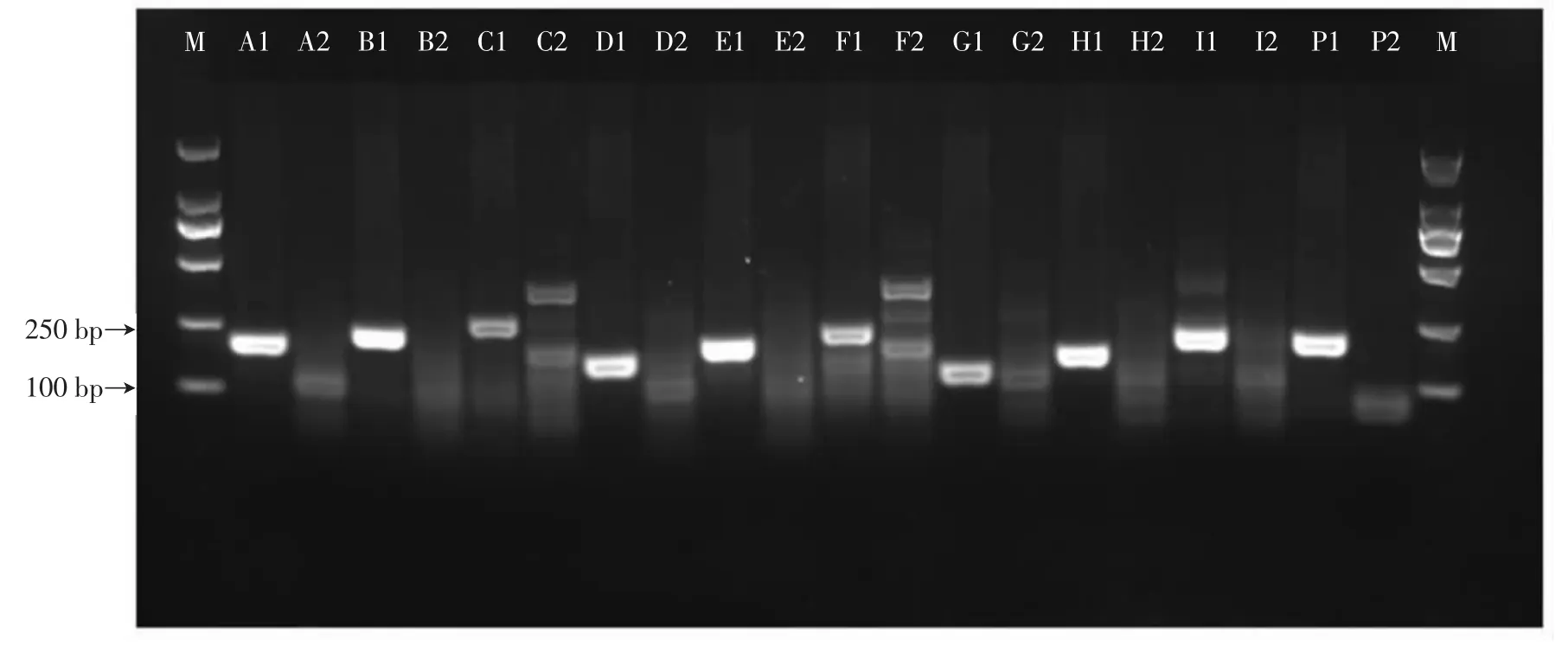
图4 鸭CYTB基因阳性对照正交试验比对结果Fig.4 Comparison results of duck CYTB gene positive control by orthogonal experiment

图5 鸭核糖体12S阳性对照正交试验比对结果Fig.5 Comparison of duck ribosomal 12S gene positive control by orthogonal experiment
由图4、图5可知,比较表2中的15套引物与试剂盒配套阳性对照结果,15对引物组合阳性对照均出现条带,但其中C、F组合空白对照结果出现明显引物二聚体,因此筛选其它13对组合与相应的探针进行空白对照试验。
3.2 空白对照试验结果
向阳性对照试验筛选出的13对引物加入其相对应探针进行MIRA-LFD反应,试验结果如图6所示。
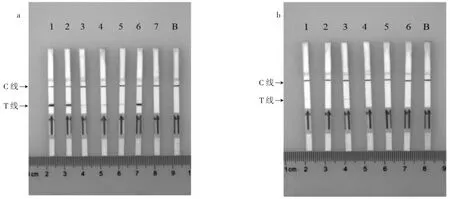
图6 鸭源性空白对照正交试验结果Fig.6 The results of duck derived blank control by orthogonal experiment
图6为15对鸭源性引物探针MIRA-LFD空白结果,4对引物探针组合空白对照未出现T线,表明未出现非特异结合;其余11对引物探针均出现T线,因此选择4对未出现T线的引物探针组合(组合I、K、M、N)进行后续试验。
3.3 阴性对照试验结果
根据以上试验结果,筛选空白对照中未出现检测线(T线)的引物探针组合进行阴性对照试验。其中,试验对象分别为猪、牛、羊、鸡和鸭样品提取的DNA模板。胶体金结果如图7所示。

图7 阴性对照筛选预试验Fig.7 Negative results pre-test
如图7中的4对引物探针阴性对照结果,组合N阴性对照未出现T线,表明未出现非特异结合。在此基础上增加阴性对照物种数,进一步考察这对引物探针组合的特异性,胶体金结果如图8所示。

图8 阴性对照筛选试验Fig.8 Negative results test
如图8所示,组合N在牛、羊、猪、鸡、鹅、狐狸、貂、猫和海狸鼠为阴性,表现出良好的特异性,未出现明显的非特异性结合,因此将组合N作为MIRA-LFD方法检测鸭源性成分的引物探针组合。
3.4 检出限试验与对比试验结果
检出限试验是通过将鸭肉酶解液与鸡肉酶解液混合制备得到的不同浓度的模拟样品(10%、1%、0.1%和0.01%,质量比),以比较MIRA-LFD法同荧光定量PCR法在检测鸭源性成分时的最低检出限,试验结果如图9所示。
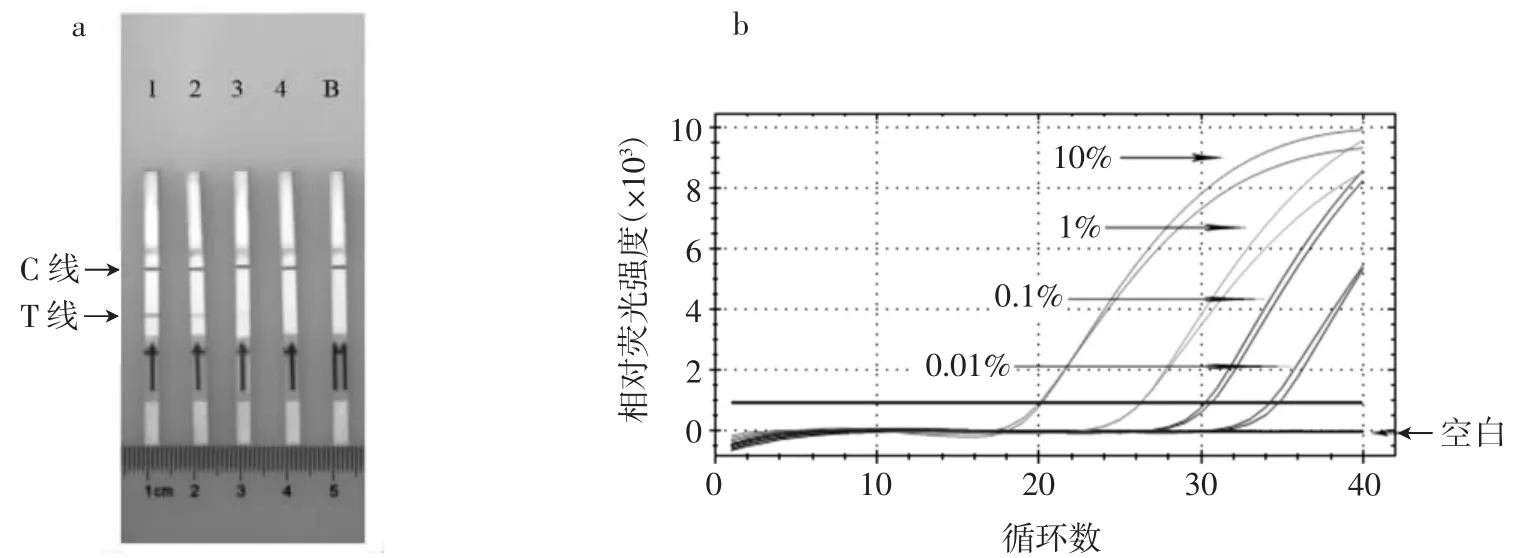
图9 检出限比对试验结果Fig.9 Comparison of detection limit results
由图9可知,MIRA-LFD模拟样品在鸭源性成分为0.1%时仍能呈现阳性结果,说明模拟样品的检测限为0.1%,与荧光定量PCR法结果一致。但是在现场检测中,胶体金0.1%结果颜色较浅,不易辨别,因此鸭源性成分MIRA-LFD检测线为1%。
4 讨论与结论
等温扩增技术近几年的发展非常迅速,在分子检测领域越来越重要,但是由于相关软件支持的滞后,引物探针的设计还停留在人工检索阶段。MIRA-LFD检测方法源于RPA技术,筛选引物的过程中,不但一些阳性结果出现了大小不一的非特异性条带,一些空白结果也出现了弥散条带,后期试验说明该检测方法需要找到反应后无非特异性条带,且在空白对照中特异性条带的位置上无条带出现的引物。在筛选引物的过程中,能够满足条件的引物较少,为此进行了大量的正交试验,花费时间较多。
本研究成功筛选出肉制品中鸭源性成分的MIRA-LFD检测体系的最优引物探针组合,与此同时,对所筛选方法的特异性、检出限分别进行了评价,证明了该组合所建立的检测体系特异性强、灵敏度高。通过与现行实验室检测方法进行比对试验,进一步验证了该方法实际应用的有效性,在实际工作尤其是现场检测中具有广阔的应用前景。
