红景天苷抑制淀粉样β蛋白聚集和降低其细胞毒性的研究
2021-11-17郝斯佳韩爱玲杨亚瑜方国臻刘继锋王硕
郝斯佳,韩爱玲,杨亚瑜,方国臻,刘继锋*,王硕,2*
(1.天津科技大学食品营养与安全国家重点实验室,天津 300457;2.南开大学医学院,天津 300071)
多酚化合物具有很强的缓解神经毒性和抑制神经退行性疾病的潜力[1-2]。近年来,一些研究表明,膳食多酚与神经退行性疾病相关的严重并发症呈负相关,并在一些治疗中起到积极的作用,可以减轻这类疾病带来的有害影响[3-4]。神经疾病的病理复杂,发病诱因不完全清楚,市面上现有的药物尚不能根治这类疾病,只能在一定程度上起到缓解作用[5]。人体组织中淀粉样蛋白的形成和沉积在病理上与许多蛋白质错误折叠疾病呈正相关,例如阿尔兹海默症[6-7]。阿尔兹海默症是老年痴呆最常见的一种形式,其病理特征是患者大脑中细胞内tau蛋白神经纤维缠结和细胞外β-淀粉样蛋白(amyloid β-peptide,Aβ)聚集形成老年斑[8]。Aβ是由β和γ分泌酶连续切割淀粉样前体蛋白而产生的,一般包含39个~43个氨基酸,Aβ40和Aβ42是最常见的两种结构,Aβ40约占总量的90%且容易聚集成纤维,而Aβ42则具有较高的毒性[9]。很多研究表明,阿尔兹海默症患者大脑中Aβ聚集形成富含β-折叠结构的纤维与发病机制密切相关[10-11]。所以,开发一种抑制剂在早期阶段抑制Aβ聚集是治疗和防治阿尔兹海默症的潜在治疗策略。
红景天苷是从红景天的根中提取出来的有效成分,在亚洲国家的传统民间医药中被广泛应用。红景天苷因其多种功能特性而被广泛应用于抗氧化、抗凋亡、抗肿瘤、抗疲劳、抗抑郁和保护肝脏等,越来越多的研究指出,红景天苷还对大脑的神经损伤具有保护作用,也能保护神经元免受谷氨酸诱导的氧化应激和凋亡[12-15]。Zhang等[16]研究表明,红景天苷可以通过限制通路来抑制细胞焦亡从而实现对多巴胺神经元的保护,最后起到延缓帕金森疾病的作用。Wang等[17]研究表明,红景天苷对阿尔兹海默症模型小鼠受损的神经元突触具有保护作用。Li等[18]研究表明,红景天苷通过调节PKC/p38MAPK通路来实现对阿尔兹海默症模型小鼠神经的保护作用。虽然红景天苷已被证明对认知障碍具有一定的调节作用,但是尚没有详细的红景天苷对Aβ40早期聚集的影响和对其诱导的细胞毒性的缓解作用的研究。
在本文中,采用ThT荧光、刚果红和透射电子显微镜试验考察红景天苷对Aβ40纤维形成的抑制作用。利用圆二色谱试验研究红景天苷对Aβ40构象转变的影响,3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑盐 [3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT]试验检测红景天苷的毒性和对Aβ40诱导的细胞毒性的缓解作用,最后利用分子对接试验模拟红景天苷和Aβ40的结合位置,简要地分析抑制原理。
1 材料与方法
1.1 材料与试剂
β-淀粉样蛋白 40(amyloid β-peptide 40,Aβ40)(人源):美国APExBIO科技有限责任公司;红景天苷(salidroside,Sal):上海阿拉丁生化科技股份有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO)(≥99.8%)、六氟异丙醇(≥99%)、硫黄素T(thioflavin T,ThT)(≥95%)、磷钨酸(≥99%):美国Sigma-Aldrich公司;PC12细胞:中国医学科学院基础医学研究所;高糖DMEM培养基、胎牛血清、胰蛋白酶消化液、青链霉素(双抗):美国GIBCO公司;MTT细胞增殖及细胞毒性检测试剂盒、磷酸盐缓冲液(phosphate buffer saline,PBS)(pH 7.4):北京索莱宝科技有限公司。
1.2 仪器与设备
荧光分光光度计(F-2500):日本Hitachi集团;恒温摇床(THZ-103B):上海一恒科学仪器有限公司;酶标仪(Bio-RAD):美国伯乐公司;圆二色谱仪(MOS-450):法国 Bio-logic公司;超净工作台(BSC-1300IIB2):苏州安泰空气技术有限公司;细胞培养箱(Forma371):美国 Thermo Scientific公司;高压灭菌锅(VB-40):德国SYSTEC公司。
1.3 方法
1.3.1 Aβ40的制备
称取适量的Aβ40溶解于六氟异丙醇中,配制成浓度为1 mg/mL的溶液,然后置于冰浴中超声1 h除去预先存在的Aβ40聚集体,再置于冰浴中静置2 h使其充分溶解,然后将溶液在4℃、15 000×g的条件下冷冻离心0.5 h[6]。离心完成后,吸取约80%的上清液于离心管中,每个离心管中加入100 μL,并用氮气吹干,即可得到一层附着在离心管内壁的蛋白质薄膜,冷藏在-20℃备用。
1.3.2 ThT荧光试验
以ThT荧光强度为指标考察红景天苷的抑制作用。首先,用微量的二甲基亚砜溶解1.3.1制备好的蛋白质薄膜,超声10 min后,用PBS(pH 7.4)稀释至0.4×10-4mol/L。试验过程中将适当浓度的红景天苷与Aβ40混合,在37℃、170 r/min条件下振荡培养。反应结束后取出样品,加入一定量的ThT溶液孵育10 min,测定其荧光强度。调节仪器参数:λEX为445 nm,λEM为460 nm~600 nm,狭缝宽度5nm。设定仅含Aβ40的样品溶液为100%对照组,每个试验重复测量3次,计算平均值绘制ThT荧光强度随红景天苷浓度变化的曲线图。
1.3.3 刚果红试验
利用 PBS(2.5×10-2mol/L,pH7.4)配制浓度为 2.5 ×10-5mol/L的刚果红(Congo red,CR)溶液,注意避光且现用现配。试验过程中将适当浓度的红景天苷与Aβ40混合,在37℃、170 r/min条件下振荡培养。反应结束后取出样品与刚果红溶液混合,在室温25℃下避光放置0.5 h,采用紫外分光光度计测定,波长范围为400 nm~600 nm的吸光度。
1.3.4 透射电镜试验
采用透射电子显微镜(transmission electron microscope,TEM)考察Aβ40聚集体形态的变化。吸取反应一定时间的样品溶液,滴于碳膜包裹的超薄铜网上,自然风干后,再利用等体积的2%的磷钨酸染色1.5 min,染色结束后除去染料再用超纯水洗涤3次,即可以进行观察。
1.3.5 圆二色谱试验
采用圆二色光谱(circular dichroism,CD)考察红景天苷对Aβ40二级结构的影响。分别吸取300 μL反应一定时间的Aβ40、Aβ40和红景天苷共同孵育的样品,置于1 mm厚的石英比色皿中,在室温25℃下,以溶剂作为空白,在波长190nm~260nm、扫描速度30nm/min、扫描带宽1 nm的条件下进行试验以确定样品二级结构的变化,每次试验重复3次取平均值。
1.3.6 细胞毒性试验
采用细胞毒性试验考察红景天苷的细胞毒性及对Aβ40细胞毒性的影响,本研究采用MTT检测法,使用的细胞为神经元细胞系PC12细胞[19]。使用的培养基为DMEM高糖培养基[含有10%胎牛血清(fetal bovine serum,FBS)和100 U/mL青链霉素]。试验首先将细胞培养至对数期备用。吸取180 μL密度为5×103/孔的细胞悬液于96孔板中,置于温度为37℃,二氧化碳浓度为5%的培养箱中培养至细胞贴壁。细胞贴壁后,再加入用培养基溶解好的红景天苷溶液、Aβ40、红景天苷与Aβ40共培养的混合溶液,继续置于培养箱中培养24h。培养结束后缓慢吸出培养液,再快速加入90 μL新鲜的培养基和10 μL MTT溶液继续培养4 h。反应结束后离心吸出上清液,再加入110 μL甲臜(Formazan)溶液裂解沉淀的细胞,避光孵育10 min待紫色结晶物完全消失,用酶标仪测定吸光度,调节参数为490 nm,根据测定值计算细胞活性。试验设置对照组和空白组,其中空白组不含细胞,对照组仅含细胞,每个待测物的浓度设置6个复孔,计算公式如下。

1.3.7 分子对接试验
本试验选用的Aβ40结构来自蛋白质结构数据库(protein data bank,PDB),序列号为 1BA4[20]。红景天苷的结构由Gaussian绘制,且通过分子动力学和分子力学优化出其最优构型。试验过程中,首先用AutodockTools 1.5.6导出Aβ40和红景天苷的PDBQT文件。选用半柔性对接完成本次试验,设置Aβ40为刚性分子,配体(红景天苷)为柔性分子,调节盒子(Box)大小且保证Box的体积足够大,可以完全包裹Aβ40和配体分子。遗传算法为Lamarckian,运行次数为100次。对接结束后,选取结合能最低的组,利用pyMOL软件绘制图像进行分析。
1.4 数据处理
所有试验均平行测定3次,然后利用Origin 8软件进行绘图。
2 结果与分析
2.1 红景天苷对Aβ40聚集的抑制作用
首先利用ThT荧光试验来考察红景天苷对Aβ40聚集的抑制作用,ThT是检测纤维最常用的染料,当与纤维结合时,该染料激发和发射波长都会改变,且形成的纤维量越多,溶液的荧光强度越大。本试验中纤维生成的量用ThT荧光强度来表示,结果见图1。
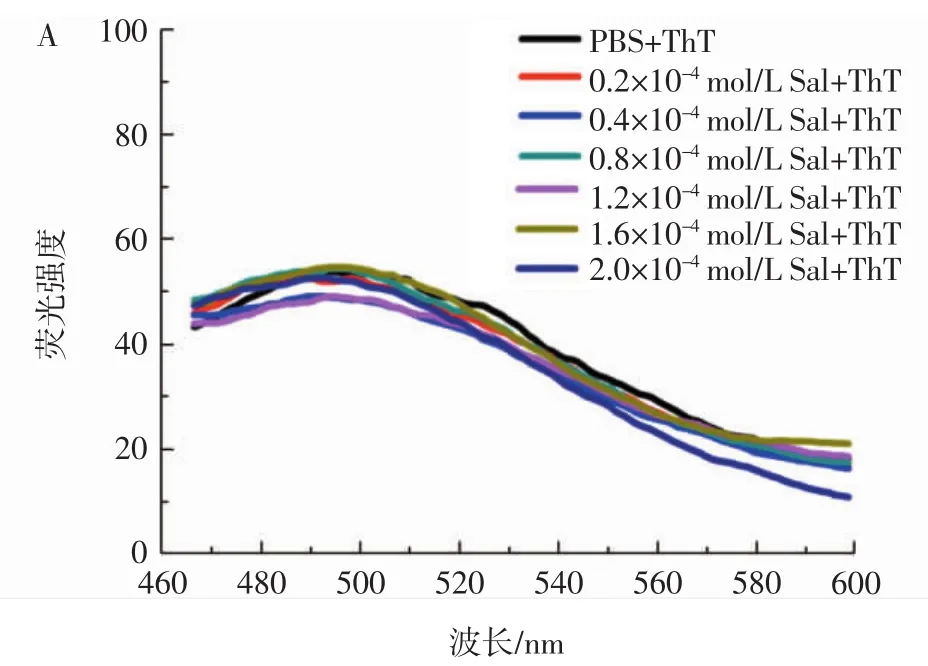
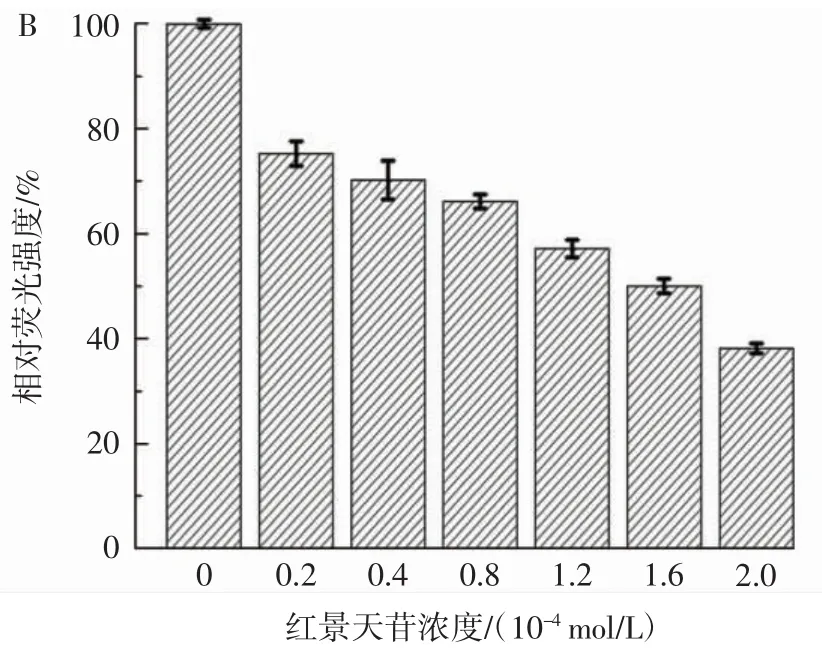
图1 红景天苷对Aβ40聚集的抑制效果Fig.1 Inhibitory effect of salidroside on aggregation of Aβ40
如图1 A所示,在仅存红景天苷的条件下,ThT的荧光曲线几乎没有变化,这表明红景天苷对ThT荧光强度几乎无影响,不会影响后续的荧光检测试验。
考察红景天苷(0.2×10-4、0.4×10-4、0.8×10-4、1.2×10-4、1.6×10-4、2.0×10-4mol/L)对 Aβ40(0.4×10-4mol/L)聚集的抑制作用,其中Aβ40独自孵育24 h的荧光强度设定为100%,对其它的荧光值进行归一化,绘制柱状图,结果如图1 B。从图1 B可以看出,红景天苷以浓度依赖方式抑制Aβ40的聚集,当红景天苷的浓度为2.0×10-4mol/L 时,ThT荧光强度降低了约(61.86±0.96)%。结果表明,红景天苷对Aβ40的纤维化具有较强的抑制作用,而且红景天苷浓度越大,对Aβ40纤维化的抑制作用越强。
利用刚果红来考察红景天苷对Aβ40聚集的抑制能力,刚果红是一种常用的检测纤维是否形成的染料。刚果红对纤维具有较高的亲和力,且刚果红与原纤维的相互作用可导致其吸光度显著增加,而且也会使吸收波长造成红移。红景天苷、Aβ40与红景天苷混合溶液的刚果红吸收光谱见图2。
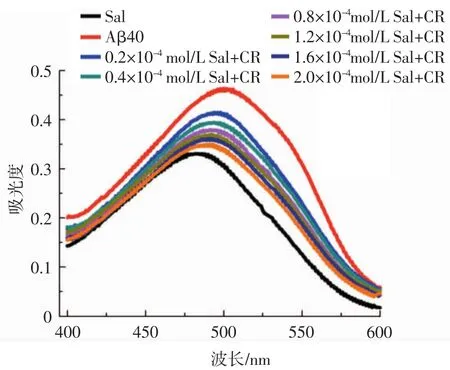
图2 Aβ40与红景天苷混合溶液的刚果红吸收光谱Fig.2 Congo red binding spectra of Aβ40 and salidroside mixed solution
从图2可以看出,在孵育24 h后,与刚果红样品相比,形成的Aβ40纤维使刚果红的吸光度明显增加,且最大吸光度波长发生明显的红移,表明淀粉样纤维已经形成。而不同浓度的红景天苷与Aβ40共同反应的样品溶液,其吸光度和红移程度则有所减少,由图2可知,红景天苷以浓度依赖方式抑制Aβ40的聚集,当红景天苷浓度为2.0×10-4mol/L时,刚果红的吸光度最小,发生红移的程度也最低,这与ThT荧光试验的结果一致,表明红景天苷可以有效抑制Aβ40聚集。
2.2 红景天苷对Aβ40聚集形态的影响
利用TEM进一步考察红景天苷对Aβ40聚集形貌的影响,结果见图3。
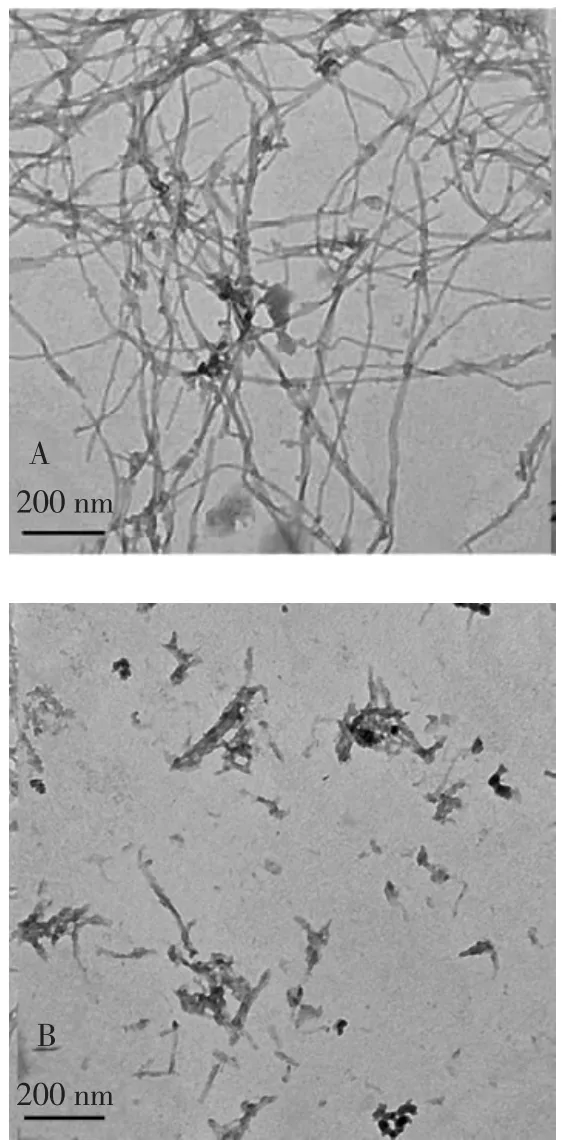
图3 红景天苷对Aβ40纤维形貌的影响Fig.3 Effect of salidroside on morphology of Aβ40 fiber
由图 3可知,Aβ40(0.4×10-4mol/L)独自孵育 24 h,形成典型的长且相互缠绕的纤维束(数百纳米长,几十纳米宽)。相比之下,在Aβ40溶液中添加红景天苷(2.0×10-4mol/L)孵育24 h后,只观察到少量短而薄的纤维,以及一些无特定结构的无定形聚集物。试验结果表明,红景天苷可以有效地延缓Aβ40原纤维的形成。这与ThT荧光和刚果红结果一致,TEM和荧光试验结果均证实红景天苷能有效抑制Aβ40聚集,且可以明显改变成熟纤维的形貌。
2.3 红景天苷对Aβ40二级结构的影响
利用远紫外CD光谱考察红景天苷对Aβ40聚集过程中构象转变的影响,结果见图4。
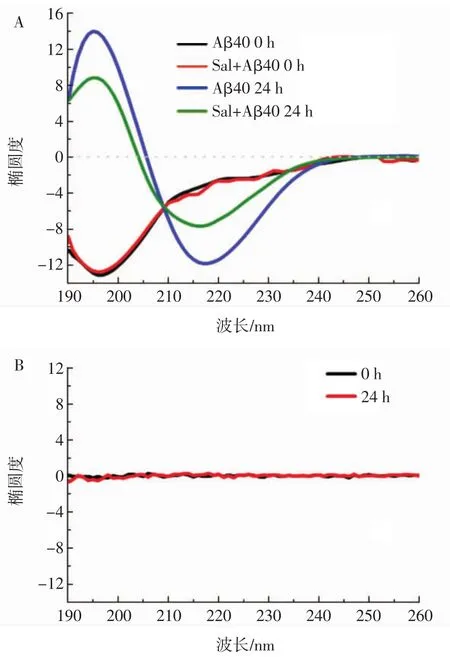
图4 红景天苷对Aβ40构象的影响Fig.4 Effect of salidroside on the conformation of Aβ40
由图4可知,红景天苷在单独孵育0 h或24 h后均不具有圆二色信号(图4B),说明红景天苷在溶液中很难形成明显的二级结构,因此不会对后续试验造成干扰。而Aβ40的初始结构为无规则卷曲,其特征为在196 nm处有一个负峰(图4A黑线)[21]。孵育24 h后,这个峰值消失,与此同时,在195 nm处出现了一个正峰,217 nm处出现了一个负峰(图4A蓝线)。这表明Aβ40的二级结构经历了由初始的无规则卷曲到β-折叠结构的转变[22-23]。红景天苷与Aβ40共孵育的混合溶液经历了相似的构象转变,即从无规则卷曲转变为β-折叠结构。不同的是,与Aβ40单独孵育24 h相比,红景天苷共孵育的Aβ40,其整体CD信号明显下降(图4A绿线)。结果表明,红景天苷的加入使Aβ40的β-折叠含量明显降低,这表明红景天苷具有抑制能力,能够干扰Aβ40从无规则卷曲向β-折叠的结构转变,从而抑制纤维的形成。CD光谱的变化与Aβ40聚集的荧光和TEM数据一致。
2.4 红景天苷的细胞毒性和对Aβ40诱导的细胞毒性的影响
以PC12细胞为试验对象,采用MTT法研究了红景天苷的细胞毒性和对Aβ40成熟纤维诱导的细胞毒性的保护作用,结果见图5。
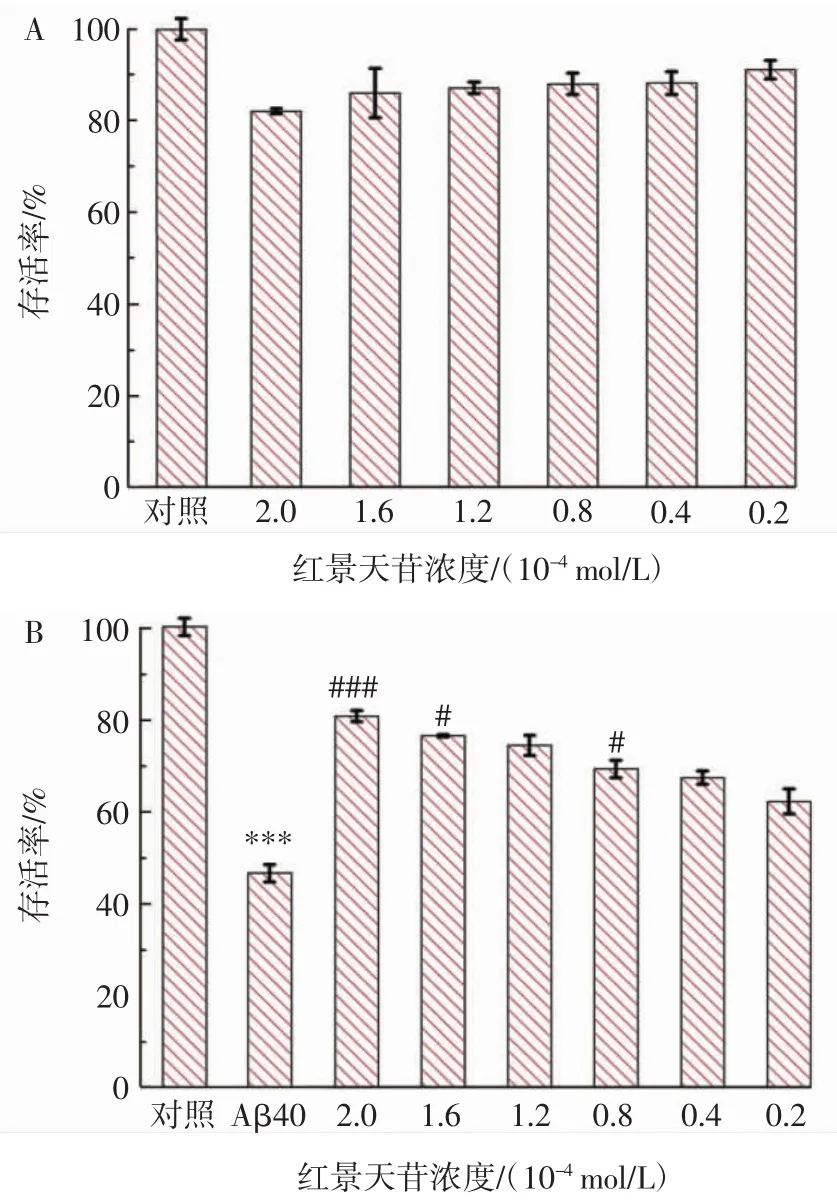
图5 红景天苷对PC12细胞活力的影响和对Aβ40诱导的细胞毒性的保护作用Fig.5 The influences of salidroside on the cell viability of PC12 and the protective effects to Aβ40-induced cytotoxicity toward PC12 cells
设定没有Aβ40或红景天苷的PC12细胞的强度为100%,对所有MTT吸光度信号进行归一化。首先研究红景天苷对PC12细胞的影响,如图5A所示,添加不同浓度的红景天苷后细胞活力均低于对照组,说明红景天苷本身对PC12细胞有一定的毒性,且呈剂量依赖性。然而,红景天苷对PC12细胞的细胞毒性不显著,经过2.0×10-4mol/L红景天苷处理过的PC12细胞,其细胞活力仍可达到(82.03±0.56)%,而 0.2×10-4mol/L红景天苷处理PC12细胞的细胞活力可达到(91.10±2.05)%。
研究红景天苷对Aβ40诱导的细胞毒性的保护作用,如图5B所示,PC12细胞与Aβ40聚集物共孵育24 h后,具有较强的细胞毒性,使细胞活力下降至(46.67±1.70)%。相比之下,在不同浓度红景天苷的保护下,Aβ40的细胞活力逐渐增强。当红景天苷的浓度为0.2×10-4mol/L时,细胞的保护能力不明显,细胞活力为(62.32±2.74)%。当浓度增加到 1.6×10-4mol/L和2.0×10-4mol/L 时,细胞活力分别提高到(76.68±0.24)%和(80.89±1.23)%。总的来说,高浓度红景天苷可以明显提高细胞活力,证实了红景天苷抑制与其浓度呈正相关。根据聚集荧光试验(ThT、刚果红)和结构表征(TEM、CD)结果,红景天苷可以将Aβ40纤维重塑为无定型的聚集物,且神经毒性更低。当浓度为2.0×10-4mol/L时,对细胞的保护效果最好。
2.5 分子对接试验
作为一种多酚,红景天苷能发挥类似表没食子儿茶素没食子酸酯[(-)-epigallocatechin gallate),EGCG]的神经保护作用,可与α-螺旋和β-片层之间的过渡性构象β-发夹结构结合,从而使Aβ保持α-螺旋结构。Aβ40结构来源于蛋白质库,在这个模型中,16~24、25~27、28~40 位氨基酸形成 α-螺旋结构,其余残基形成无规则卷曲结构[20],采用Aβ40的α-螺旋结构进行对接分析。对接试验是分子间相互作用的一个快照,以确定红景天苷和Aβ40在原子水平上是否存在直接的相互作用。分子对接试验结果见图6。
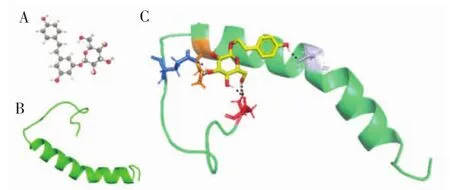
图6 分子对接试验结果Fig.6 Molecular docking test results
如图6 C所示,红景天苷与Aβ40螺旋结构的疏水表面匹配良好。红景天苷的酚羟基与Aβ40的Asp1、Glu11、Lys16和Ser26形成氢键。结果表明,红景天苷主要通过氢键与Aβ40相互作用。
综上所述,红景天苷可以明显抑制Aβ40在生长期的纤维的生成,这一结果也说明,红景天苷能够与单体、中间产物或成熟纤维结合,从而干扰Aβ40的结构从无规卷曲到β-折叠结构的转换,或者其它单体与现有淀粉样物质结合形成大的聚集体。由于红景天苷具有与其它典型的Aβ40抑制剂相似的芳香环结构,可能与Aβ40的芳香残基相互作用,在红景天苷和Aβ40之间形成π-π堆叠作用。此外,红景天苷的平面构象可能还提供了与淀粉样纤维疏水区域折角结构匹配的构型,使红景天苷可以与淀粉样纤维侧链的β-片状区域通过氢键连接。这些协同作用可能都在一定程度上起到了抑制Aβ40聚集的作用。
3 结论
本研究揭示了红景天苷对Aβ40纤维聚集的抑制作用及相应的细胞毒性的缓解作用。ThT荧光、刚果红和TEM试验表明,红景天苷可以有效地抑制Aβ40成熟纤维的形成,并呈剂量依赖的方式,即浓度越大,抑制效果越好。细胞毒性试验结果表明,红景天苷能保护PC12细胞免受Aβ40诱导的细胞毒性作用。CD试验表明,红景天苷可以有效地降低Aβ40的β-折叠结构的含量。分子对接试验结果表明,红景天苷主要通过氢键与Aβ40结合,结合位置为Asp1、Glu11、Lys16和Ser26。因此,红景天苷有很大的潜力发展为Aβ40聚集抑制剂和功能性食品成分,用于阿尔兹海默病的治疗干预。
