VemR对野油菜黄单胞菌生物被膜合成和胞外酶活性的调控
2021-11-13林茂娟吴可建于燕燕李春霞
林茂娟,吴可建,于燕燕,李春霞,陶 均
(海南省热带生物资源可持续利用重点实验室,海南大学热带作物学院,海南海口 570228)
野油菜黄单胞菌(Xanthomonas campes trispv.campest ris,Xcc)能够引起十字花科植物的黑腐病,是研究植物与病原菌相互作用的重要模式细菌之一[1-2].病原体产生的胞外酶、胞外多糖(Extracellular polysaccharide,EPS)、生物被膜(Biofilm)及效应因子等是其能够成功感染并在宿主组织中定殖的关键因素[3-5].生物被膜的形成在病原体感染寄主植物过程中起着关键作用,能够形成生物被膜的病原菌对抗生素和宿主免疫防御机制具有很强的抗性[6-7].大多数胞外酶是水解酶或裂解酶,能够降解宿主植物细胞壁的纤维素、果胶、蛋白质和淀粉等成分,用于侵染初期攻破植物的第一道防线[8].目前已发现Ⅱ型分泌系统(Type II secretion system,T2SS)分泌的蛋白酶[9]、纤维素酶(内切葡聚糖酶)[10]、淀粉酶[11]和果胶酶(多聚半乳糖醛酸酶)[12]均在Xcc的毒力中发挥作用.
VemR是一个仅含有REC(Phosphoacceptor receive)结构域的响应调节因子(Response regulator,RR),其突变导致Xcc8004菌株的毒力、EPS含量显著降低.rpo N2、vemR和fleQ基因组成一个操纵子(图1)[13].rpo N2编码一个σ54因子,其突变导致柑橘溃疡病菌Xc1生物被膜和EPS含量减少[14].fleQ编码转录激活因子,在XccXC17菌株中可调控fliE、f l iL、fli Q、fl gB、flg G、flhF和flhB A等鞭毛合成基因的表达以及致病力[15-17].但r po N2-vemR-fleQ操纵子在Xcc中是否调控胞外酶和生物被膜的生物合成并不清楚.本研究构建了r poN2、vemR、f l e Q单突变体、双突变体以及三重突变体,比较突变体与野生型菌株分泌胞外酶和形成生物被膜的能力,分析rpo N2-vemR-fleQ操纵子对Xcc8004合成胞外酶和生物被膜的调控作用,为进一步探讨病原菌的致病机制提供参考.
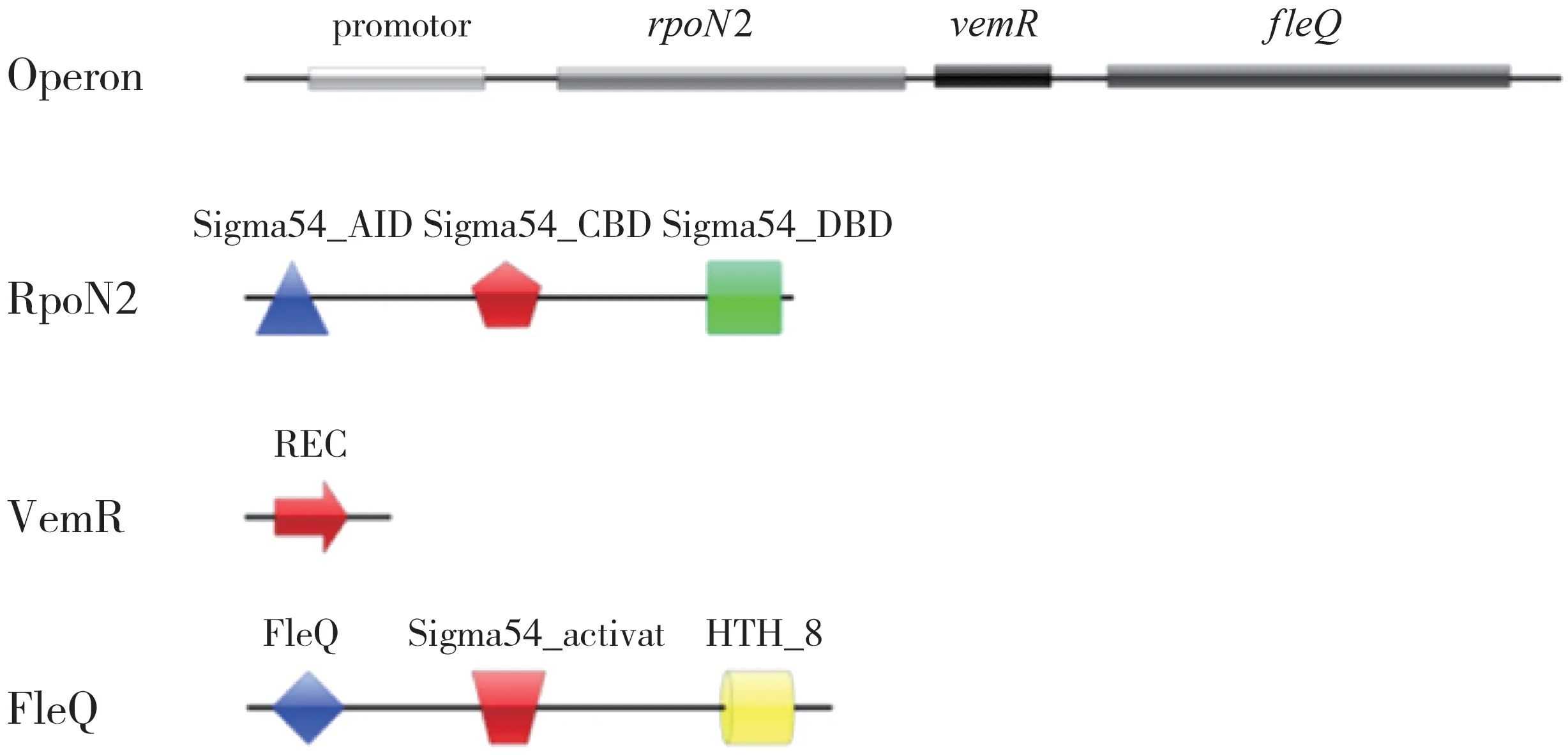
图1 rpoN2-vemR-fl eQ操纵子及其编码蛋白质结构
1 材料与方法
1.1 菌株与质粒Xcc8004菌株和pK18mob S acB质粒为本实验室保存,大肠杆菌感受态购自全式金生物技术有限公司.
1.2 培养基与试剂LB培养基(1%胰化蛋白胨、0.5%酵母提取物、1%NaCl),NYG培养基(1%胰化蛋白胨、0.5%酵母提取物、1%甘油),相应的固体培养基另加1.5%的琼脂.琼脂糖凝胶回收及质粒提取试剂盒购自天根生化科技有限公司.高保真DNA聚合酶、限制性核酸内切酶及T4连接酶购自NEB公司.其它试剂购自Sigma或广州化学试剂公司.
1.3 引物序列根据敲除基因两端序列,运用软件Primer 5分析、设计引物(表1),并由生工生物工程(广州)分公司合成.
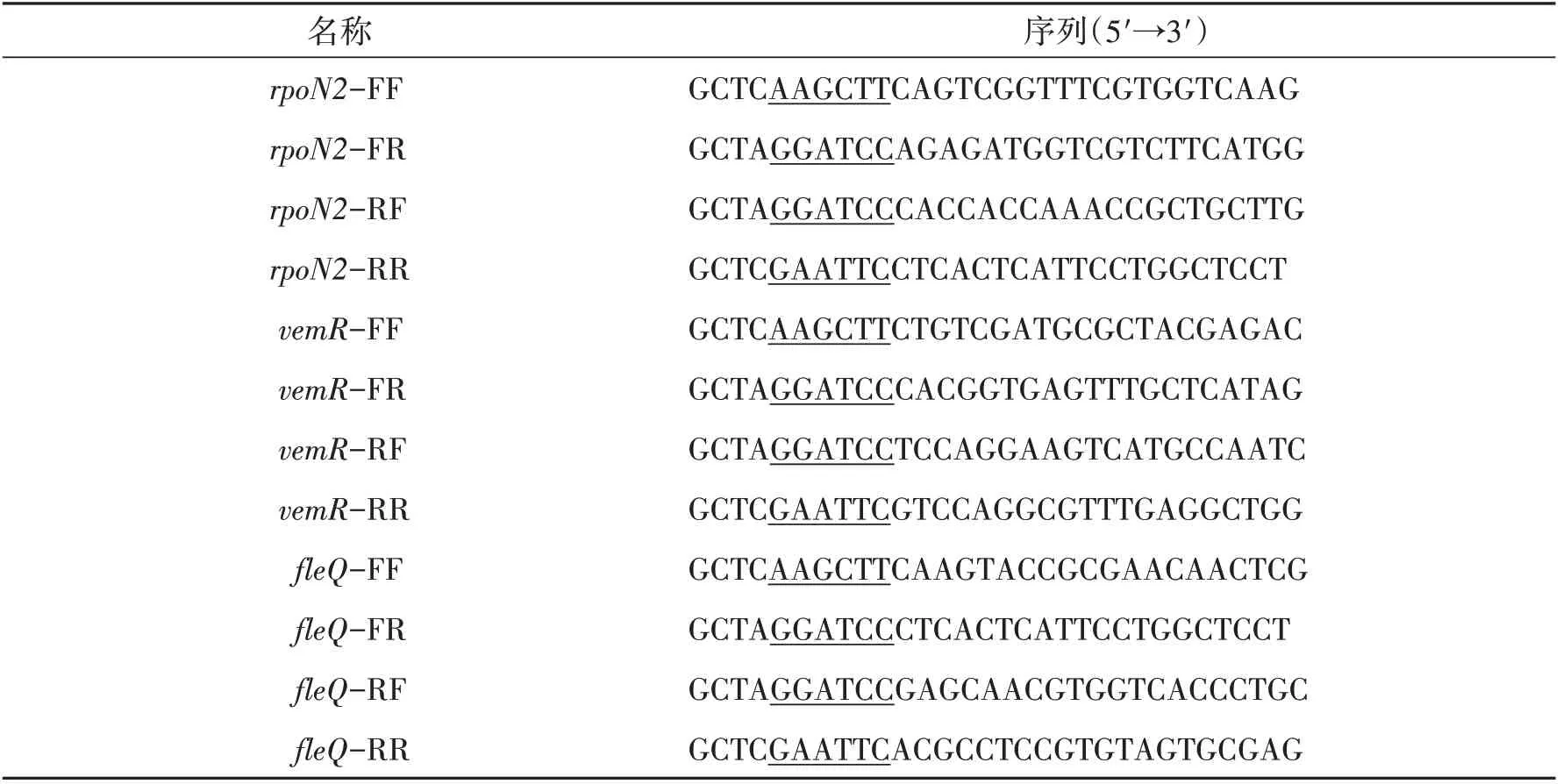
表1 引物序列
1.4 突变体构建以Xcc8004基因组为模板,PCR扩增目的基因上下游各约500 bp片段.酶切回收后与pK18mobSacB载体相连,转化E.col iDH5a,经酶切鉴定以及测序确认后获得敲除载体pK18-rpo N2、pK18-vemR、pK18-fleQ、pK18-rpo N2/vemR、pK18-vemR/fleQ、pK18-rpo N2/fleQ、pK18-rpoN2/vemR/fleQ.利用三亲接合法将自杀质粒pK18mob S ac B转入Xcc8004中,经过两次交换后获得突变体菌株,单突变体菌株:Δrpo N2、ΔvemR和ΔfleQ;双突变体菌株:ΔrpoN2/ΔvemR、ΔvemR/ΔfleQ和ΔrpoN2/ΔfleQ以及三突变体:Δrpo N2/ΔvemR/ΔfleQ.
1.5 生物被膜(Biofilm)含量测定将待测菌株于28℃振荡培养24 h后离心收集菌体,用NYG培养基清洗两次后稀释至OD600=1.0,取2 mL菌液接种到试管中,28℃静置培养72 h.将菌液吸取干净后,用ddH2O轻轻清洗两遍,自然风干,加入0.1%结晶紫染液染色30 min,弃结晶紫染液,用ddH2O轻轻清洗两遍后同样自然风干,通过观察气液表面薄膜环的大小来推测菌株Biofilm的形成能力.最后加入等量的90%乙醇溶解20 min,混匀后按200μL/孔加入96孔板于A590 nm波长处检测吸光值,每个样本做3个重复[18].
1.6 胞外酶(蛋白酶、淀粉酶、纤维素酶)活性测定将待测菌株于28℃振荡培养24 h后离心收集菌体,用ddH2O清洗两次后稀释至OD600=1.0,取2μL菌液接种到分别补充有脱脂奶粉、可溶性淀粉以及羧甲基纤维素的NYG固体培养基中培养48 h.补充有可溶性淀粉和纤维素的平板分别用1∶100的I2/KI(0.08 M I2,3.2 M KI)和0.1%的刚果红染液染色.通过比较D/d(水解产物的直径(D)和菌落直径(d))的大小以鉴定菌株产酶能力,D/d值越大,说明菌株产酶的能力越强[19].
2 结果与分析
2.1 rpoN2/vemR/fleQ突变体菌株的构建本实验以Xcc8004作为野生型菌株(WT),利用三亲本接合法经过两次同源重组将rpoN2、vemR和fleQ敲除.用目的基因两侧引物进行PCR检测,以Xcc8004为阳性对照,ddH2O为阴性对照.r poN2、vemR和fleQ基因大小分别为1 404 bp、384 bp、1 491 bp.如图2所示,在相应突变体中,野生型扩增片段与突变体扩增片段大小之差正好符合预测敲除基因片段大小,表明突变体已构建成功.
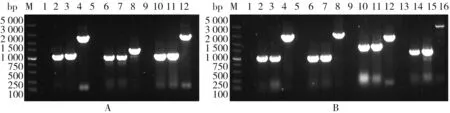
图2 r poN2、ve mR和fleQ突变体PCR检测
2.2 VemR、RpoN2和FleQ对Xcc生物被膜的调控作用生物被膜(Biofilm)是指粘附在物体表面或界面由蛋白质、多糖和DNA等组成的细菌群体[20],能够保护细菌免受各种物理、化学和生物因素的损伤[21].本研究通过气液界面环形成法以及结晶紫染色分光光度法检测突变体菌株形成Biofilm的能力.如图3所示,WT菌株形成的气液界面环面积较大,表明其形成Biofilm的能力较强.与WT相比,vemR突变后,气液界面环菌落面积明显减少,结晶紫染色的吸光值降低约88.8%.Δr poN2/ΔvemR和ΔvemR/ΔfleQ双突变体的吸光值较WT分别降低约75.3%和64.6%,表明ΔrpoN2/ΔvemR和ΔvemR/ΔfleQ的Biofilm形成能力也明显减弱,但比ΔvemR单突变体略强.Δr poN2、ΔfleQ、Δrpo N2/ΔfleQ和Δr poN2/ΔvemR/Δf l e Q均与野生型结果相似,气液界面环菌落面积较大,结晶紫染色吸光值较高,具有较强的Biofilm合成能力.以上结果表明,VemR正调控Biofilm的生物合成,但RpoN2和FleQ可能拮抗VemR的活性,存在部分上位效应.
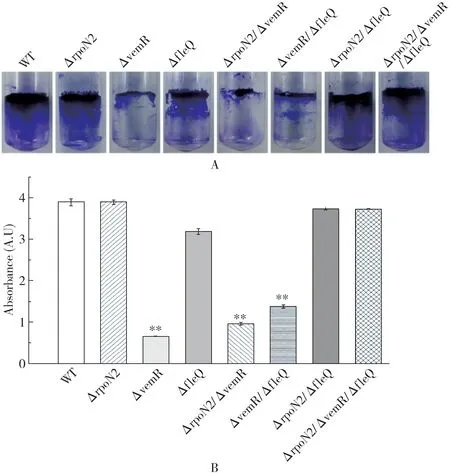
图3 rpoN2、vemR和fl eQ突变对Xcc Biofilm含量的影响
2.3 VemR、RpoN2和FleQ对Xcc胞外蛋白酶的调控蛋白酶是一类能够水解蛋白质肽链的酶.细菌若能分泌胞外蛋白酶,则能够在含有2%脱脂奶粉的平板上形成一个无色透明的水解圈.如图4所示,除了ΔvemR/Δf le Q双突变体外,其余所有突变体的水解圈直径与WT菌株大小几乎一致.ΔvemR/ΔfleQ双突变体的水解圈极小,较野生型菌株降低约64.7%,说明其产生蛋白酶的能力明显减弱.ΔvemR和ΔfleQ单突变体不影响蛋白酶的分泌.以上结果表明,vemR和fl e Q共同调控Xcc8004菌株分泌蛋白酶,在功能上有冗余.但RpoN2可抑制VemR和FleQ的活性,可能在VemR和FleQ的信号下游起作用.
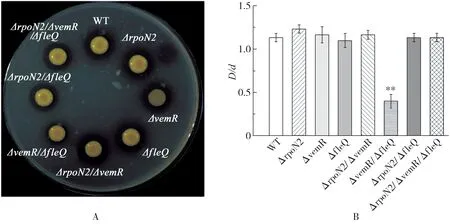
图4 rpoN2、vemR和fl eQ突变对Xc c胞外蛋白酶含量的影响
2.4 VemR、RpoN2和FleQ对Xcc胞外淀粉酶活性的调控Xcc8004具有淀粉酶活性,因此它能够在含有0.1%可溶性淀粉的NYG平板上形成透明的水解圈.如图5所示,与WT型相比,ΔvemR和ΔvemR/Δf l e Q突变体的淀粉酶水解圈直径明显变小,分别降低约16.4%和23%.其余突变体分泌淀粉酶的能力与WT型差异不大.这表明VemR正调控Xcc淀粉酶的合成或分泌,FleQ可协同VemR调控胞外淀粉酶活性,但RpoN2具有拮抗VemR和FleQ的功能.因此,VemR和FleQ可能通过负调控RpoN2来调控胞外淀粉酶的合成或分泌.
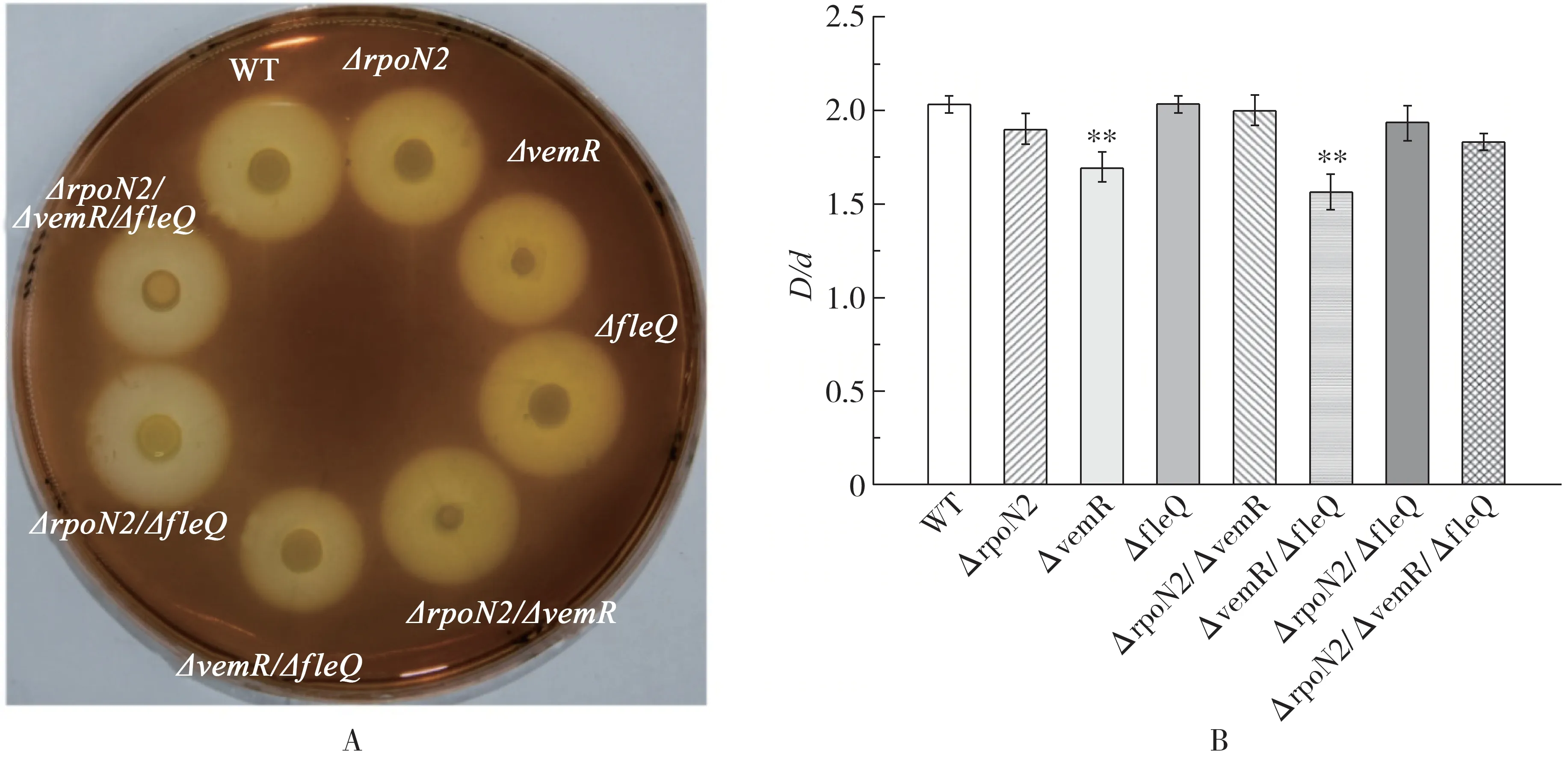
图5 rpoN2、vemR和fl eQ突变对Xc c胞外淀粉酶活性的影响
2.5 VemR、RpoN2和FleQ对Xcc胞外纤维素酶活性的调控Xcc8004也具有分泌纤维素酶的功能,能够在含有0.5%的羧甲基纤维素的固体培养基上形成水解纤维素的圈.如图6所示,所有vemR缺失突变体(即ΔvemR、ΔrpoN2/ΔvemR、ΔvemR/ΔfleQ和Δr poN2/ΔvemR/Δf le Q)的水解圈均比WT菌株小约12%~17%,而ΔrpoN2、Δfl e Q和ΔrpoN2/ΔfleQ突变体的水解圈大小与野生型菌株没有明显差异.以上结果表明,在Xcc8004中,RpoN2和FleQ对纤维素酶的合成或分泌没有影响,VemR则正调控纤维素酶的合成或分泌.
3 讨 论
在病原菌中,毒力因子的产生在多个水平上受到严格调控.在黄单胞菌中,EPS、Biofilm和胞外酶的表达主要由Rpf/DSF群体感应系统调节[23-25].此外,一些双组分系统(如RpfC/RpfG、RavA/RavR、HpaS)和转录调控因子Clp等也参与其胞外酶和Biofilm等生物合成的调控[26-28].除了转录调控外,全局性转录后调节因子RsmA和小RNA伴侣Hfq也影响XccEPS、纤维素酶和淀粉酶的产生[29-30].
在许多病原菌中,rpoN2-vemR-fleQ操纵子调节许多基因的转录和表达,调控细菌的生长、毒力、运动性、生物被膜形成、细菌鞭毛的组装和群体感应等[31-35].在Xcc8004中,我们先前发现VemR可调节EPS的生物合成和细菌的运动能力,进而影响细菌的致病力[13].在这里,我们还发现VemR正调控纤维素酶、淀粉酶和蛋白酶的合成或分泌,并且vemR缺失突变后Xcc8004菌株几乎无法产生生物被膜.这些发现说明VemR可能是全局性的调节因子,影响包括胞外酶、EPS、Biofilm、运动性在内的诸多致病相关因子的形成,调控细菌对外界环境的适应能力,进而影响病原菌的致病力.此外,除纤维素酶外,VemR对上述致病因子的调控均依赖于RpoN2和FleQ,暗示vemR操纵子内的3个基因具有上下位效应,处于一条信号传递途径上.由于RpoN2和FleQ均为DNA结合蛋白,作为转录调节因子起作用,而VemR没有相关的功能输出结构域,因此VemR可能影响RpoN2或FleQ的DNA结合活性,进而调控致病因子合成或分泌相关基因的表达,调控病原菌的致病力,但具体机制还需进一步研究.
