一种快速提取三孢布拉霉基因组的方法
2021-11-12董雪田朱恺丽曲音波杨培龙余晓斌
董雪田,朱恺丽,曲音波,杨培龙,余晓斌,罗 玮*
(1.江南大学 生物工程学院,江苏 无锡 214122;2.山东大学 微生物技术国家重点实验室,山东 青岛 266237;3.农业农村部 饲料生物技术重点实验室/中国农业科学院 饲料研究所,北京 100081)
番茄红素和β-胡萝卜素具有很强的抗氧化能力,具有提高免疫力、减少细胞或组织损伤、预防多种癌症及心血管疾病、降低血清胆固醇、预防白内障等功效,近年来被广泛应用于食品、药品、保健品和动物饲料等行业[1]。三孢布拉霉属于异宗接合菌,高产类胡萝卜素,且不需要特殊的生长条件,是一种理想的β-胡萝卜素和番茄红素工业生产菌株[1-4],是工业上用于生产食品级β-胡萝卜素和番茄红素的主要微生物[4],具有重要的经济价值。由于传统诱变选育方法存在盲目性和低效性,利用系统代谢工程和合成生物学方法进行高产菌株的选育已经成为一个重要的研究方向。由于丝状真菌细胞壁厚,对其基因组提取存在诸多问题,如方法烦琐、耗时费力,阻碍了后续基因工程和代谢工程的操作。目前常用的丝状真菌基因组提取方法有CTAB法[5]、氯化苄法[6-8]、液氮研磨法[9-11]等,这些方法普遍存在耗时长、过程烦琐、添加有毒试剂等问题,后来发展起来的一些改进的方法,如改进的CTAB法[8,12-13],操作安全性较高、简便性较强、DNA纯度也进一步提高;除此以外也发展了一些新的方法,如微波法[8,14]、冻融法[15]、试剂盒法[16]等,分别在经济性、安全性或简便性方面有所改进,但依然要经过抽提、沉淀、洗涤、溶解等4步的重复,耗费时间依然不少于2 h,再加上种子液的培养,使得整个周期也很长,且操作过程中还会用到一些毒性较大的试剂。
ITS为真菌 rDNA中 18S rDNA、5.8S rDNA和28S rDNA基因间隔序列,其长度和序列变化较大,常用于真菌菌种鉴定[17-19];wc-1a和wc-1b[20]为三孢布拉霉中的两个光受体基因;crgA[21]为三孢布拉霉中的一种与类胡萝卜素合成调控相关的负调控因子编码基因;carB[22]为八氢番茄红素脱氢酶编码基因。首先筛选出了影响三孢布拉霉基因组释放的主要因素NaOH,然后对NaOH浓度、煮沸时间及基因组来源(上清液或处理后的菌苔)进行了优化,而后又对所提取基因组的稳定性以及对后续测序、酶切等实验的影响进行了验证,最后,从三孢布拉霉的其他基因和其他丝状真菌ITS序列两个方面进行了基因组快速提取法普适性的分析,确定了一种对多种丝状真菌具有较好适用性的基因组快速提取方法。
1 材料与方法
1.1 材料
1.1.1 菌株 接合菌纲的三孢布拉霉(Blakeslea trispora)负菌 NRRL2896、卷枝毛霉(Mucor circinelloides)MU 244,丝孢纲的产黄青霉(Penicillium chrysogenum)、烟曲霉(Aspergillus fumigatus)和土曲霉(Aspergillus terreus)、半知菌纲的塔宾曲霉(Aspergillus tubingensi)及散囊菌纲的亮白曲霉(Aspergillus candidus):作者所在实验室保藏。
1.1.2 引物 本研究所用引物见表1。

表1 本实验所用引物Table 1 Primes used in this study
1.1.3 培养基
1) PDA:去皮土豆 200 g/L,葡萄糖 20 g/L,琼脂粉20 g/L;pH自然。
2)种子液:玉米粉30 g/L,黄豆粉 50 g/L,KH2PO41.5 g/L,MgSO4·7H2O 0.5 g/L;pH 6.5。
1.1.4 试剂及试剂盒 NaCl、NaOH、葡萄糖、KH2PO4、MgSO4·7H2O:购于国药集团化学试剂有限公司;2×Rapid Taq Master Mix:购于南京诺唯赞生物科技有限公司;QuickCut KpnI:购于宝日医生物技术 (北京)有限公司;溶菌酶、蜗牛酶和纤维素酶:购于北京索莱宝生物科技有限公司;液氮:购于无锡市太湖气体有限公司;快速DNA产物纯化试剂盒、植物基因组DNA提取试剂盒、50×Tris-乙酸缓冲液:购于康为世纪生物科技有限公司;琼脂糖:购于生工生物工程(上海)股份有限公司;琼脂粉:购于大连美仑生物技术有限公司;土豆、玉米粉、黄豆粉:购于本地超市。
点 评:开学第一天,老师和同学都会变得格外亲切,作者通过细节的捕捉与刻画向我们呈现了校园生活的温馨与快乐,真诚自然。
1.2 方法
1.2.1 影响三孢布拉霉基因组提取效果关键因素的筛选 选择煮沸30 min、加20 mmol/L NaOH煮沸30 min、稳渗液(0.6 mol/L NaCl)配制的复合酶液(2 g/dL溶壁酶+3 g/dL纤维素酶+3 g/dL蜗牛酶)[21]酶解30 min、复合酶液酶解30 min后煮沸30 min等4种方法处理B.trispora NRRL2896菌苔,以处理后的菌苔为基因组源,对crgA进行PCR扩增,扩增引物(crgA-F和crgA-R)序列见表1。PCR反应体系和程序见表2~3。

表2 2×Rapid Taq Master Mix PCR体系Table 2 PCR components of 2×Rapid Taq Master Mix
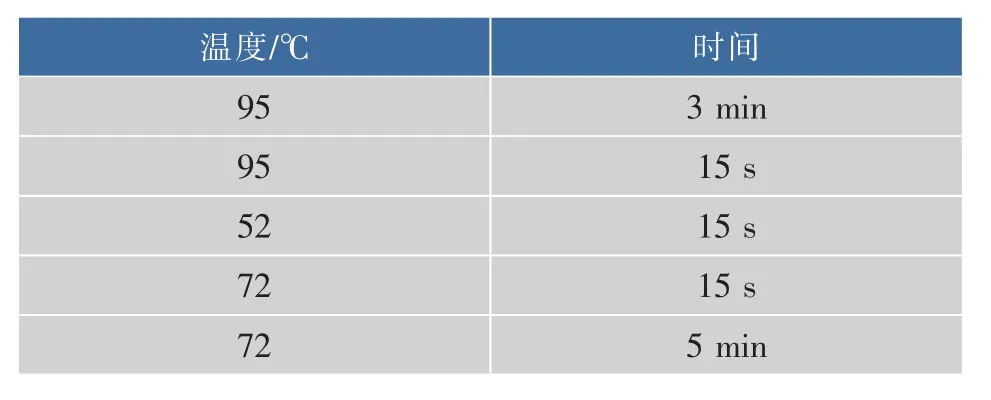
表3 2×Rapid Taq Master Mix PCR程序Table 3 PCR protocol of 2×Rapid Taq Master Mix
1.2.2 NaOH浓度、煮沸时间及基因组源对基因组提取效果的影响 选择不同的NaOH浓度、不同的煮沸时间和不同的基因组源(处理后的菌苔或上清液)对btITS进行PCR扩增,扩增引物 (ITS1和ITS4)序列见表1,PCR体系和程序见1.2.1,PCR结束后进行琼脂糖凝胶电泳验证。
1.2.3 提取的基因组稳定性测定 撕取约25 mm2的三孢布拉霉NRRL2896菌苔于50 μL浓度为20、30、40、50 mmol/L NaOH 中,6℃或 25 ℃静置,分别于不同时间点取样,测dsDNA质量浓度及纯度,并用Origin8.0绘制质量浓度变化曲线;取25℃静置60 h的样品上清液,扩增btITS,并通过琼脂糖凝胶电泳验证;分别以NaOH处理菌苔所提取基因组与试剂盒提取的基因组为模板进行PCR扩增,并通过琼脂糖凝胶电泳验证。
1.2.4 NaOH处理对后续测序、酶切等实验的影响取约 25 mm2菌苔于 50 μL浓度为 40 mmol/L NaOH中,静置10 min,取上清液为基因组源,PCR扩增btITS,用快速DNA产物纯化试剂盒纯化,取少量送金唯智测序,根据测序结果进行酶切位点分析,选具有单酶切位点的限制性内切酶进行酶切,琼脂糖凝胶电泳验证,酶切体系见表4。
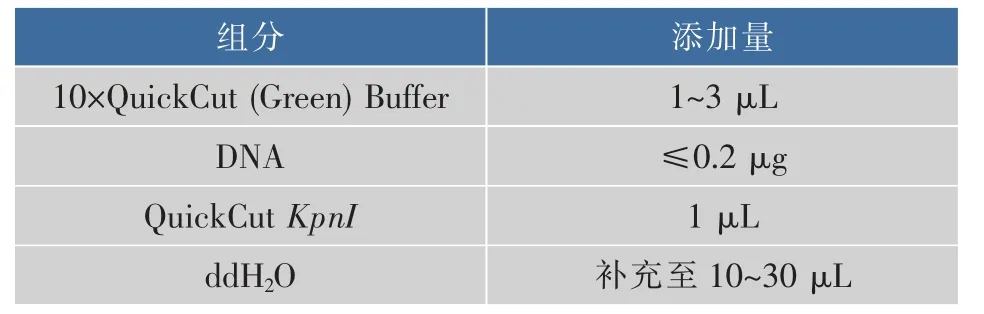
表4 酶切体系Table 4 Components of QuickCut KpnI digestion
1.2.5 基因组快速提取法普适性分析 从扩增同一菌株的不同基因和不同菌株的ITS两个方面进行基因组快速提取法普适性分析。
1)同一菌株不同基因 取约25 mm2三孢布拉霉菌苔于50 μL浓度为40 mmol/L NaOH中,静置10 min,取上清液为基因组源扩增光受体基因wc-1a、wc-1b、类胡萝卜素合成负调控因子编码基因crgA和八氢番茄红素脱氢酶编码基因carB,PCR产物进行琼脂糖凝胶电泳验证。
2)不同菌株ITS 取少量卷枝毛霉、产黄青霉、烟曲霉、塔宾曲霉、亮白曲霉和土曲霉菌苔或菌丝体,浸于50 μL浓度为40 mmol/L NaOH中,静置10 min,取上清液为基因组源,扩增ITS,PCR产物进行琼脂糖凝胶电泳验证。
1.2.6 数理统计 所有实验均重复3次,采用SPSS 20.0进行数理统计分析,结果以平均值±标准偏差表示。
2 结果与讨论
2.1 影响三孢布拉霉基因组提取的关键因素

图1 影响三孢布拉霉基因组提取关键因素的筛选Fig.1 Screening of key factors affecting the release of Blakeslea trispora genome
2.2 基因组提取所需的最适NaOH浓度、煮沸时间及基因组源的确定
一般进行细菌菌落PCR时,直接挑取菌落作为基因组源,部分革兰氏阳性菌无法直接进行菌落PCR,需要通过煮沸或冻融法进行破壁处理后,离心取上清液后进行PCR扩增。丝状真菌基因组提取大多将基因组提取纯化[12-14],无须考虑基因组源的选择。张晓利等[23]通过冻融法对19种丝状真菌进行破壁处理后,离心取上清液作为基因组源进行PCR。杜克久等[24]取孢子制成孢子悬液,以孢子悬液为基因组源进行PCR。作者用20 mmol/L NaOH煮沸处理菌苔后,菌苔仍为固态,并未溶于NaOH溶液,此时,菌苔中的基因组是否释放到上清液中,基因组源该如何选择,也需要进一步确定。
以20 mmol/L NaOH处理菌苔10 min,以处理后的菌苔为基因组源扩增crgA后虽有目的条带,但杂带明显,菌苔处理条件需进行优化。作者对煮沸时间、NaOH浓度及基因组源的选择(上清液或处理后的菌苔)进行了优化。向不同离心管中分别加入50 μL不同浓度的NaOH溶液,取约25 mm2菌苔于离心管,煮沸不同的时间后,分别取上清液和处理后的菌苔为基因组源,扩增btITS,结果见图2。当NaOH浓度为0、5、10 mmol/L时,并非所有条件均可扩增出btITS,可能是由于NaOH浓度较低(低于20 mmol/L)时,对菌丝体的裂解不充分。此外,是否扩增出目的条带与煮沸时间无正相关;当NaOH浓度达到20 mmol/L后,以上清液为基因组源,均可扩增出btITS。而以处理后的菌苔为基因组源,仅部分样品能扩增出btITS,可能是由于20 mmol/L以上的NaOH溶液处理菌苔后,均可释放一定量的基因组到体系中,因而在PCR过程中,取体系中的上清液为基因组源,均可扩增出目的条带;而以处理过的菌苔为基因组源时,菌苔中剩余未释放的基因组由于暴露于PCR体系中导致不稳定,使得PCR体系中其他组分与菌苔中基因组的接触受阻,因而有时无法扩增出目的条带。此外,当NaOH浓度到达20 mmol/L时,以各种煮沸条件处理菌苔后的上清液为基因组源,均可扩增出目的条带,即扩增效果与煮沸时间同样无正相关。添加20~40 mmol/L NaOH煮沸0 min时也可扩增出目的条带,可能是由于将菌苔浸入NaOH后到吸取上清液的片刻,部分细胞壁裂解,释放出基因组。
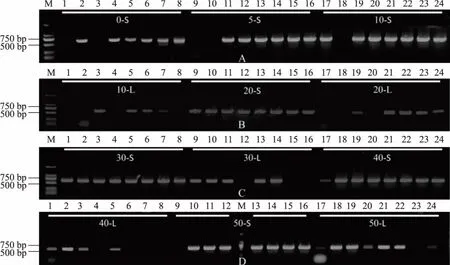
图2 最适NaOH浓度、煮沸时间及基因组源的确定Fig.2 Determination of the optimal concentration of NaOH and the time of boiling and the source of genome
2.3 提取的基因组稳定性分析
将菌苔静置于NaOH溶液中片刻,即可成功提取出基因组,但高质量浓度NaOH会使DNA降解,无法确定20~50 mmol/L NaOH较长时间存在时是否会对基因组稳定性产生影响。作者通过测定不同时间DNA质量浓度与纯度以及PCR扩增目的基因,并通过琼脂糖凝胶电泳观察其条带的完整性来确定基因组的稳定性。
分别取约25 mm2菌苔于20~50 mmol/L NaOH中,6℃静置,并于不同时间点取样测DNA质量浓度与纯度,绘制质量浓度变化曲线,见图3(a)。当静置108 h后,DNA质量浓度依旧没有明显的下降趋势,纯度也较高(OD260/OD2801.8~2.0),可能与温度较低有关。取约25 mm2菌苔于20~50 mmol/L NaOH中,25℃静置60 h取样,绘制质量浓度变化曲线,见图3(b)。60 h时,质量浓度依然没有下降趋势。根据DNA质量浓度变化曲线,将菌苔浸入20~50 mmol/L NaOH后,DNA质量浓度迅速上升,并在约5 min后上升速度减慢,10~15 min后DNA质量浓度达到最高值。曲线中DNA质量浓度高低与所用NaOH浓度并非正相关,可能是撕取的菌苔面积大小不同,但DNA质量浓度均在150~350 ng/μL,完全满足PCR扩增的要求。
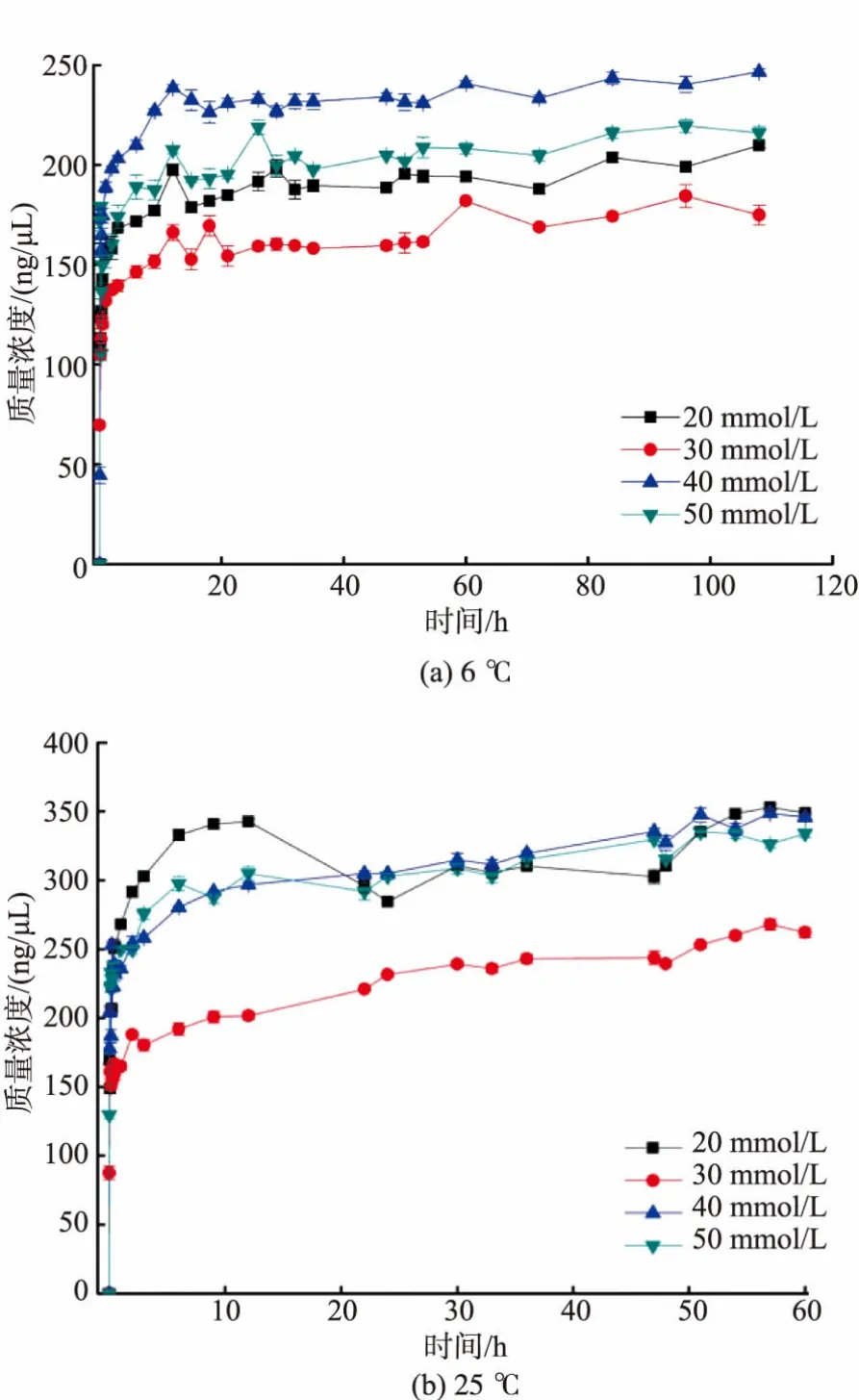
图3 不同温度下DNA质量浓度变化Fig.3 Changing of DNA concentration at different temperature
取25℃静置60 h的上清液为基因组源,PCR扩增btITS,琼脂糖凝胶电泳验证,见图4。结果表明,全部都能扩增出目的条带,条带清晰,无杂带。因此,至少在25℃静置60 h或6℃静置108 h后,基因组仍可以稳定存在。
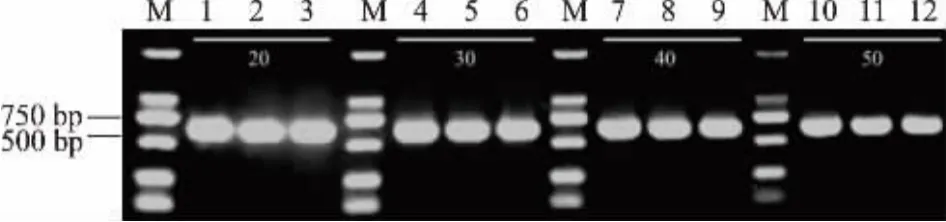
图4 以NaOH溶液中25℃静置60 h处理的上清液为基因组源扩增的btITSFig.4 btITS exemplified by the genome source that stand in NaOH solutions at 25℃for 60 h
大多数丝状真菌基因组提取方法都将基因组分离纯化,因而稳定性较好,有的甚至可在4℃存放6个月[12],但这些方法操作烦琐,耗时长,有的还需要进行一些特殊处理或使用昂贵试剂,甚至存在一定的危险性。因此,根据实验的需求,可对基因组稳定性与操作简便性、安全性和经济性等进行一定的取舍。当进行大批量转化子筛选或进行菌种鉴定时,所提取基因组的长期稳定性对实验并无太大影响,而简便性、安全性和经济性相对更为重要。因此,本研究仅进行了较短时期的基因稳定性研究,未进行更长时间的稳定性测定。
2.4 NaOH处理对基因组完整性的影响
NaOH处理菌苔后,不影响PCR的扩增效果。为进一步确定NaOH对测序及酶切等实验的影响,分别以NaOH裂解提取的基因组和传统液氮研磨后试剂盒提取的基因组为模板,扩增btITS并测序,两种方法无明显差异,且不影响测序,见图5。周礼红[12]对提取的基因组DNA进行酶解,得到较为均一的完全酶解带,证明该方法提取的基因组DNA不存在影响酶切的干扰因子,但由于基因组上酶切位点数量很大,该方法无法识别具体的序列变化,因此对特定序列进行酶切更具说服力。根据测序结果对三孢布拉霉btITS进行限制性内切酶酶切位点分析,选择具有单靶点的KpnI对纯化的PCR产物进行酶切,酶切效果良好,见图6。说明NaOH处理未对后续实验产生影响,可能是由于NaOH处理菌苔后,体系pH较原NaOH溶液已有所降低 (已通过pH试纸检测验证),而加入PCR体系中的模板量较少,NaOH浓度再次稀释50倍,且后续实验中又经过了纯化等步骤,NaOH被去除或再次稀释,因而未对基因完整性造成影响。
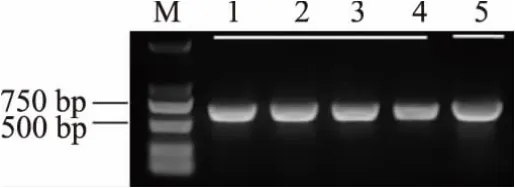
图5 以不同方法提取的基因组为模板扩增的btITSFig.5 Amplification of btITS with genome extracted by different methods
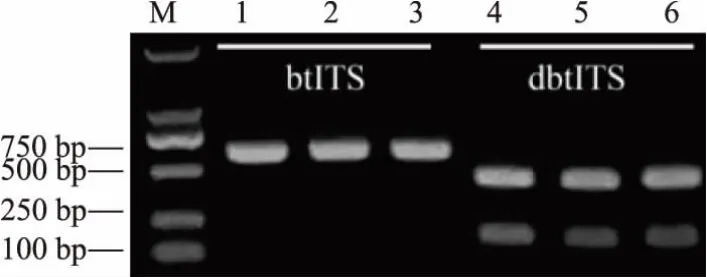
图6 btITSPCR产物和酶切产物Fig.6 PCR product and the digestion product of btITS
2.5 方法普适性分析
该方法简便快速,具有其独特的优势,但能否在各种丝状真菌中广泛应用,还需进一步确定。后续实验中选择在50 μL浓度为40 mmol/L NaOH中静置10 min作为菌苔或菌丝体处理条件。
2.5.1 对同一菌株不同基因的普适性 ITS区存在于各种真核生物中,为最常用的验证基因,大多研究仅通过这些序列进行验证分析,但ITS区较短,无法检测DNA模板的完整性[23],因此,对方法的适用性的确定,还需要通过更多的基因进行进一步的验证。曾东方等[15]利用随机引物进行PCR,获得DNA指纹图谱,但由于缺少对照,无法判断图谱的完整性及重复性。本研究中,通过扩增三孢布拉霉中其他4种序列较长的基因来确定该菌苔处理方法对三孢布拉霉基因整体的适用性。
用40 mmol/L NaOH处理三孢布拉霉负菌10 min,扩增 wc-1a(2 286 bp)、wc-1b(2 456 bp)、crgA(1 836 bp)和 carB(1 958 bp),条带大小均正确,且阳性率为100%,适用于三孢布拉霉中其他基因的扩增,见图7。
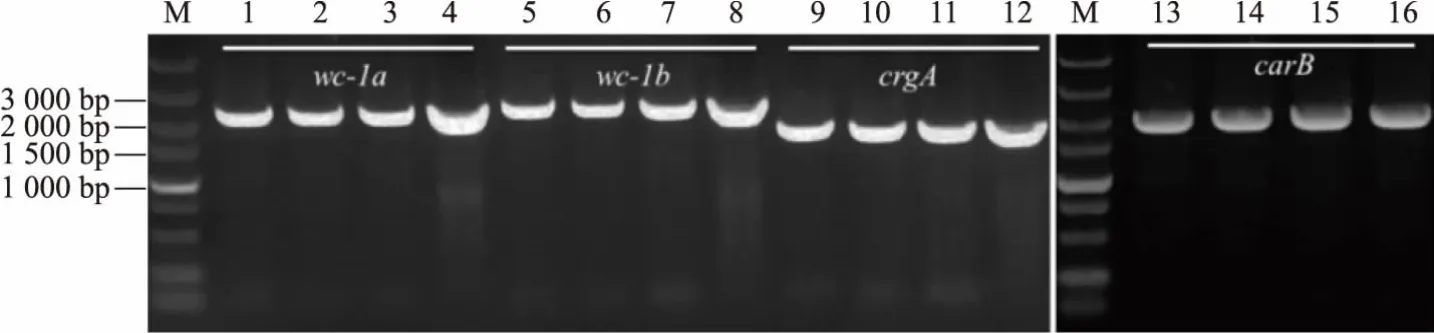
图7 以快速法提取的基因组为模板扩增的wc-1a、wc-1b、crgA和carBFig.7 Amplification of wc-1a,wc-1b,crgA and carB by template extracted by the rapid method
2.5.2 对不同菌株的普适性 传统的以及一些改进的丝状真菌基因组提取方法[13-14,23]均存在着一定的普适性,为确定本研究方法对其他丝状真菌是否也存在适用性,选取另外6种丝状真菌进一步研究。用40 mmol/L NaOH处理卷枝毛霉、产黄青霉、烟曲霉、塔宾曲霉、亮白曲霉和土曲霉10 min,取上清液扩增ITS,卷枝毛霉、产黄青霉、烟曲霉和土曲霉阳性率均为100%,但塔宾曲霉和亮白曲霉扩增阳性率较低,见图8。可能该NaOH浓度和处理时间并非其最适条件,从以上结果可知,NaOH处理法具有一定的普适性,但具体处理条件(NaOH浓度和静置时间)可能需随菌种不同进行适当调整。
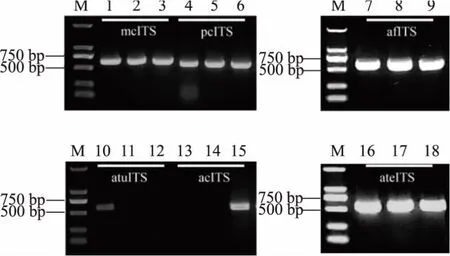
图8 以快速提取的卷枝毛霉、产黄青霉、烟曲霉、塔宾曲霉、亮白曲霉和土曲霉基因组为模板扩增的ITSFig.8 Amplification of ITS by genome of M.circinelloides,P.chrysogenum,A.fumigatus,A.tubingensi,A.candidus and A.terreus extracted by the rapid method
2.6 三孢布拉霉基因组快速提取法与传统方法的比较
丝状真菌基因组提取方法较多,但常用的流程基本都是扩大培养、收集菌体、液氮冷冻、研磨破碎菌体、萃取、沉淀、洗涤、溶解基因组,并重复萃取、沉淀、洗涤和溶解这4个步骤数次,因而操作烦琐、耗时较长。表5将快速提取法与最传统方法进行比较,其他优化的提取方法未详细列出,但快速提取法的优点在与其他方法比较时依然适用。
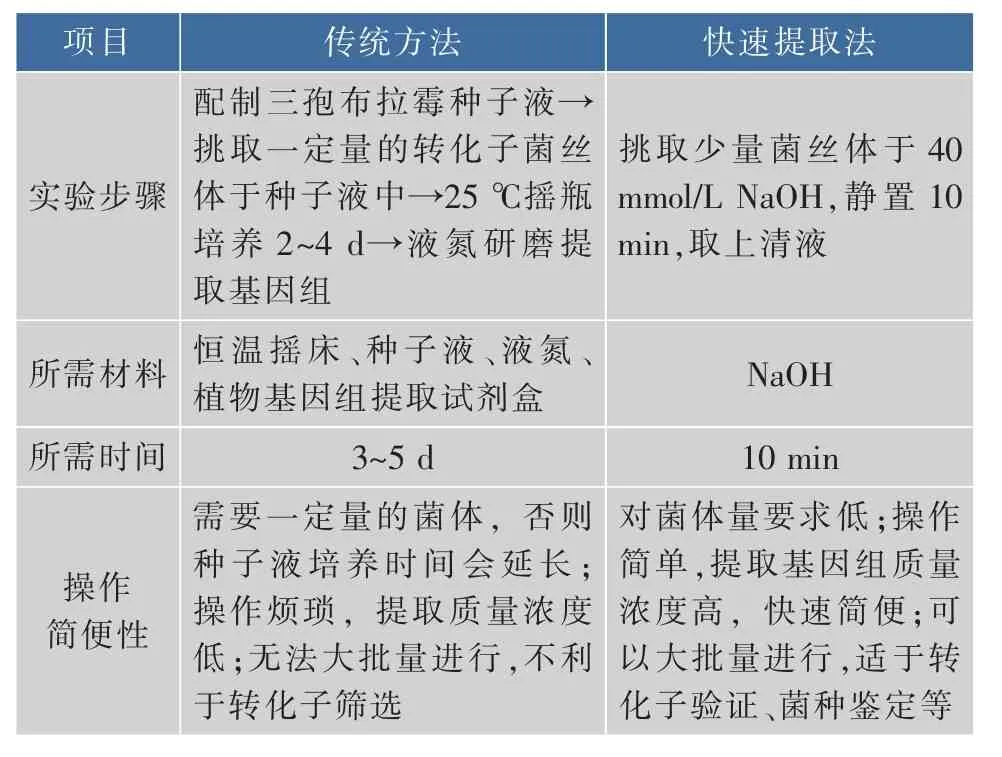
表5 基因组快速提取法与传统试剂盒提取法比较Table 5 Comparison of traditional genome extraction method with the rapid method and the traditional kit extraction
3 结 语
真菌具有复杂的、动态的细胞壁结构,在抵御外界刺激过程中发挥着重要作用[25]。丝状真菌细胞壁主要由葡聚糖、几丁质、壳聚糖、甘露聚糖、糖蛋白等组成[26-28],结构复杂,外界物质不易穿透,因而无法像原核生物那样不经过处理或经过简单处理后即可进行菌落PCR。因此,当对丝状真菌进行基因编辑操作后,筛选转化子的工作便非常耗时耗力,且无法大批量进行。本研究中,先筛选出影响三孢布拉霉基因组释放的关键因素,确定了在添加20 mmol/L NaOH煮沸30 min后,取菌苔作为基因组源可扩增出目的条带;然后对NaOH浓度、煮沸时间及基因组源(上清液或处理后的菌苔)进行了优化。当NaOH浓度达到20 mmol/L后,以上清液为基因组源均可扩增出目的条带。对所提取基因组的稳定性及其对后续测序、酶切等实验的影响进行了验证,发现快速法提取的基因组至少在25℃静置60 h或6℃静置108 h后质量浓度(150~350 ng/μL)与纯度 (OD260/OD2801.8~2.0)依然非常理想,用于PCR时与传统基因组提取法效果无明显差异,且不影响后续基因测序和对基因片段的酶切等研究;最后,从三孢布拉霉其他基因和其他丝状真菌ITS序列两个方面进行了基因组快速提取法普适性的分析,发现在40 mmol/L NaOH处理10 min的条件下,三孢布拉霉中wc-1a、wc-1b、crgA和carB的扩增的阳性率均为100%,卷枝毛霉、产黄青霉、烟曲霉和土曲霉ITS的扩增阳性率也为100%,但塔宾曲霉和亮白曲霉ITS的阳性率不高,只有30%,可能是因为该条件对其而言非最佳提取条件,需要对NaOH浓度和处理时间重新进行优化。从以上结果可知,NaOH处理法对多种丝状真菌基因组的快速提取具有较好的适用性,但最适处理条件需依照不同菌株进行适当的调整。由于过高的NaOH浓度会对基因组的稳定性产生影响,过长的NaOH处理时间违背了快速提取法的快速性,因此无法确定一个既相对温和又适用于各种丝状真菌的处理条件。针对不同的菌种,可通过控制NaOH处理时间并对NaOH浓度进行简单的优化来确定其最适处理条件。
基因组常规提取法需要先对目的菌株进行种子培养,然后收集菌体,经液氮研磨后利用试剂盒或其他自备的试剂进行基因组的萃取、沉淀、洗涤、溶解,整个过程耗时很长,需要一些设备及试剂的支持,既耗时耗力,还存在一定的安全隐患。而快速提取法只经过NaOH静置处理一步,操作简便,耗时非常短,所需材料少,不需要特殊设备,既可少量提取,也可大量制备,且不影响后续分子操作,具有很高的经济性、简便性与高效性,为丝状真菌大规模基因编辑提供了有利条件。
