理脾复方制剂及硫酸锌对大鼠结肠平滑肌细胞增殖及其脑肠肽的影响
2021-11-06刘启艳詹伟高娜张力文庞平李春彭玉
刘启艳, 詹伟, 高娜, 张力文, 庞平, 李春, 彭玉
小儿厌食症指排除全身性和消化道器质性疾病,较长时间的食欲减退或消失、食量减少甚至拒食的一种常见疾病[1]。我国学龄前儿童厌食症发病率为12%~34%,每年有递增趋势[2]。若本病治疗不及时,可影响儿童生长发育,轻者发生疳证(营养不良),重者并发佝偻病以及贫血等[3]。因此,小儿厌食症仍是中西医儿科医生共同关注及防治的疾病之一。目前研究表明,小儿厌食症的发生多种脑肠肽异常变化有关,如神经肽Y(neuropeptide Y,NPY)、八肽胆囊收缩素(cholecystokinin-octopeptide,CCK-8)、瘦素(leptin,LP)[4-6]等。因此,认为脑肠肽异常表达可导致“脑肠肽-食欲中枢紊乱”,这是发生小儿厌食的重要环节[7]。在治疗小儿厌食症诸多药物中,微量元素锌是最为常见药物,而中药也具有较强的优势。理脾复方制剂是贵州中医药大学第二附属医院治疗小儿厌食的验方-运脾散(院内制剂名为运脾颗粒)基础上研发的实验用颗粒制剂。前期研究发现,运脾散治疗厌食的有效率达93.3%[8]。目前,中西医药物发挥其治疗研究机制多从血液或组织标本进行探索,而从细胞水平进行研究甚少。故此,本研究通过低、中、高剂量理脾复方制剂和硫酸锌含药血清作用于大鼠结肠平滑肌细胞(colon smooth muscle cells,CSMCs),开展理脾复方制剂和硫酸锌含药血清对大鼠CSMCs增殖及其该细胞分泌的LP、NPY、CCK-8的调控影响,以期研究成果能阐释理脾复方制剂和硫酸锌治疗厌食的作用机制与靶点。
1 材料与方法
1.1 动物 30日龄SPF级SD大鼠60只,雌雄各半,体质量(60±5)g,生产许可合格证号:SCXK(湘)2014-0011。
1.2 实验药物 理脾复方制剂组方药材(苍术、白术、茯苓、薏苡仁各10 g,山药、陈皮、枳壳、神曲、甘草各6 g)由贵州中医药大学第二附属医院中药房提供,经贵州中医药大学中药鉴定教研室刘晓龙博士鉴定,委托贵州中医药大学药学院刘文教授参照陈大业方法[9-10]制备理脾复方制剂颗粒,其含量为2.70 g/kg,供试品样品按干燥品计算,含柚皮苷(C27H32O11)应不得<0.98 mg/g,含橙皮苷(C28H34O13)不得<0.52 mg/g;硫酸锌口服液(浙江迪耳药业有限公司,批号:13171001)。
1.3 主要试剂 高糖培养基(Gibco);0.25%胰蛋白酶、青-链霉素溶液(HyClone);胎牛血清(Sera);绵羊血清、二甲基亚砜(Solarbio);即用型快捷免疫组化MaxVisionTM试剂盒兔抗鼠、DAB显色试剂盒(迈新试剂);抗大鼠α-平滑肌肌动蛋白抗体(博士德生物);细胞增殖试剂盒、RIPA(强)组织细胞快速裂解液、聚氰基丙烯酸正丁酯(butyleyanoacrylate,BCA)蛋白浓度测定试剂盒(增强型)、山羊抗兔IgG、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)一抗抗体、LP ELISA试剂盒、NPY ELISA试剂盒、CCK-8 ELISA试剂盒(武汉贝茵莱生物科技有限公司);荧光聚合酶链反应试剂盒(美国KAPABiosystems公司);逆转录试剂盒(北京索莱宝科技有限公司);LP、NPY一抗抗体(英国Abcam公司);CCK-8一抗抗体(美国Invitrogen公司)。
1.4 主要实验仪器 EPS300电泳仪、Tanon-5200全自动化学发光分析仪(上海天能);Multiskan FC酶标仪(Thermo);DMIL LED倒置相差显微镜(OLYMPS);CFX-Connect 96荧光定量聚合酶链反应仪(Bio-Rad);JY045-3C凝胶成像系统(北京君意);DM3000显微镜(Leica);ST16R型台式高速冷冻离心机(长沙迈佳森仪器设备有限公司)。
1.5 方法
1.5.1 大鼠CSMCs简化培养与细胞鉴定、保存 本实验大鼠CSMCs原代培养参照刘启艳简化方法[11]进行CSMCs原代、传代培养及鉴定、保存。
1.5.2 含药血清制备 60只幼龄大鼠中取10只培养大鼠CSMCs,余50只大鼠参照文献[12]实验动物随机分组法分为对照组,低、中、高剂量理脾复方制剂组,硫酸锌组,每组10只。对照组灌胃给予等体积饮用水;硫酸锌组灌胃给予20 mg/kg硫酸锌口服溶液;低、中、高剂量理脾复方制剂组分别灌胃给予2.4、4.8、9.8 g/kg理脾复方制剂,各组每日灌胃1次,连续7 d,末次灌胃后1~2 h后予2%戊巴比妥钠3 mL/kg,腹腔麻醉后股动脉采血,各组血液静置2 h后,离心(2 000 r/min×10 min)后无菌分离血清,0.22 μm过滤器进行过滤,置于-20 ℃冰箱保存备用,使用时室温恢复并采用高糖培养基(dulbecco′s modified eagle medium,DMEM)培养基稀释成10%浓度。
1.5.3 CCK-8细胞增殖检测 收集对数期第3代CSMCs,用DMEM培养基重悬细胞,调整细胞悬液浓度,接种于96孔板中(5×103个细胞/孔,每孔180 μL),边缘孔用无菌磷酸盐缓冲液填充,同时设置调零孔(培养基),对照孔(相应浓度、相应组别含药血清)每组设3复孔,置37 ℃,5%CO2培养箱中培养过夜,细胞贴壁后按上述分组处理细胞,培养至各预设的时间点(0、2、4、6、8、12、24、36、48 h),向每孔加入10 μL CCK-8溶液,继续培养4 h后在酶联免疫检测仪450 nm处测量各孔的吸光值(OD值),每组取3孔平均值,计算增殖率并绘制细胞增殖曲线,寻找含药血清对大鼠CSMCs增殖影响最佳起始时间点。增殖率=(含药血清组OD值-对照组OD值)/对照组OD值×100%。
1.5.4 酶联免疫吸附法测CSMCs的LP、NPY、CCK-8蛋白浓度 提取10%含药血清干预大鼠CSMCs至最佳增殖起始时间点,收集各组别细胞,提取总蛋白。严格按照LP、NPY、CCK-8酶联免疫吸附法试剂盒操作进行。
1.5.5 蛋白质印迹法检测CSMCs的LP、NPY、CCK-8蛋白相对表达量 将提取后各组CSMCs总蛋白,BCA法定量后,100 ℃水煮5 min蛋白变性,聚丙烯酰胺凝胶电泳电分离蛋白移至聚偏二氟乙烯膜,经稀释后的LP、NPY、CCK-8抗体孵育、电化学发光显色后,置于凝胶成像仪中观察各组LP、NPY、CCK-8蛋白表达的变化情况。
1.5.6 实时聚合酶链反应法检测CSMCs的LP、NPY、CCK-8 mRNA相对表达量 从NCBI基因库中查寻目标基因序列,LP和GAPDH引物由武汉华联科生物技术有限公司合成,CCK-8和NPY引物由武汉擎科创新生物技术有限公司合成。Trizol法提取各含药血清组干预至最佳增殖起始点时CSMCs的RNA。引物序列如下:GAPDH,上游:5′-CAA GTT CAA CGG CAC AG-3′,下游5′-CCA GTA GAC TCC ACG ACA T-3′;CCK-8,上游:5′-AGC AGG TCC GCA AAG-3′,下游:5′-GGC CGA AAT CCA TCC-3′;LP,上游:5′-CCC ATT CTG AGT TTG TC-3′,下游:5′-GGT CTC GCA GGT TCT-3′;NPY,上游:5′-GAC CCT CGC TCT ATC C-3′,下游:5′-TTG ATG TAG TGT CGC AGA-3′;扩增片段长度分别为36,12,15,11 bp。选GAPDH作为内参基因。完成反转录反应体系和cDNA扩增反应体系,反应条件:95 ℃ 3 min,95 ℃ 5 s,56 ℃ 10 s,72 ℃ 25 s,39个循环,65 ℃ 5 s,95 ℃ 50 s。以GAPDH为内参,用2-ΔΔCT法计算样品中基因相对表达量。各组大鼠LP、NPY、CCK-8基因表达量(△Ct值),△Ct=目的基因Ct-内参照基因Ct。
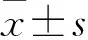
2 结果
2.1 10%理脾复方制剂和硫酸锌含药血清在24 h时开始稳定促进CSMCs增殖 见图1。
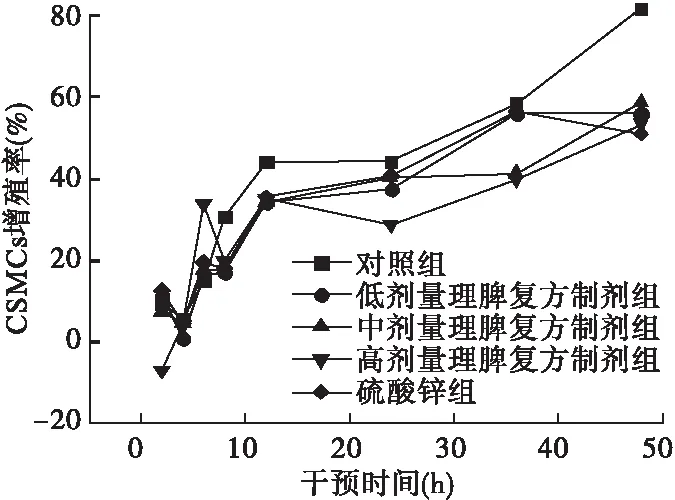
图1 10%含药血清对正常大鼠CSMCs增殖的影响
图1结果表明,在2 h时,高剂量理脾复方制剂组10%含药血清抑制CSMCs增殖;在4 h时,除高剂量理脾复方制剂组外,其余各组10%含药血清中的CSMCs增殖率呈持续、非匀速增高;在8 h及24 h时间点,各组CSMCs增殖率呈下降趋势;24~36 h,各组CSMCs增殖率呈均速增高。此外,各组CSMCs在24 h以后,其增殖率均在20%以上,处于对数增长期,故此24 h为最佳起始时间点。
2.2 10%含药血清干预大鼠CSMCs后的LP、NPY、CCK-8蛋白浓度 10%理脾复方制剂与硫酸锌含药血清上调大鼠CSMCs中LP、NPY蛋白浓度,下调CCK-8蛋白浓度,见表1。
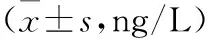
表1 10%含药血清干预大鼠CSMCs后的LP、NPY、CCK-8蛋白浓度
表1结果表明,与对照组比较,10%理脾复方制剂含药血清对大鼠CSMCs的LP、NPY蛋白浓度均为上调作用,差异有统计学意义(P<0.05),上调作用呈高剂量理脾复方制剂组>中剂量理脾复方制剂组>低剂量理脾复方制剂组;对CCK-8均为下调作用,差异有统计学意义(P<0.05),下调作用呈高剂量理脾复方制剂组>中剂量理脾复方制剂组>低剂量理脾复方制剂组。10%硫酸锌含药血清对LP、NPY蛋白浓度有上调作用,对CCK-8蛋白浓度有下调作用,差异有统计学意义(P<0.05)。
2.3 10%含药血清干预大鼠CSMCs后的LP、NPY、CCK-8蛋白相对表达量 10%理脾复方制剂与硫酸锌含药血清上调大鼠CSMCs中LP、NPY蛋白相对表达量,下调CCK-8蛋白相对表达量,见表2。
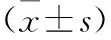
表2 10%含药血清干预大鼠CSMCs后的LP、NPY、CCK-8蛋白相对表达量
表2结果表明,与对照组比较,10%理脾复方制剂含药血清对大鼠CSMCs中LP、NPY蛋白相对表达量均为上调作用,差异有统计学意义(P<0.05),上调作用呈高剂量理脾复方制剂组>中剂量理脾复方制剂组>低剂量理脾复方制剂组,对CCK-8蛋白相对表达量各组蛋白均为下调作用,差异有统计学意义(P<0.05),下调作用呈高剂量理脾复方制剂组>中剂量理脾复方制剂组>低剂量理脾复方制剂组。10%硫酸锌含药血清对大鼠CSMCs中LP、NPY蛋白相对表达量有上调作用,对CCK-8蛋白相对表达量有下调作用。
2.4 10%含药血清干预大鼠CSMCs后的LP、NPY、CCK-8 mRNA相对表达量 10%理脾复方制剂与硫酸锌含药血清上调大鼠CSMCs中LP、NPY、CCK-8 mRNA相对表达量,见表3。
表3结果表明,与对照组比较,10%理脾复方制剂含药血清对大鼠CSMCs中LP、NPY mRNA相对表达量有上调作用,除低剂量理脾复方制剂组外,差异有统计学意义(P<0.05),上调作用呈高剂量理脾复方制剂组>中剂量理脾复方制剂组>低剂量理脾复方制剂组,对CCK-8表达有上调作用,差异有统计学意义(P<0.05),表达量上调趋势呈低剂量理脾复方制剂组>中剂量理脾复方制剂组>高剂量理脾复方制剂组;10%硫酸锌含药血清对大鼠CSMCs中LP、NPY、CCK-8 mRNA相对表达量有上调作用。
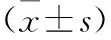
表3 10%含药血清干预大鼠CSMCs后的LP、NPY、CCK-8 mRNA相对表达量
3 讨论
结肠位于消化道末端,主要由黏膜层、黏膜下层、肌层和外膜四层组成,结肠肌层包括纵行肌和环形肌,这是结肠运动的基础[13],纵肌主要产生肌张力,环肌主要产生位相性收缩,共同将肠内容物推向直肠,以排出体外。摄食行为主要经过以下两种方式影响结肠运动:进食与否:空腹时多见的袋状往返运动,进食时见分节推进运动及多袋推进运动,这两种运动均可推动食物残渣向前运动,以促进结肠内容物排出体外[14];胃-结肠反射:当机体摄入食物时,由于胃的拉伸而增加结肠的蠕动,而结肠蠕动可促进结肠排空,为食物增加消化空间,这种现象称之为胃-结肠反射,其实质是食物摄入的结肠反应[15],小儿进食时易引发胃-结肠反射[16],两种方式均与神经肽密切相关[15]。
LP、NPY、CCK-8既是胃肠道中的神经肽,亦是脑肠肽,三者均影响胃肠运动及食欲变化。LP是一种主要由脂肪细胞产生的相对分子质量16 000的多肽,骨骼肌、胃、脑下垂体等组织可能产生少量的LP。LP通过可溶性LP受体刺激阿黑皮素神经肽合成并产生α-促黑激素,发挥抑制食欲与减少体质量作用。NPY由36个氨基酸组成的活性单链多肽,由于结构中富含酪氨酸,故称为神经肽酪氨酸,“Y”指的就是分子两端的酪氨酸残基,是最有效的食欲肽之一。CCK由115个CCK氨基酸前体衍生而来,包括硫酸化的CCK-8和CCK-7、非硫酸化的CCK-8和CCK-7、CCK-5等[17],是第一个被证明具有厌食作用的肠道激素。既往研究发现CCK在肠道平滑肌的分布及兴奋作用向直肠方向呈阶梯递减趋势[18],NPY的Y1和Y2受体mRNA在小鼠降结肠表达[19],可溶性LP受体在胃肠道中大量存在[20],传入和传出迷走神经末梢均含可溶性LP受体[21]。由此可推测,CSMCs分泌LP、NPY、CCK-8影响摄食行为,其药物发挥治疗厌食作用机制可能通过调节其CSMCs中的LP、NPY、CCK-8表达。故此,本实验对治疗小儿厌食的有效药物,即理脾复方制剂和硫酸锌口服液进行相关研究。
理脾复方制剂原名为运脾散(院内制剂名为运脾颗粒),是贵州中医药大学治疗厌食的经验方,该方为“四君子汤”和“平胃散”化裁而来,由苍术、白术、茯苓、山药、薏苡仁、陈皮、枳壳、神曲、甘草共同组成。在该方药物中,100%药物含挥发油,挥发油多为芳香药物所含,“香能通气,能主散,能醒脾阴……能和合五脏”(《药品化义》)。此外,芳香之药有化湿、燥湿、理气、温中醒脾之效,如《医方考》所言:“脾胃喜甘而恶苦,喜香而恶秽,喜燥而恶湿,喜利而恶滞……香能开胃窍。”另外,该方药物中,100%药物归脾经,提示以健脾、运脾之效为主。最后,67%药物甘味,44%药物性味为辛、苦、温,33%药物性味为平,22%药物性味为寒,提示组方药物苦甘相得、辛苦相宜、温寒并用,使该方充分发挥行湿、燥湿、化湿、下湿之效,“理顺脾胃气机转枢,恢复胃纳脾运”作用。但其发挥治疗小儿厌食症的作用具体机制则不详。本研究结果发现,10%低、中、高剂量理脾复方制剂含药血清促进CSMCs增殖,提示理脾复方制剂可影响结肠运动及CSMCs脑肠肽的表达。此外,本实验研究发现,10%理脾复方制剂含药血清有上调CSMCs中LP、NPY蛋白浓度、蛋白相对表达量、mRNA相对表达量,下调CCK-8蛋白浓度及蛋白相对表达量,且提示调节LP、NPY、NPY的作用随理脾复方制剂的剂量增大而增强,证实理脾复方制剂有调控CSMCs中LP、NPY、CCK-8表达,这可能是理脾复方制剂发挥治疗厌食作用的重要机制和靶点之一。
生长迟缓和摄食减少是锌缺乏的早期症状[22],研究显示缺锌饮食后的3~5 d内,食物摄取量被抑制[23]。由于锌具有改善味觉及增进食欲的作用,许多早期厌食患儿家长及临床儿科医生给予补充锌元素,锌补充剂也被儿童普遍接受,且无论补充哪种锌盐(硫酸锌、醋酸锌或葡萄糖酸锌)都是有效的[24]。但补充微量元素锌是否影响CSMCs的增殖或其内脑肠肽的表达,未见相关报道。本实验研究发现,10%硫酸锌含药血清促进CSMCs增殖,上调CSMCs中LP、NPY蛋白浓度、蛋白相对表达量、mRNA相对表达量,下调CSMCs中CCK-8蛋白浓度、蛋白相对表达量,证实硫酸锌能调控CSMCs中LP、NPY、CCK-8表达,这可能是硫酸锌发挥治疗厌食作用的另一重要机制。
综上,理脾复方制剂和硫酸锌可促进CSMCs增殖,影响CSMC中LP、NPY、CCK-8的表达,可能是治疗厌食的重要作用机制之一。但是,本研究结果发现,10%理脾复方制剂和硫酸锌含药血清对CCK-8 mRNA调控作用与蛋白浓度及蛋白相对表达量调控作用相反,这提示理脾复方制剂与硫酸锌对CSMCs中CCK-8在转录和翻译水平影响上可能不同,但其具体机制有待进一步研究。
