抗菌肽BCp12对大肠杆菌壁膜及DNA损伤的作用机制
2021-10-31李钰芳施娅楠黄艾祥
杨 昆,王 欢,高 洁,李钰芳,赵 琼,施娅楠,黄艾祥
(云南农业大学食品科学技术学院,云南 昆明 650201)
大肠杆菌(Escherichia coli)是人和多数动物体内常见的肠道共生革兰氏阴性菌[1],并且广泛存在于动植物产品中[2-3],肉制品在加工过程中极易受到大肠杆菌污染,从而引发食源性疾病[4]。因此,有效抑制动植物产品中的大肠杆菌的增殖生长,对提高食品的安全性显得尤为重要。
抗菌肽是一类天然的具有抗细菌或真菌作用的活性肽,作为新型天然食品防腐剂而备受关注[5]。作为天然来源的抗菌肽,与传统的抗菌剂相比,其在发挥抑菌作用的同时不易产生耐药性,因此其抑菌机理已成为广大学者的研究热点[6]。抗菌肽BCp12是本课题组从槟郎江水牛酪蛋白中分离出的新型抗菌肽,一级结构为YLGYLEQLLRLK,分子质量为1 508.82 Da,属于热稳定性高的疏水性阳离子抗菌肽,且对大肠杆菌具有良好的抑菌效果[7]。谢海伟等[8]研究发现抗菌肽首先作用于细胞膜,随着作用时间和浓度效应变化,细胞膜通透性增加,胞膜裂解,这表明细胞膜是其首要和重要作用靶点。王梓源等[9]研究发现ε-聚赖氨酸能够增强大肠杆菌细胞表面疏水性及细胞内、外膜的通透性,并且改变菌体细胞膜内外电势,使其细胞内容物如核酸、蛋白质等大量渗出,从而实现对菌体的杀菌作用。陈旋等[10]研究发现抗菌肽P7能特异性地结合rnhA序列,引起大肠杆菌DNA的损伤,并抑制大肠杆菌的DNA复制。
目前,抗菌肽BCp12的研究主要集中在纯化、鉴定及性质方面,并没有对其抑菌机制进行研究。因此,本实验从抗菌肽BCp12对大肠杆菌的生长繁殖、壁膜损伤机制及DNA的影响3 个方面来揭示BCp12对大肠杆菌壁膜及DNA的损伤机制。
1 材料与方法
1.1 材料、菌种与试剂
抗菌肽BCp12是用本课题组自主研发的贯筋藤蛋白酶对槟榔江水牛酪蛋白进行酶解,利用活体大肠杆菌亲和吸附法联合反相高效液相色谱(reverse phase highperformance liquid chromatograph,RP-HPLC)技术从酶解液中靶向分离得到的,利用UniProt数据库(https://www.uniprot.org/)预测分析酪蛋白的功能活性,发现该序列来源于牛αS1-酪蛋白,属于新抗菌肽,由安徽国平药业有限公司合成,纯度为95%以上。
大肠埃希氏菌CICC10003 中国工业菌种保藏中心。
正十六烷 山东西亚化学工业有限公司;溴化乙锭(ethidium bromide,EB) 山东西亚化学股份有限公司;细菌基因组DNA提取试剂盒 北京索莱宝生物科技有限公司;0.02 mol/L pH 7.4磷酸盐缓冲液(phosphate buffer saline,PBS) 赛国生物科技有限责任公司。
1.2 仪器与设备
Synergy HI全波长荧光酶标仪 美国Biotek公司;GR85DA高压灭菌锅 美国Zealway公司;DW-HL388-86 ℃冰箱 中科美菱低温科技有限公司;UV-6100紫外-可见分光光度计 上海美谱达仪器有限公司;ZQZY-85CS振荡培养箱 上海知楚仪器有限公司;NEXUS 470傅里叶变换红外光谱仪 美国赛默飞世尔科技公司;FlexSEM1000 HITACHI落地式扫描电子显微镜 日本日立公司;JEM-1200EX透射电子显微镜 日本JEOL公司;Gel-Doc XRS免疫电泳成像系统 美国Bio-Red科技公司。
1.3 方法
1.3.1 BCp12对大肠杆菌生长繁殖影响的测定
1.3.1.1 最小抑菌浓度及抑菌曲线的测定
参照文献[11]的研究方法,取对数生长期的大肠杆菌菌液,用0.02 mol/L pH 7.4 PBS稀释至106CFU/mL,使用96 孔板进行实验。每孔加入190 μL新鲜Luria-Bertani(LB)培养基、10 μL菌液和50 μL抗菌肽BCp12溶液,BCp12的终质量浓度分别为0、1、1.6、2、3.2 mg/mL。以等体积无菌水为空白对照组,于37 ℃恒温培养箱培养18 h,用酶标仪测定OD600nm。能完全抑制病原菌生长的最低质量浓度作为最小抑菌浓度(minimum inhibitory concentration,MIC)。然后,参照Cirioni等[12]的研究方法,测定不同质量浓度的BCp12对大肠杆菌的抑菌效果。每小时测一次OD600nm,测7 次并计算出平均值,以时间为横坐标、OD600nm为纵坐标,绘制抑菌曲线。
1.3.1.2 大肠杆菌生长曲线的测定
参照孟兆丽[13]的研究方法,并稍作修改。取对数生长期的大肠杆菌菌液,用0.02 mol/L pH 7.4 PBS稀释至106CFU/mL,实验组加入等体积BCp12溶液并使其终质量浓度为MIC,空白对照组和四环素对照组分别加入等体积的无菌水和四环素溶液(2 mg/mL)代替BCp12溶液。37 ℃、120 r/min连续培养24 h,每2 h取样1 次,用酶标仪测定OD600nm,每个时间点重复3 次,取平均值绘制生长曲线。
1.3.2 BCp12对大肠杆菌壁膜损伤的机制研究
1.3.2.1 菌体细胞壁表面疏水性分析
参照文献[14]的方法,取对数生长期的大肠杆菌菌液,10 000 r/min离心2 min,收集菌体沉淀,加入等体积PBS将菌体沉淀重悬,10 000 r/min离心2 min,收集菌体沉淀加入等体积的0.02 mol/L pH 7.4 PBS,重复上述离心洗涤操作,洗涤3 次后,将菌体沉淀重悬于0.1 mol/L的KNO3溶液,调整菌液浓度为1.0×106CFU/mL备用,并测定该菌悬液于405 nm处的光密度,记为OD0。然后取1.2 mL菌悬液,加入200 μL的一定质量浓度的BCp12溶液,使其终质量浓度为MIC;KNO3组加入200 μL 0.1 mol/L KNO3溶液;正十六烷组加入200 μL正十六烷分别于室温孵育10 min,漩涡振荡2 min,使各溶液充分的混合,静置15 min后,快速吸取上清液置于96 孔板中,每组重复3 次,测定405 nm处的光密度(OD405nm)。菌体壁膜表面疏水性与吸附率相关,因此可用大肠杆菌吸附率来反应菌体壁膜表面疏水性的变化,大肠杆菌吸附率按下式进行计算。
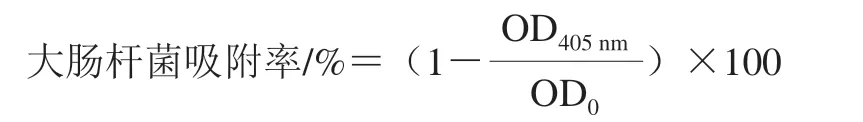
1.3.2.2 菌体细胞膜通透性的测定
参照Al-Adham等[15]的研究方法,取1.3.2.1节用PBS洗涤3 次的菌体沉淀,用PBS重悬得到1.0×106CFU/mL的大肠杆菌菌悬液,并加入等体积BCp12溶液,使BCp12终质量浓度分别为MIC、1/2 MIC,对照组添加等体积的无菌水,于37 ℃恒温孵育一定时间,分别在培养的2、4 h取样,10 000 r/min离心2 min,取上清液于260 nm和280 nm测定其光密度,分别用于检测胞内核酸和蛋白质的泄漏情况。
1.3.2.3 流式细胞仪分析菌体细胞膜的完整性
参照文献[16]并稍作修改。取1.3.2.1节用PBS洗涤3 次的菌体沉淀,用PBS重悬得到1.0×106CFU/mL的大肠杆菌菌悬液,并加入等体积BCp12溶液,使BCp12终质量浓度为MIC,对照组添加等体积的无菌水。均匀混合后,于37 ℃恒温培养箱培养6 h,孵育结束后,用PBS洗涤菌体沉淀3 次,以终止抗菌肽继续发挥作用。上机前加入终质量浓度为50 μg/mL的碘化丙啶(propidium iodide,PI)染液,用流式细胞仪分析PI着染阳性细菌数[17]并分析菌体细胞膜的完整性。
1.3.2.4 BCp12对菌体壁膜组分的影响
参照文献[18]并进行适当调整。取1.3.2.1节用PBS洗涤3 次的菌体沉淀,用PBS重悬得到1.0×106CFU/mL的大肠杆菌菌悬液,并加入等体积BCp12溶液,使BCp12终质量浓度分别为MIC、1/2 MIC,对照组添加等体积的无菌水。置于37 ℃恒温培养一定时间后,取10 μL于透明光学晶片(KBr)上,立即置于装有硅胶的减压干燥器中,将其干燥成透明的膜状物。按中华人民共和国药典的方法校准仪器。取出空白KBr晶片,立即置于样品窗口中,测定吸收后红外光谱图,用于矫正空白。测量参数:分辨率4 cm-1、扫描次数32 次、扫描范围400~4 000 cm-1。用同样方法和参数测定载有透明膜状物的KBr晶片[19]。
1.3.2.5 对菌体壁膜超微结构的观察
取1.3.2.1节用PBS洗涤3 次的菌体沉淀,用新鲜LB培养基重悬为1.0×106CFU/mL菌悬液,加入BCp12使其终质量浓度为MIC,对照组添加无菌水,对照组于37 ℃培养5 h、BCp12处理后于37 ℃培养5、10、15 h时分别取样,在10 000 r/min下离心5 min,加入等体积PBS按照1.3.2.1节方法洗涤3 次,收集菌体沉淀。向菌体沉淀中加体积分数为2.5%戊二醛溶液固定12 h,将固定好的菌体于室温10 000 r/min离心2 min,除去固定液,PBS洗涤3 次后得到菌体沉淀。依次用体积分数为30%、50%、70%、80%、90%、100%的乙醇溶液梯度脱水,每次脱水时间为10 min,其中100%乙醇脱水2 次,并用100%乙醇重悬。最后,吸取一定量的重悬液在载样台上烘干,并进行镀金,上样,用扫描电子显微镜观察[20]。
菌液处理同上,于37 ℃培养10、12 h时分别取样。参考文献[21],取PBS洗涤3 次后的菌体沉淀,加入体积分数为2.5%戊二醛溶液固定12 h;然后,离心收集菌体,用PBS冲洗,并加入体积分数为1%锇酸溶液固定2~4 h;接着用不同梯度浓度的乙醇脱水,并将菌体沉淀用包埋剂进行处理,72 h后对包埋样品进行超薄切片、染色;最后,用透射电子显微镜进行观察、拍照[21]。
1.3.3 BCp12对大肠杆菌DNA影响的分析
1.3.3.1 凝胶阻滞实验分析BCp12与菌体DNA的结合情况
参照Bandyopadhyay等[22]的研究方法,将大肠杆菌接种至无菌的LB液体培养基中,于37 ℃摇床培养,直至对数生长期,然后通过麦氏比浊法确定原菌液的浓度,取1.3.2.1节用PBS洗涤3 次的菌体沉淀,用PBS重悬得到1.0×106CFU/mL的大肠杆菌菌悬液1 mL,按照细菌基因组DNA提取试剂盒进行DNA提取。所获得的DNA溶液用紫外分光计检测其核酸浓度和纯度,测定OD260nm和OD280nm。所提取的细菌基因组DNA纯度均达到实验的要求:1.7≤OD260nm/OD280nm≤1.9。取5.0 μL基因组DNA溶液与不同质量浓度(0、0.625、1.25、2.5、5 mg/mL)的抗菌肽等体积混合,置于37 ℃生化培养箱中作用30 min。反应结束后,用质量分数1%的琼脂糖凝胶跑电泳,观察和分析基因组DNA的迁移结果。
1.3.3.2 荧光光谱实验分析BCp12与菌体DNA的作用方式
参照文献[23]和文献[24],用1×TE缓冲液将菌体DNA稀释为50 μg/mL,然后,在96 孔板的每个孔中加入5 μL的DNA溶液和10 μL 100 μg/mL的EB溶液,混匀后置于37 ℃生化培养箱中,避光孵育10 min。接着加入50 μL不同质量浓度(0、0.625、1.25、2.5、5 mg/mL)的BCp12溶液,对照组用50 μL超纯水代替,混匀后置于37 ℃生化培养箱中避光孵育30 min。孵育结束后,用多功能酶标仪测定样品在激发波长535 nm及发射波长550~750 nm范围内的荧光光谱。
1.4 数据处理与分析
所有实验均进行3 次平行实验,实验数据采用SPSS Statistics 19 软件与GraphPad Prism 8.3.0软件进行统计分析,以平均值±标准差表示。采用Duncan法进行显著差异性比较,P<0.05表示差异显著。
2 结果与分析
2.1 BCp12对大肠杆菌生长繁殖的影响
2.1.1 BCp12对大肠杆菌的最小抑菌质量浓度及抑菌曲线
如图1A所示,BCp12质量浓度越高,OD600nm越小,表示对大肠杆菌的抑菌效果越强。当BCp12的终质量浓度为2 mg/mL时,几乎完全抑制了菌体的生长,由此确定BCp12的MIC为2 mg/mL。由图1B可知,BCp12的抑菌菌效果与抗菌肽的质量浓度成正比关系。与空白对照组(添加无菌水)相比,添加BCp12的菌液,其生长繁殖受到了不同程度的抑制。当BCp12终质量浓度达到2 mg/mL及以上时,其菌体生长被明显抑制。
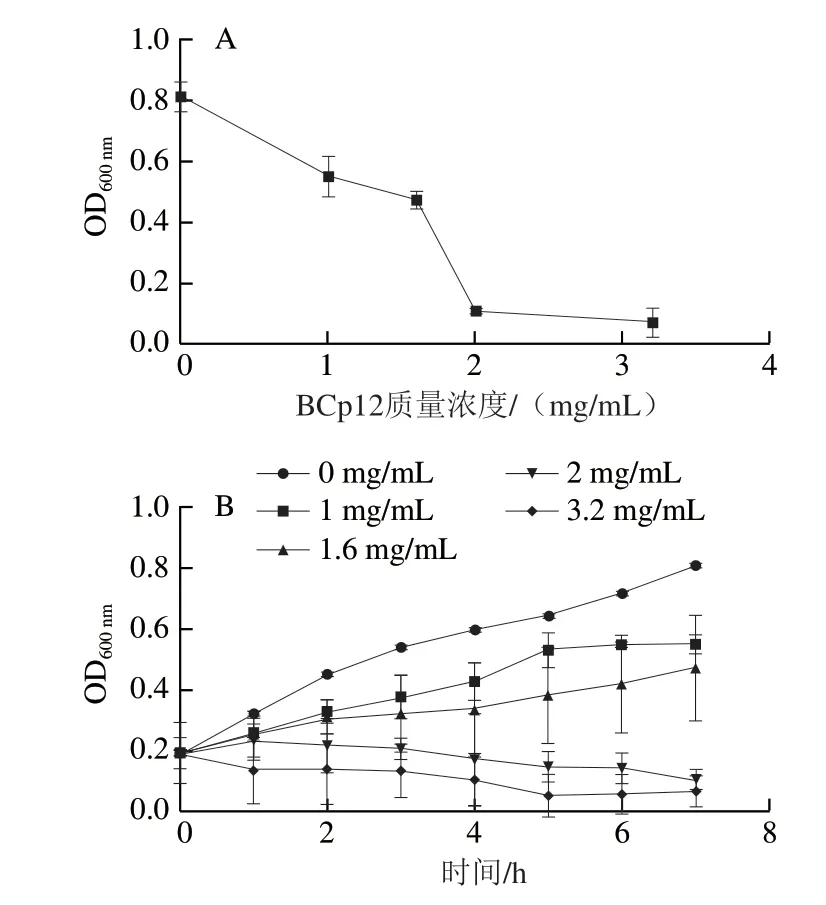
图1 BCp12对大肠杆菌的MIC(A)和抑菌曲线(B)Fig. 1 Minimum inhibitory concentration (A) and time courses (B) of anti E. coli effect of BCp12 at different concentrations
2.1.2 对菌体生长曲线的影响
如图2所示,BCp12对菌体的生长具有明显的抑制作用。在0~14 h期间,空白对照组的菌体生长繁殖速度快,14 h之后趋于平缓,菌体的生长进入相对稳定的时期。添加BCp12的菌液,菌体在0~14 h生长速率也比较快,14 h以后呈现快速下降的趋势,直至最终趋于稳定,但与空白对照组相比,菌体总量明显降低。添加四环素的菌液,菌体生长被明显抑制。通过对3 组的对比,可以看出BCp12有良好的抑菌效果。
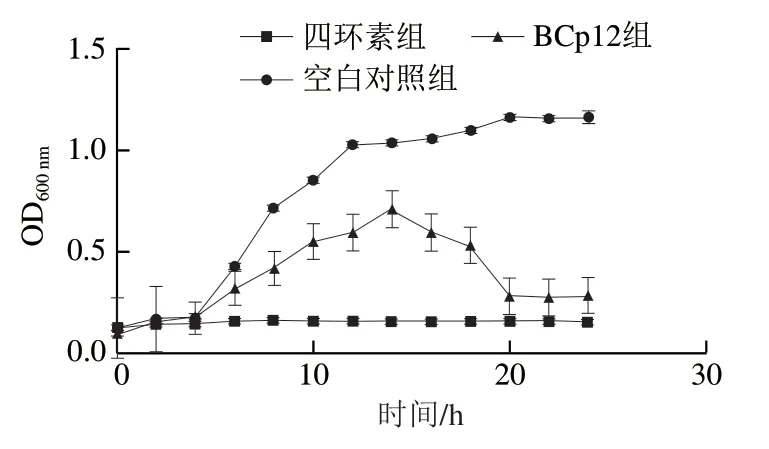
图2 BCp12对大肠杆菌生长曲线的影响Fig. 2 Effect of BCp12 on the growth curve of E. coli
2.2 BCp12对大肠杆菌壁膜损伤的机制
2.2.1 对菌体细胞壁表面疏水性的影响
从图3可见,BCp12能够明显降低菌体细胞壁的表面疏水性。BCp12处理1 h后大肠杆菌吸附率为79.8%,显著低于相同作用时间的正十六烷组(84.3%);作用5 h时,正十六烷组和BCp12处理组大肠杆菌吸附率分别为79.95%和64.73%,BCp12处理组大肠杆菌吸附率表现出显著低于相同时间的其他组(P<0.05)。相同作用时间下,正十六烷组大肠杆菌吸附率显著低于KNO3组(P<0.05)。孙宜君[25]在螺旋藻抗菌肽的纯化鉴定及其抑菌机理的研究中提到,正十六烷是一种有机相,大肠杆菌在水相和有机相中的吸附率是不同的,因此,细菌细胞表面疏水性可由吸附率的大小来反映。另外,阿琪玛[14]对于疏水性的理解为细菌对于有机溶剂的吸附效果,疏水性越大则代表对有机溶剂的黏附效果越强。

图3 BCp12对大肠杆菌细胞壁表面疏水性的影响Fig. 3 Effect of BCp12 on the surface hydrophobicity of E. coli cell wall
综上所述,BCp12可以引起大肠杆菌细胞亲水性增加。这是因为BCp12是阳离子抗菌肽,可与菌体细胞表面带负电的脂多糖结合,导致细菌细胞表面疏水性降低,最终起到破坏细胞壁膜的作用。郭文杰等[26]的研究结果也表明,细胞表面疏水性降低可能是因为抗菌肽与菌体细胞表面相互作用,吸引电负性基团造成重排,从而导致菌体细胞表面电负性增强,疏水性下降。
2.2.2 对菌体细胞膜通透性的影响
如图4所示,正常条件下,培养液中的核酸和蛋白质基本稳定在较低的水平。与对照组(添加无菌水)相比,菌体在1/2 MIC和MIC的BCp12下作用2 h,培养液中的核酸含量无显著变化(P>0.05),蛋白质含量显著增加(P<0.05)。作用4 h后,培养液中的核酸及蛋白含量均显著增加(P<0.05)。

图4 BCp12对大肠杆菌细胞膜通透性的影响Fig. 4 Effect of BCp12 on cell membrane permeability in E. coli
Bajpai等[27]研究表明,核酸作为细胞内重要的大分子物质,当菌体细胞完整性受到破坏时,正常状态下不能透过细胞膜的大分子物质(核酸)通过“蛋白孔道”释放出胞外,泄漏到菌悬液中,由于核酸在260 nm处有强吸收,所以可通过检测菌悬液中核酸泄漏(260 nm处吸光度)的变化来评价细胞膜是否完整。Long Men等[28]的研究表明,核酸、蛋白质等生物大分子贯穿于整个细胞膜和细胞质之中,是细胞的重要组成结构,大肠杆菌细胞膜被破坏时,核酸、蛋白质等大分子物质就会泄漏到胞外。另外,抗菌肽也能通过改变细胞膜的通透性使细胞死亡[29]。
因此,通过测定菌悬液在260、280 nm处吸光度的变化,可分析细胞壁膜的受损情况。上述结果表明:大肠杆菌胞内核酸及蛋白质的泄漏量与BCp12的质量浓度、作用时间呈正比关系;BCp12通过破坏大肠杆菌细胞膜的完整性,致使其通透性增加,引起胞内核酸及蛋白质的渗漏,从而达到抑制菌体增殖的目的。
2.2.3 流式细胞仪分析菌体细胞膜的完整性
如图5所示,M1和M8表示收集的50 000 个大肠杆菌细胞中完整细胞所占的百分比。由图5A可知,未经BCp12处理的菌液在培养6 h后,细胞膜的损伤率几乎为0。由图5B可知,经过MIC BCp12处理的菌液,在培养6 h后,细胞膜的损伤率为25.1%,两者相比差异较大。
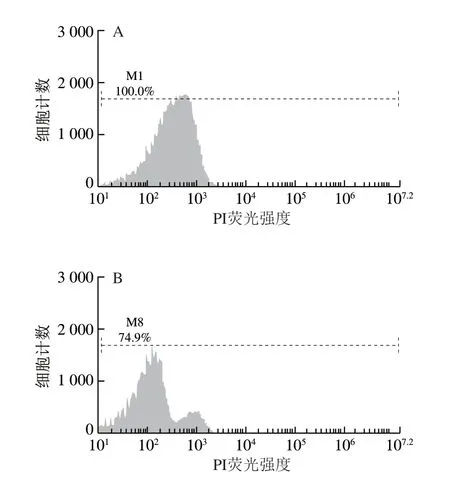
图5 BCp12对大肠杆菌细胞膜完整性的影响Fig. 5 Effect of BCp12 on cell membrane integrity in E. coli
研究表明,PI是一种可对DNA染色的核染色试剂,当细菌细胞膜结构完整时,PI染料无法进入细胞,但当细菌细胞膜完整性遭到破坏后,该染料可穿过破损的细胞膜而对核酸染色,流式细胞仪检测其为红色荧光,PI荧光信号强弱能够反映细胞膜完整性破坏程度[30]。由此可知,经BCp12处理后,菌体的细胞膜发生损伤,即细胞膜不完整,通透性增强。
2.2.4 BCp12对菌体细胞壁膜组分的影响
傅里叶变换红外光谱技术可用来分析微生物细胞壁和细胞质膜的组成成分,通常可分为5 个区域来描述不同的细胞成分信息[18]:1)3 000~2 800 cm-1:脂肪酸信息区;2)18 00~1 500 cm-1:蛋白和多肽酰胺信息区;3)1 500~1 200 cm-1:混合信息区域(蛋白质和脂肪酸);4)1 200~900 cm-1:细胞壁多糖的信息区;5)900~500 cm-1:指纹信息区。如图6所示,与对照组相比,BCp12在以上5 个区间的吸收峰强度出现明显变化,这表明BCp12对大肠杆菌菌体的脂肪酸、蛋白和多肽酰胺、多糖、指纹信息区都有影响。另外,不同质量浓度的BCp12对大肠杆菌壁膜组分的影响,如MIC处理的菌体在3 600~2 500 cm-1区间的其吸收峰强度明显高于1/2 MIC处理组。

图6 BCp12对大肠杆菌细胞壁膜组分的影响Fig. 6 Effect of BCp12 on main components of the cell wall and membrane of E. coli
综上所述,抗菌肽BCp12可以影响大肠杆菌细胞壁膜结构上的组分,与文献[31]和文献[19]报道的结果相似,也验证了前述BCp12对大肠杆菌细胞壁膜的损伤作用。
2.2.5 对菌体壁膜超微结构的影响
如图7A所示,未经BCp12处理过的菌体,其细胞表面圆润光滑,饱满。而经BCp12处理5 h的菌体,细胞形态发生变化,变得粗糙皱缩,无饱满感,少部分细胞具有完整性(图7B)。作用10 h,部分细胞发生自溶,甚至黏连在一起(图7C)。作用15 h,菌体细胞大部分自溶,只有少数的几个细胞保持杆状形态(图7D)。

图7 扫描电子显微镜观察抗菌肽BCp12对大肠杆菌超微结构的变化Fig. 7 Effect of the antimicrobial peptide BCp12 on the ultrastructure of E. coli observed by SEM
张子越[32]在水煎液体外抑制大肠杆菌和痢疾杆菌的作用机制的研究中发现,对照组的菌体形态正常饱满,细胞壁和细胞膜结构完整,经1/2 MIC药物作用6 h后,与对照组相比,有些菌体形态开始变得不规则,菌体变长,有的菌体皱缩变圆发生死亡。Matsuzaki[33]、Sebe[34]等关于抗菌肽作用机制的研究报道也证明了这一结论。由此确定,BCp12主要通过破坏菌体的细胞壁膜,致使胞内物质流出来,引起壁膜发生皱缩,变得凹凸不平,产生自溶现象,进而达到抑制菌体生长的效果。
如图8所示,用无菌水处理的大肠杆菌细胞膜结构光滑完整,无破损,细胞内容物充实致密(图8A、C)。与对照组相比,MIC BCp12作用菌体10 h,菌体细胞膜有明显的孔洞、撕裂及受伤情况,且胞内物质发生泄漏(图8B);作用菌体12 h,部分细胞壁膜、细胞器和细胞核区消失,甚至细胞质内出现空化现象(图8D)。石伟[35]通过透射电子显微镜观察发现,蜂毒肽melittin作用于水稻白叶枯病菌细胞膜后,细菌细胞膜结构破坏,内容物被完全释放出来,且呈囊泡状结构。这与本研究结果相似,也证实了BCp12能够破坏菌体的细胞膜,且使菌体细胞器消失,进而出现空化现象,以达到抑制菌体生长繁殖的作用。

图8 透射电子显微镜观察抗菌肽BCp12对大肠杆菌超微结构的变化Fig. 8 Effect of the antimicrobial peptide BCp12 on the ultrastructure of E. coli observed by TEM
2.3 BCp12对大肠杆菌DNA的影响
2.3.1 凝胶阻滞实验分析BCp12与菌体DNA的结合情况如图9所示,BCp12可以与EB竞争性结合大肠杆菌的DNA,且使DNA在泳道中出现拖尾和偏移。当BCp12的终质量浓度在0~2.5 mg/mL时,BCp12与大肠杆菌DNA出现一定程度的结合,泳道中出现拖尾现象,同时有部分DNA被阻滞在凝胶孔中。当BCp12质量浓度为5 mg/mL时,DNA的迁移几乎完全受阻,无法看到DNA的迁移条带。谢海伟等[8]的研究表明,抗菌肽在较低质量浓度时结合到DNA表面,起到阻滞DNA迁移率的作用;高质量浓度的抗菌肽通过静电作用力结合到DNA双螺旋表面,竞争并阻碍EB和DNA的结合,从而在凝胶电泳中未发现电泳条带。另外也有研究表明,DNA是最重要的遗传物质之一,DNA的损伤会影响基因的表达,导致酶和受体蛋白质等合成受阻,最终导致细胞死亡[36]。由此可知,BCp12使菌体DNA在迁移过程中发生拖尾和偏移,影响DNA的正常复制,进而起到抑制菌体生长繁殖的作用。

图9 BCp12与菌体DNA结合的凝胶阻滞分析Fig. 9 Gel retardation analysis of BCp12 binding to bacterial DNA
2.3.2 荧光光谱实验分析BCp12与菌体DNA的作用方式
如图10所示,BCp12促进DNA-EB复合物的荧光强度降低,且BCp12的质量浓度越高,其下降趋势越明显。与对照组相比,添加BCp12的菌液荧光强度明显降低。研究表明,EB为灵敏度高、选择性好的荧光探针,其本身的荧光很弱,能够与双链DNA以两种方式结合[37]。EB可以通过静电作用与双链DNA的磷酸骨架结合,此时其荧光性质不变;但当它以较高亲和力嵌入DNA的双链内部的碱基对之间后使荧光强度大幅度增强,此外,当它与能产生相似作用的分子共存时,便相互竞争与DNA的结合,使EB-DNA复合体系的荧光发生变化[38]。刘莎[39]和Li Lirong[40]等也得到了相似的结论,抗菌肽能够与EB相互竞争结合位点,并以嵌入方式结合DNA。由此可知,BCp12也是以嵌插的方式与EB竞争性地结合DNA,致使DNA-EB复合物的荧光强度明显下降,进而影响DNA的正常复制,使菌体的生长繁殖受到抑制。

图10 BCp12与EB竞争性结合菌体DNA的荧光光谱Fig. 10 Fluorescence spectra showing competitive binding of BCp12 and EB to bacterial DNA
3 结 论
BCp12通过降低大肠杆菌壁膜的表面疏水性,对菌体壁膜脂肪酸、蛋白、多肽酰胺、多糖及指纹信息区都有明显影响,致使菌体壁膜损伤,从而引起胞内紫外吸收物质渗漏,菌体呈现自溶及空化现象,且以嵌插方式与DNA结合,产生凝胶阻滞现象,影响DNA正常复制,从而起到抑制菌体增殖的作用。
