Cu2+掺杂MnO2作为水系锌离子电池正极材料的合成与电化学性能
2021-10-31张璐璐谭伯川李文坡
张璐璐,谭伯川,李文坡
(重庆大学化学化工学院,重庆 401331)
引 言
人类生产生活的需求使得能源的需求不断增加,而石油、煤炭等传统燃料的燃烧对环境不够友好[1-2]。近几年来,风能、太阳能、水能等可再生能源的发电量快速增长,进而对能源的储存提出了新的要求[3-6]。锂离子电池虽有比容量高的优点,但锂资源稀缺,且锂电池制作条件较为严苛,导致了其价格昂贵[7-10]。锌离子电池的理论容量大(820 mAh/g),相对较小的离子半径也有利于充放电过程中锌离子在正极材料中的嵌入脱出[11-12],而且锌原料价格低廉[13]。锌离子电池作为具有发展前景的储能方法渐入人们视野,成为研究的热点[14-15]。
目前,文献报道的锌离子电池正极材料主要有三类:锰基材料、钒基材料和普鲁士蓝类似物。普鲁士蓝类似物因其成本低、结构稳定、制备简单和开放的骨架结构等优点在电化学储能领域得到了广泛的应用,但存在容量低的问题。钒基材料因其具有较高的比容量成为另一种潜在的正极材料,但因其易溶解导致循环稳定性差的问题不容忽视[13]。值得注意的是,二氧化锰材料具有多种晶型,已有研究发现,当使用其中某些晶型的二氧化锰作为锌离子电池的正极材料时,表现出了良好的电化学性能[16-22]。但锰基材料也存在一定的缺陷,比如,在充放电时其结构易崩塌且材料的导电性较差,限制了电池的容量[23]。为了改进其性能,研究者们进行了多方面的探索,多项研究证明金属离子的掺杂具有较好的性能提升效果[24-26]。例如,Liu等[23]通过水热和退火方法得到了K+掺杂的α-MnO2,证明了K+的掺杂可以作为材料的层间柱,有效防止材料的坍塌;Sun等[27]通过水热法制备了Ca2+掺杂的δ-MnO2,发现Ca2+的掺杂降低了Zn2+的界面转移电阻,同时也稳定了材料结构。
本研究采用简单的一步电沉积方法制备了具有蓬松多孔的纳米结构的Cu2+掺杂δ-MnO2。将掺杂前后的两种材料进行了电化学性能及形貌表征等多方面的对比,探究了Cu2+的掺杂对于材料起到的作用和内在的机理。有望在提高锰基锌离子电池材料的性能方面给以新的启发,推动此类材料的实际应用。
1 实验方法和表征
1.1 Cu2+掺杂MnO2的合成
试剂为分析纯的MnCl2·4H2O(成都市科龙化工试剂厂)、NaCl(重庆川东有限公司)、ZnSO4·7H2O、MnSO4·H2O、CuCl2·2H2O(成 都市科隆化学品有限公司)。
样品采用循环伏安电沉积法获得,制备时采用三电极体系,碳布为工作电极基底[用10%(质量)的硫酸和10%(质量)的硝酸混合液超声2 h,其次用65%(质量)硝酸在80℃下水热6 h,用超纯水和无水乙醇超声清洗,碳布约为1.8 mg/cm2],饱和甘汞电极为参比电极,铂片为对电极。纯MnO2样品制备所使用的电解液为0.12 mol/L MnCl2和0.06 mol/L NaCl,Cu掺杂的MnO2样品制备所用电解液为0.12 mol/L MnCl2、0.06 mol/L NaCl和0.06 mol/L CuCl2,在电位范围为0.7~1.3 V,扫描速度为10 mV/s,段数为10段的电沉积条件下制得。根据沉积前后碳布的质量差可以计算得知样品约为1.0 mg/cm2。将制备好的电极材料用超纯水冲洗后于真空干燥箱中进行干燥。图1为二氧化锰的制备过程示意图(Cu0.12MnO2中化学计量为后文测试所得,为非化学计量比化合物)。
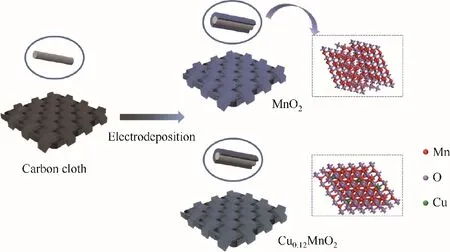
图1 二氧化锰制备过程示意图Fig.1 Schematic diagram of the preparation process of manganese dioxide
1.2 结构表征
用X射线衍射仪(XRD,PANalytical X Pert Poeder)分析晶体学信息,扫描范围为5°~90°,通过场发射扫描电镜(SEM,Quattro S)分析样品的基本形貌,通过透射电镜(TEM,Talos F200S)获得微观结构信息。X射线光电子能谱仪(XPS,ESCALAB250Xi)用于定性分析材料的化学元素。电感耦合等离子体(ICP,iCAP 6300 Duo)用于分析掺杂样品的掺杂量。全自动多站比表面和孔径分析仪(BET,max-Ⅱ)用于分析样品的比表面积和孔径。
1.3 电化学测试
电化学测试时将其制成型号为2032的纽扣电池。正极为上述所制备材料,负极为锌片,隔膜为中速滤纸2片,电解质为2 mol/L ZnSO4·7H2O和0.2 mol/L MnSO4混合液。采用CHI 760E电化学工作站测试阻抗(EIS)、循环伏安(CV)曲线和恒流充放电(GCD)曲线。EIS测试时采用的频率范围为0.01 Hz~105Hz。测试循环性能和恒电流间歇滴定技术(GITT)时置于蓝电系统(型号为CT2001A)进行。循环测试采用恒电流充放电,电流密度为500 mA/g,电压范围为0.8~1.7 V。GITT测试采用的电流密度为300 mA/g,脉冲时间为10 min,弛豫时间为30 min,电压范围为0.8~1.7 V。
2 实验结果与讨论
2.1 物相分析
图2为掺杂前后两种材料的XRD谱图。从图中可以看出,通过简单的电沉积法得到ε-MnO2,其结晶度较低。掺杂后的样品与ε-MnO2谱图几乎没有差别,但有轻微的向低角度方向偏移的倾向,这是由于Cu2+的嵌入增大了MnO2隧道间距[28-33],将有利于Zn2+的嵌入和脱出。
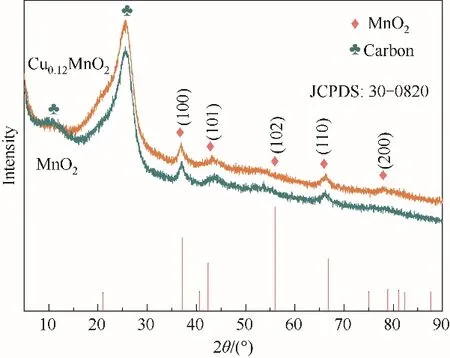
图2 掺杂前后物相XRD谱图Fig.2 XRD patterns of MnO2 and Cu0.12MnO2
2.2 形貌和元素分布分析
图3显示了掺杂前后样品形貌和元素分布。SEM图[图3(a)、(b)]表明MnO2样品为纳米片结构且形貌均一,图3(c)TEM图显示MnO2结构蓬松多孔,充分提高了活性物质的表面积,有利于增大其比容量。而掺杂Cu2+后,从图3(d)~(f)可以看出材料的形貌没有改变,保持了良好的纳米结构。图3(g)为掺杂样品的电子衍射图,可以看出样品的结晶度很低,这与图2是对应的。图3(h)为掺杂样品的元素分布图,从图中可以看出Mn、O和Cu在材料上分布均匀,这也说明了Cu成功掺杂进材料结构中。图4为掺Cu2+样品的BET测试图,测试得知样品的比表面积为131.9 m2/g,孔径平均值在5.6 nm左右(插图)。微孔负责电荷的储存和离子的吸附,介孔是离子从电极和电解质界面传递的通道[34],从而得知样品具有较好的储存和离子传输能力。

图3 MnO2和Cu0.12MnO2的形貌和元素分布Fig.3 Morphology and element distribution of MnO2 and Cu0.12MnO2

图4 Cu0.12MnO2样品N2物理吸附等温线和等效孔径分布(插图)Fig.4 N2 physisorption isotherms and equivalent pore size distribution(inset)of the Cu0.12MnO2
图5为掺Cu2+样品的掺杂量分析。图5(a)、(b)为样 品 中Mn和Cu的ICP图,由Mn和Cu的浓 度 比(3.691∶0.507)计算,可知材料中相应元素比为1∶0.12,从EDS图[图5(c)]中可以得出Mn和Cu的原子数比为1∶0.10,这与ICP得到的比例相近,故而本文中根据ICP结果,将掺Cu2+后的样品记为Cu0.12MnO2。

图5 Cu0.12MnO2样品中Mn(a)和Cu(b)的ICP图;Cu0.12MnO2的EDS图(c)Fig.5 ICP maps of Mn(a)and Cu(b)of Cu0.12MnO2 samples;EDS diagram of Cu0.12MnO2(c)
2.3 电化学性能对比
图6(a)为纯MnO2和Cu0.12MnO2样品的CV图对比,从图中可以看出掺Cu2+后CV图的峰面积增大,表明其具有较好的氧化还原活性和活性物质利用率。其中电位1.32 V和1.7 V左右分别为H+的嵌入和脱出电位;1.2 V和1.63 V左右为Zn2+的嵌入和脱出电位[35-36]。图6(b)为二者的比容量对比,可以看出纯的MnO2的比容量为159 mAh/g,掺Cu2+后的材料比容量为235 mAh/g,提高了47.8%,而其充放电平台与图6(a)的离子嵌入脱出电位是相对应的。图6(c)为MnO2和Cu0.12MnO2在不同的电流密度下的比容量对比,Cu0.12MnO2的比容量在各种电流密度下一直大于MnO2,显示了掺杂对于材料的优势。图6(d)为二者的阻抗对比图,在进行拟合后可以看出,掺Cu2+后溶液的溶液电阻和电荷转移电阻都减小了,进一步说明Cu2+的掺杂扩大了离子运动的隧道间距,减小了离子传输阻力,从而增大锌离子的扩散速度[15]。

图6 MnO2和Cu0.12MnO2材料的CV曲线(a);200 mA/g下GCD曲线(b);不同电流密度下GCD曲线(c);EIS曲线对比(d)Fig.6 CV curves(a),GCD curves at 200 mA/g(b),GCD curves at different current densities(c)and EIS curves(d)of MnO2 and Cu0.12MnO2
2.4 Cu0.12MnO2扩散动力学分析
图7(a)为Cu0.12MnO2在不同扫速下的CV图,反映了电极的电化学动力学特征。根据式(1):

其中,i为峰电流,mA;v为扫描速率,mV/s;a和b为参数。b值反映了电荷储存机制,当b=1时,表示此反应倾向于表面控制过程;b=0.5时,此反应倾向于扩散控制过程。从图7(b)中可以看出此反应的b值更接近于0.5,故而可以说明,Cu0.12MnO2材料作为锌离子电池正极时,更倾向于扩散控制,这也与典型的电池充放电行为更为一致。
图7(c)和(e)分别为Cu0.12MnO2和MnO2样品的GITT图。根据式(2):
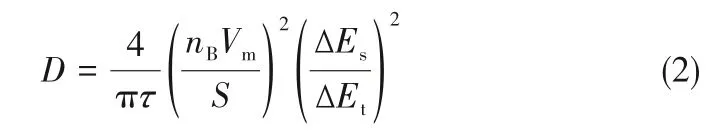
其中,τ为电池静置时间,即弛豫时间;nB是活性物质的量;Vm为电极体积;S为活性物质的面积;ΔEs为弛豫过程电压的变化;ΔEt为脉冲过程电压的变化。
图7(d)和(f)分别为Cu0.12MnO2和MnO2样品的扩散系数分析图,对比可以看出,Cu0.12MnO2材料相比于纯MnO2在放电时具有更大的扩散系数,具体数值在6.31×10-10~2.70×10-15cm2/s,表明其具有较快的离子扩散动力学[10,27,37]。
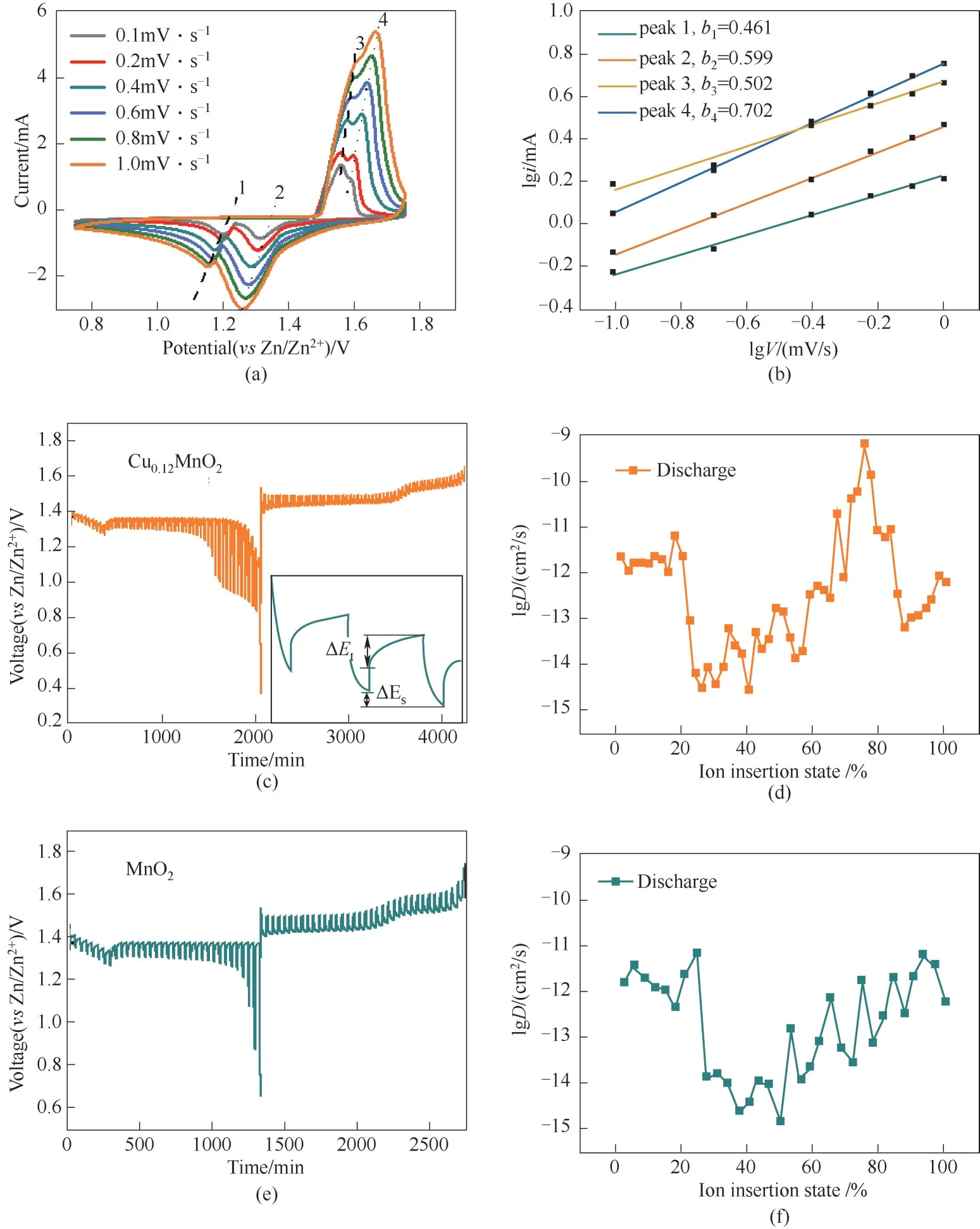
图7 Cu0.12MnO2不同扫速下的CV图(a),电化学动力学分析图(b),GITT(c)及扩散系数分析图(d);MnO2的GITT(e)及扩散系数分析图(f)Fig.7 CV diagram at different sweep speeds(a),electrochemical kinetic analysis diagram(b)and GITT(c)and diffusion coefficient analysis(d)of Cu0.12MnO2;GITT(e)and diffusion coefficient analysis(f)of MnO2
2.5 XPS分析
图8(a)为Cu0.12MnO2中Cu的XPS图,对应于一个2p3/2和一个2p1/2峰,说明Cu存在于材料中。图8(b)为掺杂前后两种样品的Mn的分析,可以看出在掺Cu2+后,Mn的两个峰的分离能由11.6 eV增大到了11.8 eV。较高的键能分离表明晶格中形成了一些三价锰,它们是为了补偿Cu2+在晶格中带来的额外正电荷而形成的[28]。图8(c)为充/放电完成后的Mn的价态分析,可以看出在放电完成后,Mn的+3价比+4价更多。简单来说,这是由于在放电时Zn2+嵌入到正极材料中,为平衡电荷,Mn的价态由+4价降为+3价,而充电时与此相反。图8(d)是Zn的XPS图,从峰强度可以看出,放电时材料中的Zn含量更多,这与图8(c)的结论是相对应的。以上结论说明了充放电伴随着Zn2+的嵌入和脱出过程。

图8 Cu0.12MnO2中Cu的XPS谱图(a);掺杂前后Mn的XPS谱图(b);充电和放电状态下Mn(c)和Zn(d)的XPS谱图Fig.8 XPS of Cu in Cu0.12MnO2(a);XPS of Mn before and after doping(b);XPS of Mn(c)and Zn(d)under charging and discharging conditions respectively
2.6 电池性能
图9进一步表征了纽扣电池的性能。图9(a)为电池的循环性能图。虽然二者的循环性能都有待改善,但可以看出,随着循环次数的增加,掺杂Cu2+的电池比容量下降得更慢。在不同的功率密度下测得Cu0.12MnO2材料的相应能量密度,得到掺杂材料所制得的电池的能量密度和功率密度与文献报道的同类型电池的数据[3,16,35,38-39]的对比[图9(b)],可以看出,掺杂的材料在不同的功率密度下都具有较好的能量密度。为了进一步证明此电池材料的实用性,进行了点灯实验,并将掺杂前后的二者进行了对比,将两个纽扣电池串联后,两种材料的电池均可点亮所用LED灯(3 V,5 W),但灯亮时长有一定的差别。图9(c)为MnO2材料的点灯图,灯亮时长为20 min,而Cu0.12MnO2材料的灯点亮时长为40 min[图9(d)]。图10为电池循环100圈后Cu0.12MnO2的SEM图。从图中可以看出,循环后的样品形貌仍为纳米片形状,测EDS后可以看出仍含有Cu元素,表明Cu的掺杂不会随着样品的循环而流失掉。
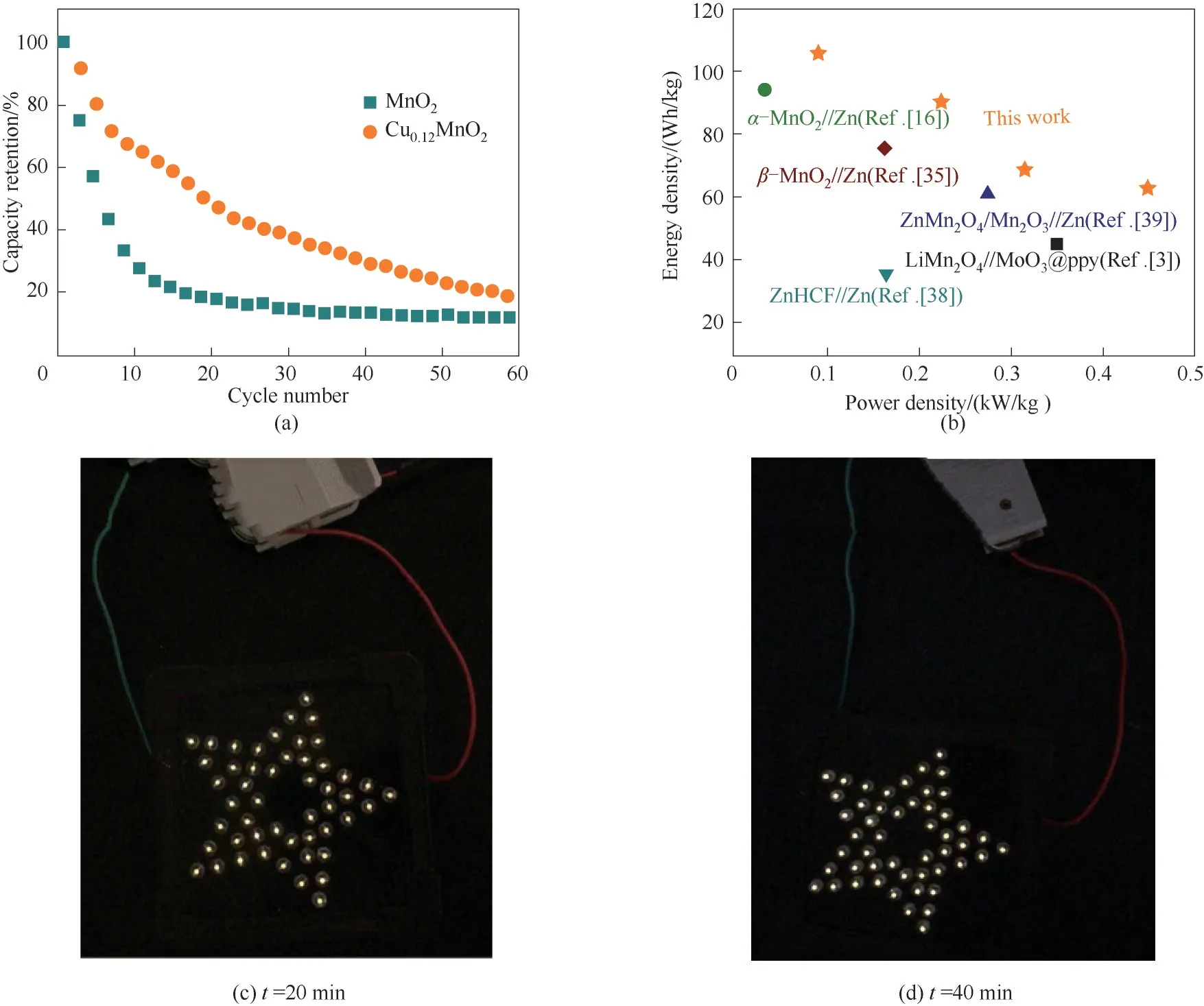
图9 MnO2和Cu0.12MnO2的循环对比图(a);Ragone图(b);MnO2(c)和Cu0.12MnO2(d)点灯应用图Fig.9 Cyclic comparison of MnO2 and Cu0.12MnO2(a);Ragone plot of the Zn//Cu2+doped MnO2 aqueous battery(b);MnO2(c)and Cu0.12MnO2(d)lighting application diagram
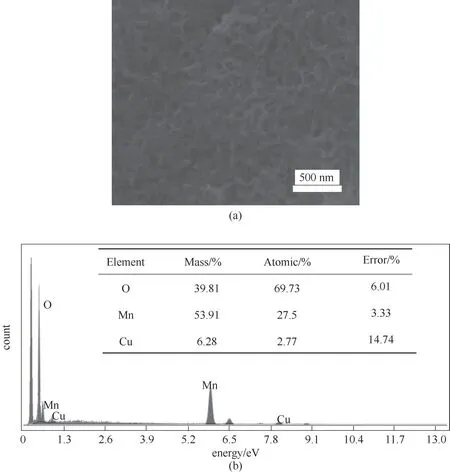
图10 循环100圈后的Cu0.12MnO2的SEM图(a)和EDS图(b)Fig.10 SEM image(a)and EDS spera(b)of Cu0.12MnO2sample after 100 cycles
3 结 论
(1)通过简单的电沉积方法得到了MnO2和Cu0.12MnO2,经过表征可以证明MnO2具有纳米级别的蓬松多孔结构,而一步Cu2+掺杂得到的材料依然保持其原本的良好结构。
(2)将掺杂前后的两种材料作为正极,分别封装成锌离子纽扣电池进行测试,结果证明掺杂后的材料电化学性能得到了显著提高,比容量提高了47.8%。
(3)本实验所制备Cu0.12MnO2材料的比容量、能量密度和功率密度较其他研究相比具有较好的表现。
