基于U-Net 的直肠癌肿瘤靶区和危及器官的自动分割模型
2021-10-21戴薇李华玲王沛沛唐媛媛孙新臣李金凯通信作者
戴薇,李华玲,王沛沛,唐媛媛,孙新臣,李金凯(通信作者)
1 南京医科大学第一附属医院放疗科 (江苏南京 210009);2 南京医科大学特种医学系(江苏南京 210009)
据统计,2015年我国结直肠癌发病率在所有恶性肿瘤中位于第三位,病死率位于第五位[1]。目前,放射治疗是治疗直肠癌患者的重要手段之一,对于可手术切除的Ⅱ、Ⅲ期直肠癌,可以通过术前放射治疗来降低其局部复发的概率;术前同步放、化疗是局部晚期不可切除直肠癌的首选治疗方案[2]。放射治疗的目标是在提高肿瘤靶区(gross target volume,GTV)剂量的同时尽量降低周围正常组织的受照剂量。因此,GTV 和危及器官(organs at risk,OARs)的准确勾画是精准放射治疗量的重要保证。GTV 和OARs 通常由放射治疗医师根据定位CT 图像进行手动勾画,勾画过程耗时费力,且勾画结果依赖于医师所掌握的肿瘤学及解剖学相关知识,因而主观性较强,一致性较差。近年来,有多种自动分割方法应用于GTV 和OARs 的勾画中,其中包括基于图谱库的自动分割方法[3-4]和基于神经网络的自动分割方法[5-7]。
基于图谱的自动分割方法是在建立参考图谱库后,通过形变配准对目标图像进行勾画,其缺点是建立图谱库耗时较长,且难以处理个体之间的解剖学差异[8]。目前,临床应用最多的是基于U-Net 的自动分割方法,该方法属于卷积神经网络的一种,其可对较少的数据进行训练,具备准确性较高且分割速度快的优点[9]。本研究拟通过利用基于U-Net 的自动分割模型对直肠癌GTV 和OARs 进行勾画,并评估该模型的勾画准确性及临床可行性,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2018年1月至2020年10月于医院接受术前放射治疗的70例直肠癌患者的临床资料,随机分组,其中52例作为训练集,6例作为验证集,12例作为测试集。所有患者在CT 扫描前1 h 排空大、小便,饮800 ml 水后等待40 min 进行扫描;使用西门子Siemens Sensation Open CT 模拟定位系统进行图像采集,患者体位包括仰卧位和俯卧位,体位固定方式为热塑膜;扫描层厚及层间距均为5 mm,CT 图像重建采用的矩阵大小为512×512;采集的CT 图像通过DICOM 传至医师工作站,由同一位放射治疗医师参考磁共振图像在CT 图像上勾画GTV 和OARs(包括左侧股骨头、右侧股骨头、膀胱),并由高年资医师进行二次确认。
1.2 模型训练
1.2.1 数据预处理
在建立模型之前对图像进行预处理:将所有的数据重新取样到(1.0,1.0,None)的体素,然后每次从单层数据中截取(320,320)大小的图像进入训练。
1.2.2 网络模型结构
本研究使用的网络模型为基于U-Net 的自动分割模型,该模型包含一个搜索路径及一个扩展路径。搜索路径是一个重复的结构,每次重复包含两个卷积层和一个池化层,卷积层的卷积核大小均为3×3,基础卷积核通道数为32,每个卷积层的后面都有批量标准化(batch normalization,BN)和线性整流函数ReLU 作为激活函数,两个卷积层后是一个2×2 Max pooling 层,用于降采样,每次降采样后特征通道数增倍;扩展路径也是一个重复的结构,首先包含一个 2×2 反卷积,用于上采样,每次上采样后特征通道数量减半,上采样后将结果与收缩路径中对应步骤的特征图进行拼接,拼接后的图像连接着两个3×3卷积层,卷积层后均有BN 和ReLU 激活函数,最后是一个1×1的卷积,其可将所有元素的特征向量映射至一个类标签。
1.2.3 训练流程
预处理后,从训练集中提取GTV 和OARs 结构图像并制作成标签图像;然后对原始图像进行增强及标准化后输入神经网络结构,见图1;最后采用Dice 损失函数对网络的预测结果和标签图像进行损失计算并反向传播,训练流程见图2。模型建立后,将验证集用于测试及评估模型的稳定性。本研究在MANTEIA 公司的Acculearning 软件中进行模型搭建。
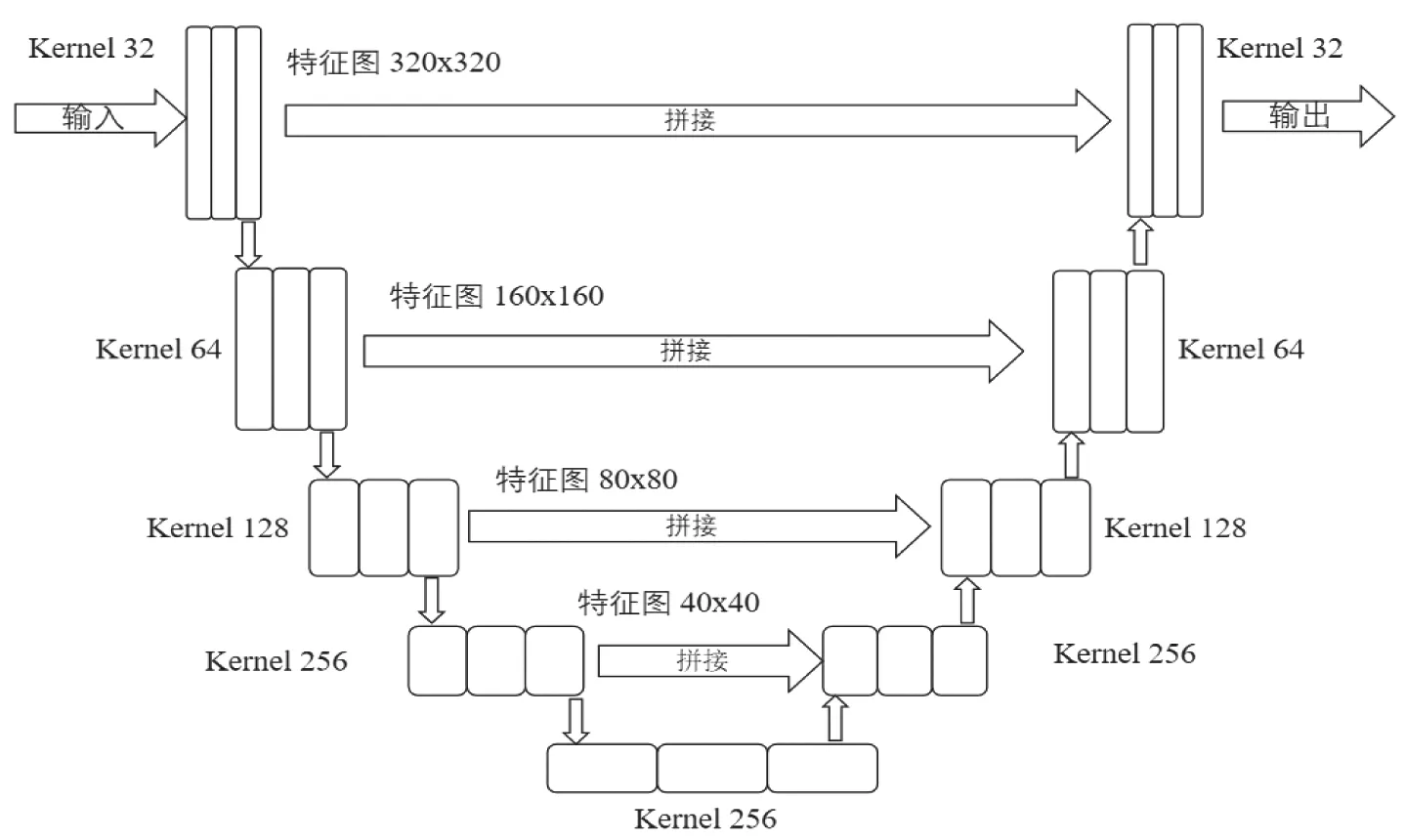
图1 网络模型结构
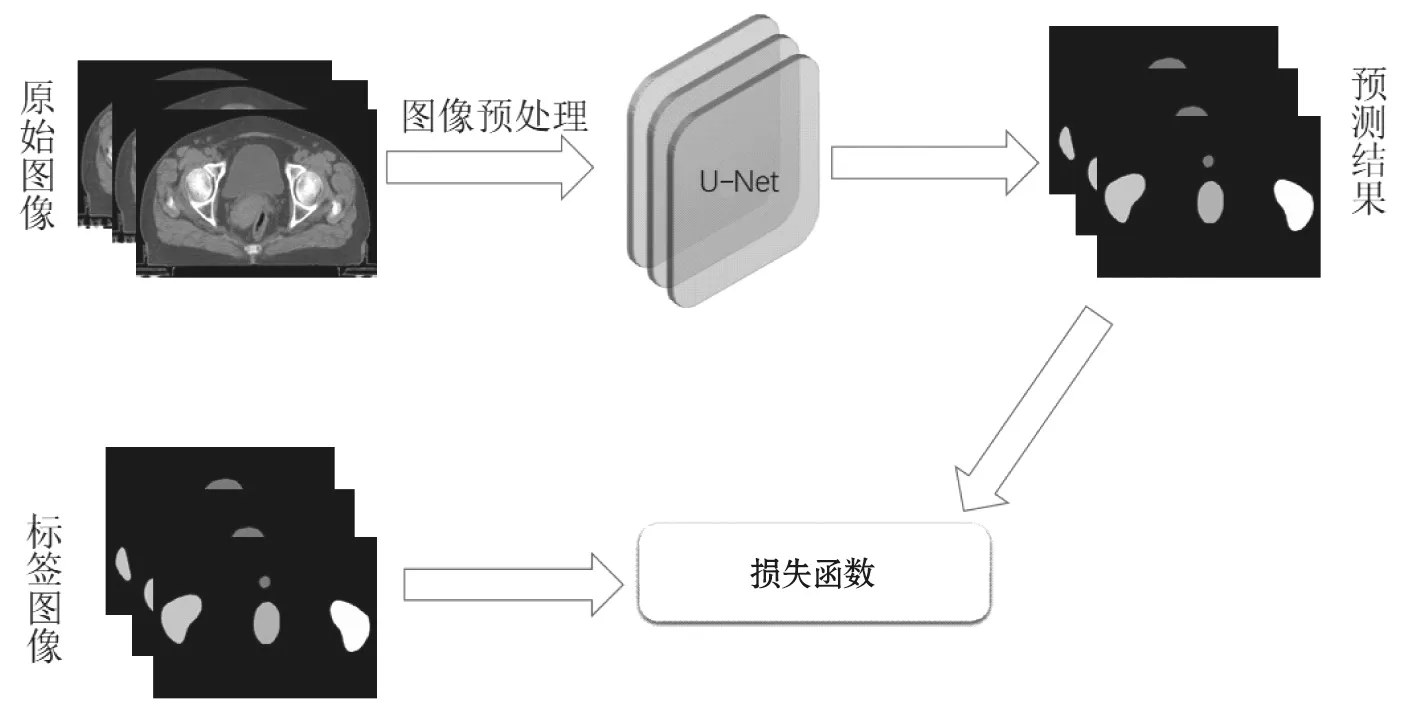
图2 训练流程
1.3 评价参数
采用戴斯相似系数(Dice similarity coefficient,DSC)及豪斯多夫距离(Hausdorff distance,HD)评估勾画结果的准确性。
DSC 用于评价自动勾画与手动勾画之间轮廓的重叠性[10],其计算公式为:
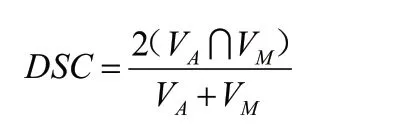
式中,VA代表自动勾画的体积,VM代表手动勾画的体积。DSC 值的大小为0~1,且越接近1表示相似度越高,即自动勾画的准确性越高。
HD 用于描述两组点集之间的相似程度,是两个点集之间距离的一种定义形式,若假设自动勾画集合A={a1,a2,…,ai},手动勾画的集合M={m1,m2,…,mj},则其公式可表示为:
H(A,M)=MAX[h(A,M),h(M,A)]
HD 值越小,表示自动勾画集合和手动勾画集合的交集越大,自动勾画的准确性越高。
1.4 模型的测试
将测试集的CT 图像输入训练好的自动分割模型中进行GTV 和OARs 的勾画,待勾画完成后将数据导入MIM Maestro 软件,在MIM Maestro 软件上计算两种方法的GTV 和OARs 的DSC 值、HD 值。
2 结果
表1为GTV 和OARs 的勾画准确性评估参数。图3为自动勾画与手动勾画的比较图,其中图3A 为GTV 勾画的比较图,图3B 为OARs 勾画的比较图。由表1和图3可知,自动分割模型在OARs 的勾画中具有较高的准确性,而在GTV 的识别上还有所欠缺,仍需要进一步提高。
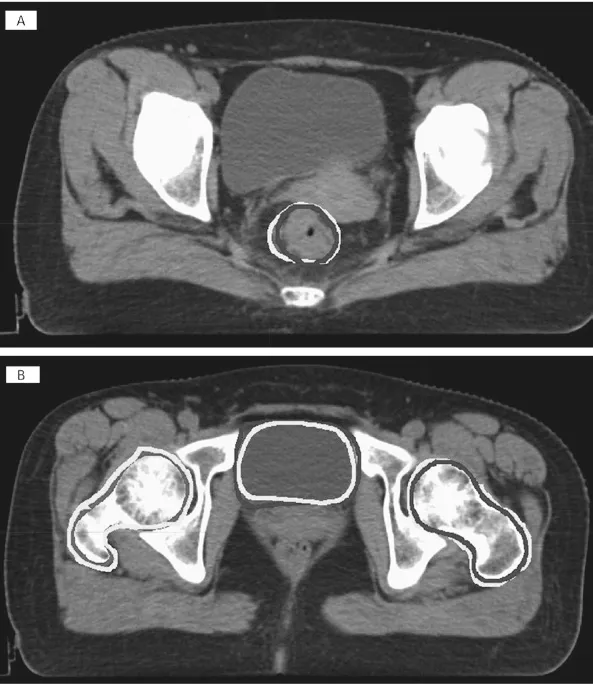
图3 自动勾画与手动勾画的比较图
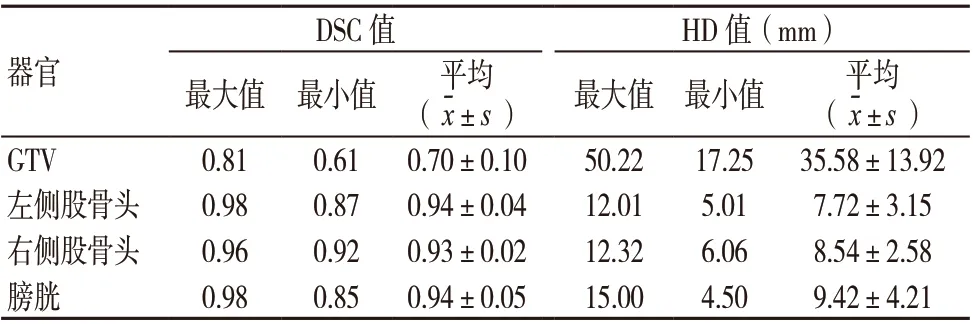
表1 勾画准确性评估参数
3 讨论
近年来,人工智能在各行各业得到了广泛的应用,其在肿瘤放射治疗中也扮演着重要的辅助角色,不仅可减轻放射治疗工作者的工作负担,并且可有效提高工作效率[11]。人工智能在放射治疗中应用较多的是GTV 和OARs 的自动勾画[12-16]、自动计划设计[17]等。目前,已有关于盆腔肿瘤GTV 和OARs 的自动勾画的研究。秦楠楠等[7]利用基于U-Net 的自动分割模型研究关于宫颈癌临床靶区(clinical target volume,CTV)和OARs 的自动分割,结果表明CTV 的平均DSC 值为(0.86±0.040),平均HD 值为(13.9±5.7)mm,膀胱及股骨头的DSC 值均>0.9,HD 值均不超过8.3 mm。Men 等[18]利用扩展卷积神经网络训练用于直肠癌CTV 和OARs 自动分割的模型,其中CTV 的平均DSC 值为0.877,膀胱的平均DSC 值为0.934,左侧股骨头的平均DSC 值为0.921,右侧股骨头的平均DSC 值为0.923。Song 等[19]研究对比了DeepLabv3+及ResUNet 两个模型对于直肠癌CTV 和OARs 的自动勾画效果,结果表明,在CTV 的勾画中,DeepLabv3+的勾画效果优于ResUNet(DSC值分别为0.88、0.87);在股骨头的分割中,ResUNet 的分割效果优于DeepLabv3+(DSC 值分别为0.93、0.90)。而本研究所训练的自动分割模型在OARs 分割中的准确性均不低于上述模型。
直肠癌病灶多为软组织结构,形态通常具有多样性及不确定性的特点,而CT 图像对软组织的分辨力较差,因此使用CT 图像对直肠癌的GTV 进行训练会影响最终的勾画效果;而使用磁共振图像作为训练对象则可提高勾画的准确性。目前,已有关于使用直肠癌磁共振图像来训练自动分割模型的相关研究[20-21]。Wang 等[21]使用磁共振T2加权图像对自动分割模型进行训练,其平均DSC 值为(0.74±0.14),平均HD 值为(20.44 ±13.35)mm,其分割准确性优于本研究。本研究的不足之处在于,所训练的自动分割模型对GTV 的始末层面识别准确性较差及训练的患者数较少,在后续的工作中将增加训练患者数并不断调整训练参数来提高GTV 勾画的准确性。
综上所述,本研究所训练的基于U-Net 的自动分割模型在直肠癌OARs 的勾画中具有较高的准确性,但在GTV勾画中的准确性还有待提高,可将该模型用于辅助临床工作,以提高放射治疗医师的工作效率。
致谢 MANTEIA 公司谢璐及张炜工程师给予的技术支持。
