LncRNA KIF9-AS1靶向miR-152-3p调控肺癌细胞的顺铂敏感性
2021-10-19王慧张佳文王健美张薇
王慧 张佳文 王健美 张薇
长期以来,以顺铂为基础的治疗一直是临床肺癌化疗的重要方案,然而由于顺铂内在或获得性耐药的限制,多数肺癌患者的化疗以失败告终[1]。因此,阐明肺癌顺铂耐药的分子机制、探索有效的逆转顺铂耐药的方法,对改善肺癌患者的预后意义重大。长链非编码RNA(lncRNA)被定义为长度>200个核苷酸的真核生物转录本,其通过染色质修饰、转录和转录后机制充当基因表达的关键调节剂,广泛参与癌细胞的增殖、侵袭、转移和耐药生理病理过程[2,3]。LncRNA驱动蛋白家族成员9反义RNA1(KIF9-AS1)位于染色体3p21.31位点,研究显示KIF9-AS1可增强细胞活力,抑制细胞凋亡,在肾细胞癌对索拉非尼的耐药性中发挥了积极作用[4]。然而,KIF9-AS1在肺癌顺铂耐药中的作用和潜在机制知之甚少。本研究通过检测肺癌顺铂耐药细胞(A549/DDP)中KIF9-AS1表达水平,探讨下调KIF9-AS1表达对A549/DDP细胞增殖、凋亡和顺铂耐药的影响,分析其下游潜在靶基因,以期为克服临床肺癌顺铂耐药提供有效靶点。
1 材料与方法
1.1 材料 人肺癌细胞A549、A549顺铂耐药细胞株(A549/DDP)购自上海北诺生物科技公司;RPMI-1640培养基、胎牛血清、青链霉素双抗购自武汉纯度生物科技有限公司;逆转录试剂盒、SYBR Green PCR Master Mix购自大连TAKARA生物科技公司;Lipofectamine 2000、TRIzol试剂购于上海科敏生物;miR-152-3p模拟物(miR-152-3p mimics)及其阴性对照、miR-152-3p抑制物(anti-miR-152-3p)及其阴性对照(anti-miR-NC)、KIF9-AS1小干扰RNA(si-KIF9-AS1)、无序阴性对照(si-NC)、KIF9-AS1过表达质粒(pcDNA-KIF9-AS1)及其阴性对照(pcDNA-NC)、双荧光素酶报告基因载体由上海吉凯基因提供;细胞计数试剂盒(CCK-8)、膜联蛋白V-异硫氰酸荧光素/碘化丙啶(Annexin-V-FITC/PI)试剂盒购于上海贝博生物公司;多药耐药相关蛋白1(MRP1)、细胞周期素D1(CyclinD1)和裂解的半胱氨酸蛋白酶3(Cleaved-caspase-3)兔源单克隆抗体购自上海艾博抗生物技术公司;
1.2 方法
1.2.1 细胞培养:A549/DDP、A549细胞均采用RPMI-1640培养基(补充10%胎牛血清、100 U/ml青霉素和100 mg/L链霉素)进行常规培养。培养A549/DDP细胞时加入5 μmol/L顺铂以维持其顺铂耐药性。
1.2.2 实时荧光定量PCR(RT-qPCR)检测KIF9-AS1和miR-152-3p表达:TRIzol法分别提取A549、A549/DDP细胞中总RNA。根据逆转录试剂盒将1 μg RNA反转录成cDNA。使用SYBR Green PCR Master Mix配置25 μl反应体系,在ABI 7500上进行实时RT-qPCR扩增。2-ΔΔCt公式计算KIF9-AS1和miR-152-3p的相对表达量。引物序列如下:KIF9-AS1上游引物5’-AGTC
CTTCCCATTCACAGGG-3’,下游引物5’-GCCCTCTTC
TT CCTCCACAT-3’;内参β-actin上游引物5’-TCACC
CACACTGTGCC CATCTACGA-3’,下游引物5’-CAGC
GGAACCGCTCATTGCCAATGG-3’;miR-152-3p上游引物5’-TCGGCAGG TCAGTGCATGACAGAA-3’,下游引物5’-CTCAACTGGTGTCGTGGA-3’;U6上游引物5’-GAGGGCCTATTTCCCATGATT-3’,下游引物5’-TAATTAGAATTAATTTGACT-3’。
1.2.3 细胞转染和实验分组:将对数期A549/DDP细胞接种6孔板,当细胞50%融合时利用Lipofectamine 2000将si-NC、si-KIF9-AS1、miR-NC、miR-152-3p mimics分别转染A549/DDP细胞,依次记为si-NC组、si-KIF9-AS1组、miR-NC组、miR-152-3p组。为证实KIF9-AS1是通过调控miR-152-3p表达进而影响肺癌细胞顺铂敏感性,将si-KIF9-AS1分别与anti-miR-NC、anti-miR-152-3p共转染A549/DDP细胞,依次记为anti-miR-NC+si-KIF9-AS1组、anti-miR-152-3p+si-KIF9-AS1组。6 h后,更换新鲜含血清培养液,继续培养48 h,胰酶消化收集细胞进行后续实验。
1.2.4 CCK-8法检测细胞活力:将A549/DDP细胞接种在96孔板,按照实验分组转染48 h后,将10 μl的CCK-8溶液添加到每个孔中,孵育2 h后,酶标仪测量450 nm处的光密度(OD)值。收获各转染组A549/DDP细胞并将其接种在96孔板,用不同浓度的顺铂(5、10、20、40、80 μmol/L)处理48 h。按照CCK-8使用说明使用检测OD450 nm值。根据OD值计算半数抑制浓度(IC50)。
1.2.5 流式细胞术检测细胞凋亡:收获各转染组A549/DDP细胞,结合缓冲液调整为1×106/ml的单细胞悬液。取100 μl细胞悬液,加入5 μl的Annexin-V-FITC和PI室温避光染色15 min。添加400 μl结合缓冲液后,流式细胞术分析细胞凋亡情况。
1.2.6 蛋白质印记(Western blot)检测CyclinD1、Cleaved-caspase-3和MRP1蛋白表达:采用含有蛋白酶抑制剂的RIPA缓冲液在冰上孵育各组细胞30 min,4℃离心机10 000 r/min离心15 min获得细胞总蛋白。二喹啉甲酸法测量蛋白浓度后,100℃煮3 min使细胞蛋白变性。聚丙烯酰胺凝胶电泳分离细胞蛋白后,湿法转膜仪转移至聚偏二氟乙烯膜。用5%脱脂奶粉封闭膜后,用CyclinD1、Cleaved-caspase-3和MRP1抗体4℃孵育膜12 h,随后用稀释的二抗室温下与膜反应2 h。显色后,Quantity One软件对目的条带灰度值进行量化分析。
1.2.7 双荧光素酶报告基因实验:将含有miR-152-3p结合位点的KIF9-AS1野生型(WT)序列或突变型(MUT)序列分别插入到pGL3载体构建双荧光素酶报告基因载体。利用LipofectamineTM2000试剂将WT-KIF9-AS1、MUT-KIF9-AS1与miR-152-3p mimics或miR-NC分别共转染A549/DDP细胞,共转染48 h后,荧光素酶测定系统检测荧光素酶活性。
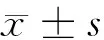
2 结果
2.1 在肺癌耐药细胞A549/DDP中KIF9-AS1、miR-152-3p、MRP1表达情况 与A549亲本细胞比较,耐药细胞A549/DDP中KIF9-AS1表达水平显著升高,miR-152-3p表达显著降低,MRP1蛋白表达显著升高(P<0.05)。见表1,图1。
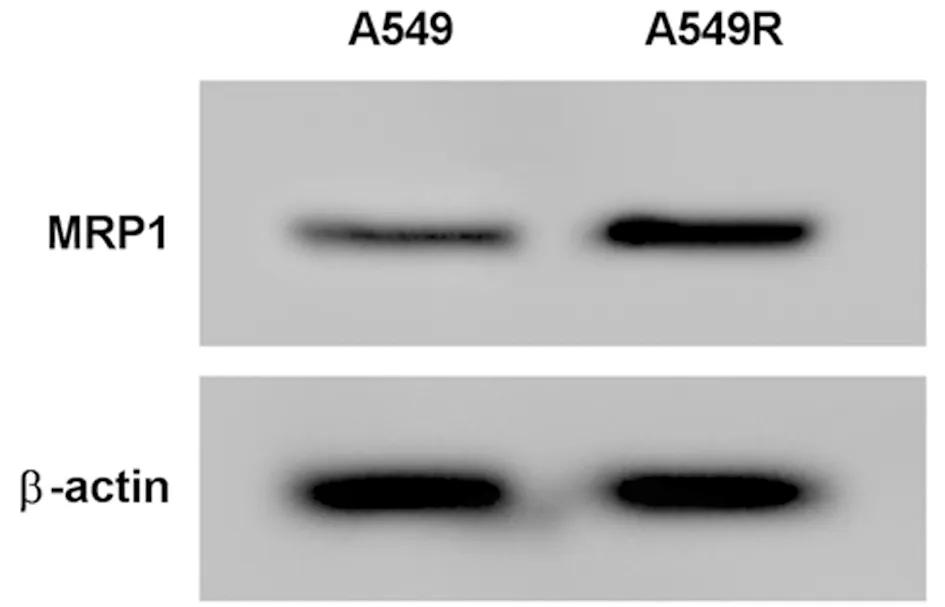
图1 Western Blot 检测MRP1蛋白的表达量

表1 在肺癌耐药细胞A549/DDP中KIF9-AS1、miR-152-3p、MRP1表达情况
2.2 下调KIF9-AS1表达抑制A549/DDP细胞增殖,促进凋亡,降低对顺铂的耐药性 与si-NC组比较,si-KIF9-AS1组A549/DDP细胞KIF9-AS1表达显著降低,细胞活力和CyclinD1蛋白表达显著降低,凋亡率和Cleaved-caspase-3蛋白表达显著升高,对顺铂的IC50、MRP1蛋白表达显著降低(P<0.05)。见表2,图2。

表2 下调KIF9-AS1表达对A549/DDP细胞增殖、凋亡和顺铂耐药性的影响

图2 下调KIF9-AS1表达对A549/DDP细胞增殖、凋亡和顺铂耐药性的影响;A 流式细胞仪检测细胞凋亡;B Western Blot检测CyclinD1、Cleaved-caspase-3和MRP1蛋白的表达
2.3 上调miR-152-3p表达抑制A549/DDP细胞增殖,促进凋亡,降低对顺铂的耐药性 与miR-NC组比较,miR-152-3p组A549/DDP细胞miR-152-3p表达显著升高,细胞活力和CyclinD1蛋白表达显著降低,凋亡率和Cleaved-caspase-3蛋白表达显著升高,对顺铂的IC50、MRP1蛋白表达显著降低,差异有统计学意义(P<0.05)。见表3,图3。
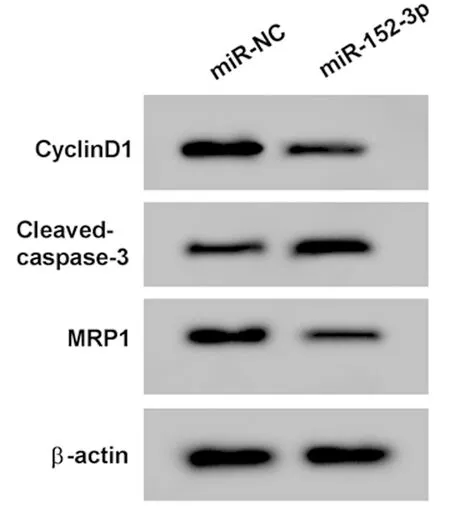
图3 Western Blot检测CyclinD1、Cleaved-caspase-3和MRP1蛋白的表达

表3 上调miR-152-3p表达对A549/DDP细胞增殖、凋亡和顺铂耐药性的影响
2.4 KIF9-AS1靶向调控miR-152-3p表达 Starbase在线预测显示见图4,KIF9-AS1与miR-152-3p之间存在结合位点。双荧光素酶活性检测显示,与miR-NC和WT-KIF9-AS1共转染比较,miR-152-3p和WT-KIF9-AS1共转染后A549/DDP细胞相对荧光素酶活性显著降低(P<0.05);与miR-NC和MUT-KIF9-AS1共转染比较,miR-152-3p和MUT-KIF9-AS1共转染后A549/DDP细胞相对荧光素酶活性无显著变化。RT-qPCR检测显示,pcDNA-KIF9-AS1组A549/DDP细胞miR-152-3p的表达水平较pcDNA-NC组显著降低(P<0.05);si-KIF9-AS1组A549/DDP细胞miR-152-3p的表达水平较si-NC组显著升高(P<0.05)。见表4、5,图4。

表4 miR-NC或miR-152-3p与报告质粒共转染A549/DDP细胞后双荧光素酶活性检测

表5 RT-qPCR检测miR-152-3p的表达

图4 通过starbase对miR-152-3p和KIF9-AS1结合区域进行预测
2.5 下调miR-152-3p表达可逆转KIF9-AS1下调对A549/DDP细胞增殖、凋亡和顺铂耐药性的影响 与anti-miR-NC+si-KIF9-AS1组比较,anti-miR-152-3p+si-KIF9-AS1组A549/DDP细胞miR-152-3p表达显著降低,细胞活力和CyclinD1蛋白表达显著升高,凋亡率和Cleaved-caspase-3蛋白表达显著降低,对顺铂的IC50、MRP1蛋白表达显著升高(P<0.05)。见图5,表6。

表6 下调miR-152-3p表达可逆转KIF9-AS1下调对A549/DDP细胞增殖、凋亡和顺铂耐药性的影响
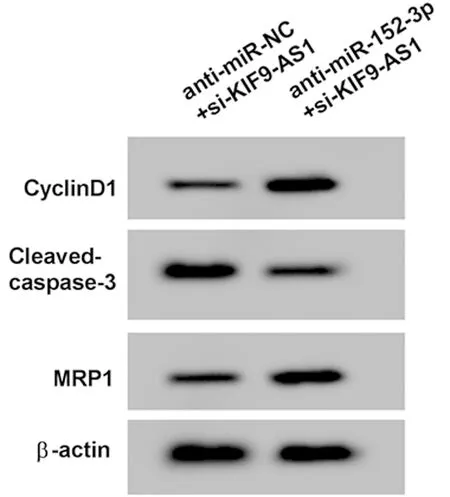
图5 Western Blot检测CyclinD1、Cleaved-caspase-3和MRP1蛋白的表达
3 讨论
肺癌仍然是最常见的人类恶性肿瘤,是全球范围内癌症死亡的首要原因[5]。顺铂化疗已是外科手术切除后肺癌的一线辅助治疗和晚期肺癌患者的重要治疗手段[6]。然而,随着肺癌的发展,癌细胞对顺铂的敏感性减弱导致顺铂耐药和化疗失败。近年来,多项研究表明LncRNA在肿瘤耐药中发挥重要作用。Ge等[7]研究发现LncRNA FOXD2反义RNA1(FOXD2-AS1)通过调控miR185-5p/同源盒蛋白1(SIX1)分子轴促进肺癌进展和顺铂耐药。Tian等[8]证实在顺铂耐药肺癌患者和小鼠A549/DDP异种移植瘤组织中LncRNA X染色体失活特异转录物(XIST)表达上调,下调XIST表达可降低细胞的存活率、增殖和迁移能力,诱导细胞凋亡,并抑制耐药蛋白表达。为探讨KIF9-AS1在肺癌顺铂耐药中的作用,本研究首先检测A549和A549/DDP细胞中KIF9-AS1表达,结果显示A549/DDP细胞中KIF9-AS1表达显著升高。通过转染si-KIF9-AS1下调KIF9-AS1表达可降低A549/DDP细胞活力和对顺铂的IC50值,提高细胞凋亡率,降低促增殖蛋白CyclinD1和耐药蛋白MRP1的表达水平,升高促凋亡蛋白Cleaved-caspase-3的表达水平。以上结果表明,KIF9-AS1可促进肺癌的顺铂耐药。
LncRNA充当miRNA海绵抑制miRNA活性进而参与肿瘤耐药的机制已被广泛报道。例如,LncRNA肺腺癌转移相关转录本1(MALAT1)通过吸附miR-200a促进肺癌细胞的增殖和吉非替尼耐药[9];LncRNA TTN反义RNA1(TTN-AS1)通过靶向miR-134-5p参与调节骨肉瘤细胞生长、凋亡和耐药性[10]。为探讨KIF9-AS1的可能作用机制,本研究通过Starbase在线分析发现miR-152-3p与KIF9-AS1之间存在相互作用。既往研究表明,miR-152-3p在肺癌、乳腺癌、胶质瘤等多种实体瘤中表达下调发挥抑癌基因作用,上调miR-152-3p表达可抑制肿瘤细胞的生长和转移[11-13]。此外,miR-152-3p低表达与卵巢癌、胶质瘤的顺铂耐药有关,上调miR-152-3p表达可提高其顺铂敏感性[14,15]。本研究发现A549/DDP细胞中miR-152-3p表达显著降低,提示miR-152-3p表达下调可能与肺癌顺铂耐药有关。通过转染miR-152-3p mimics上调miR-152-3p表达可降低A549/DDP细胞活力和对顺铂的IC50值,提高细胞凋亡率,降低CyclinD1和MRP1蛋白表达水平,升高Cleaved-caspase-3蛋白表达水平,与Zhang等[11]miR-152-3p在肺癌中发挥抑癌作用结论基本吻合。进一步研究显示,miR-152-3p是KIF9-AS1的靶基因,且KIF9-AS1对miR-152-3p具有负性调控作用。此外,下调miR-152-3p表达还可部分逆转下调KIF9-AS1对A549/DDP细胞活力、凋亡、顺铂耐药以及相关蛋白表达的影响,这进一步说明KIF9-AS1通过靶向miR-152-3p促进肺癌顺铂耐药形成。
综上所述,lncRNA KIF9-AS1在肺癌顺铂耐药中发挥促进作用,下调KIF9-AS1表达可抑制A549/DDP细胞增殖,促进细胞凋亡,增强其对顺铂的敏感性,其机制与靶向调控miR-152-3p表达有关。因此,lncRNA KIF9-AS1/miR-152-3p有望成为克服肺癌顺铂耐药的有效靶点。
