基于NF-κB/MAPK信号通路研究鱼藤素对过敏性哮喘大鼠的作用机制*
2021-10-14李慧邢学勇王一新杨爽赵丽郭俊华
李慧,邢学勇,王一新,杨爽,赵丽,郭俊华
1.新乡医学院第三附属医院,河南 新乡 453000;2.河南大学,河南 开封 475000
过敏性哮喘(allergic asthma,AA)是以高反应及气道炎症为主要特征,所有年龄段均可发病,严重影响人们的健康[1]。目前,激素类药物是治疗轻度AA的常用药物,短期内可改善气喘症状,但对重症及激素抵抗型AA疗效并不理想,且长期使用激素有一定的安全风险[2]。研究证实,慢性炎症反应是AA病理、生理改变的基础,可导致气道高反应性,引发疾病的反复发作,增加治疗的难度[3]。因此,抗炎药物逐渐成为AA的研究热点。研究发现,中药提取物鱼藤素可不同程度抑制多种肿瘤细胞的增殖、迁移,且具有较强的抗炎作用[4-5]。但关于鱼藤素对AA的抗炎作用及机制研究尚少。核转录因子-κB(nuclear factorκB,NF-κB)/p38丝裂原活化蛋白激酶(p38 motigen-activated protein kinase,MAPK)通路可介导炎症反应,在哮喘发生、发展中发挥重要作用。本研究基于NF-κB/MAPK通路研究鱼藤素对AA模型大鼠的影响。
1 材料
1.1 动物SPF级雄性Wistar健康大鼠46只,6~8周龄,体质量(200±20)g,购自郑州市惠济区华兴实验动物养殖场,许可证号:SCXK(豫)2019-0002,动物伦理批准号:XXYXY-2020-032。自由进水饮食,饲养环境温度维持(24±1)℃,相对湿度(55±5)%,12 h/12 h明暗交替下适应性饲养。
1.2 药物与试剂鱼藤素(纯度>98%,美国Sigma公司,批号:045M4736V)。卵清蛋白(ovalbumin,OVA)(美国Spectrum公司,货号:AL125);白细胞介素-1β(interleukin-1β,IL-1β)ELISA试剂盒(武汉菲恩生物科技有限公司,货号:EM0109);IL-13ELISA试剂盒(北京百奥莱博科技有限公司,货号:ARB12179);Trizol试剂(武汉纯度生物科技有限公司,货号:CD-13433-ML);BCA蛋白定量试剂盒(美国MedChemExpress公司,货号:HY-15908);兔抗鼠NF-κB p65、p-NF-κB p65、细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)、p-ERK、p38 MAPK、p-p38 MAPK抗体(美国Abcam公司,货号:ab207297、ab247871、ab32081、ab192591、ab218177、ab221013)。
1.3 仪器WBP型流量型整体体积描记箱、整体体积描记系统(美国Buxco公司);SM2010R型切片机、EG1150分体式包埋机、DM500光学显微镜(德国Leica公司);PE2400电泳仪、CheniDoc XRS全自动凝胶成像系统(美国Bio-Rad公司)。
2 方法
2.1 模型建立、分组及干预46只SPF级雄性Wistar大鼠,适应性喂养7 d后,随机选取8只为正常组,其余38只建立哮喘模型。造模开始第1~3天对大鼠采用腹腔注射OVA致敏液[10 mg OVA和100 mg Al(OH)3]1 mL,第8天注射1次,第15天开始行1%OVA溶液雾化激发,每次40 min,隔天1次,共6 d。大鼠出现烦躁不安、呼吸加快、抓耳、大小便失禁、紫绀等即为模型建立成功。正常组均以生理盐水代替致敏混悬液和雾化液,其他操作相同。将造模成功的32只大鼠随机分为模型组、鱼藤素低剂量组、鱼藤素中剂量组、鱼藤素高剂量组,每组8只。末次雾化6 h后用鱼藤素干预进行,鱼藤素低、中、高 剂 量 分 别 为1 mg·kg-1、2 mg·kg-1、4 mg·kg-1,正常组与模型组均给予同体积生理盐水腹腔注射,连续7 d。
2.2 大鼠肺功能的测定末次用药后2 h,将大鼠置入流量型整体体积描记箱,每箱1只大鼠,分批轮流测试。大鼠可于箱中自由活动,呼吸接近自然,使大鼠在箱中适应10 min,待其安静后采用整体体积描记系统记录大鼠呼吸时箱中的压力变化,将信号传输至系统,计算大鼠呼吸速率、吸气峰流量、呼气峰流量。
2.3 大鼠肺泡灌洗液(bronchoalveolarlavage fluid,BALF)中IL-1β、IL-13的测定 末次用药6 h后,颈椎脱臼处死大鼠,逐层分离颈部皮肤,暴露气管,取出肺,以手术线结扎右肺并将其固定;左肺经2 mL 37℃生理盐水灌洗3次,回收BALF后(回收率>80%),2 800 r·min-1离心15 min(离心半径为12 cm),收集BALF上清液,用ELISA试剂盒检测BALF中IL-1β、IL-13水平。
2.4 HE染色观察AA模型大鼠肺组织病理变化每组随机选择3只大鼠,取结扎未经灌洗的右肺,用40ng·L-1多聚甲醛溶液固定48 h,流水冲洗30 min后常规乙醇脱水,石蜡包埋,以病理切片机制作成连续切片,厚度为5μm,HE染色后用显微镜对肺组织病理变化进行观察。
2.5 W estern Blot法检测大鼠肺组织NF-κB p65、p-NF-κB p65、p38 MAPK、p-p38 MAPK、ERK、p-ERK蛋白表达每组随机选择3只大鼠,取60 mg结扎未经灌洗的右肺组织,充分研磨后转移至离心管,加入细胞裂解液于冰上裂解,12 000 g离心15 min后取上清,收集沉淀后经BCA蛋白定量试剂盒测定蛋白浓度。取50μg样品与等体积上样缓冲液充分混匀,恒定电压下电泳,转膜后加入封闭液,室温下摇床孵育2 h,加入稀释一抗(1∶1 000),4℃孵育过夜,TBTS漂洗3次,每次10 min,加入辣根过氧化物酶标记的二抗(1∶10 000),常温孵育2 h,TBTS漂洗3次,每次10 min,暗室中显影。采用全自动凝胶成像系统扫描,并分析灰度值。
2.6 统计学方法采用SPSS 25.0统计学软件分析数据,计量资料以均值±标准差(±s)表示,多样本计量资料以方差分析检验,以SNK-q检验分析两两样本。P<0.05为差异有统计学意义。
3 结果
3.1 大鼠的一般情况正常组大鼠毛色顺滑、有光泽,呼吸情况良好;模型组大鼠毛色暗淡、竖毛,烦躁不安、呼吸局促、前肢缩抬、站立不稳、大小便失禁、紫绀,腹式呼吸且节律无规则,行动迟缓,随激发次数的增加,上述症状逐步加重且频率增加;鱼藤素低、中、高剂量组出现不同程度类似模型组的症状,但程度均有所改善。
3.2 鱼藤素对大鼠肺功能的影响与正常组比较,模型组大鼠呼吸速率显著升高(P<0.05),吸气峰流量、呼气峰流量显著降低(P<0.05);与模型组比较,鱼藤素低、中、高剂量组大鼠呼吸速率显著降低(P<0.05),吸气峰流量、呼气峰流量显著升高(P<0.05)。见表1。
表1 各组大鼠肺功能参数比较 (±s)

表1 各组大鼠肺功能参数比较 (±s)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05
组别 n呼吸速率/次·min-1吸气峰流量/mL·s-1呼气峰流量/mL·s-1 8 165.34±17.06 120.56±13.02 214.06±22.37模型组 8 205.67±19.33* 77.53±8.04* 96.65±9.81*鱼藤素低剂量组8 194.80±20.17# 88.10±8.91# 108.72±11.16#鱼藤素中剂量组8 188.75±19.14# 97.33±9.87# 124.97±13.08#鱼藤素高剂量组8 172.35±18.92#108.21±11.43# 156.67±17.02正常组#
3.3 鱼藤素对大鼠BALF中IL-1β、IL-13水平的影响与正常组比较,模型组大鼠BALF中IL-1β、IL-13水平显著升高(P<0.05);与模型组比较,鱼藤素低、中、高剂量组大鼠BALF中IL-1β、IL-13水平显著降低(P<0.05)。见表2。
表2 各组大鼠BALF中IL-1β、IL-13水平比较 (±s,ng·L-1)

表2 各组大鼠BALF中IL-1β、IL-13水平比较 (±s,ng·L-1)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05
组别 n IL-1β IL-13正常组8 502.31±48.62 18.56±2.01模型组 8 6 539.37±754.76* 96.32±9.87*鱼藤素低剂量组 8 4 127.94±450.27# 70.26±7.69#鱼藤素中剂量组 8 2 926.83±302.48# 54.68±6.71#鱼藤素高剂量组 8 1 203.57±289.32# 40.97±4.20#
3.4 鱼藤素对大鼠肺组织病理变化的影响正常组大鼠肺泡组织结构较为完整,肺泡间隔正常,未观察到炎症浸润;模型组大鼠可明显观察到肺泡结构异常,肺泡间隔中有大量炎症浸润,肺泡壁变薄;鱼藤素低、中、高剂量组大鼠肺泡间隔中炎症浸润减轻,其中鱼藤素高剂量组减轻最为明显。见图1。
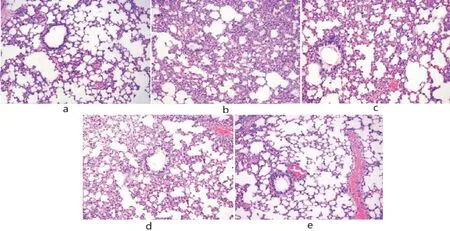
图1 大鼠肺组织病理变化(HE染色,×200)
3.5 鱼藤素对大鼠肺组织蛋白表达的影响与正常组比较,模型组大鼠肺组织p-NF-κB p65/NF-κB p65、p-p38 MAPK/p38 MAPK、p-ERK/ERK水平显著升高(P<0.05);与模型组比较,鱼藤素低、中、高剂量组大鼠肺组织p-NF-κB p65/NF-κB p65、p-p38 MAPK/p38 MAPK、p-ERK/ERK水平显著降低(P<0.05)。见表3、图2。
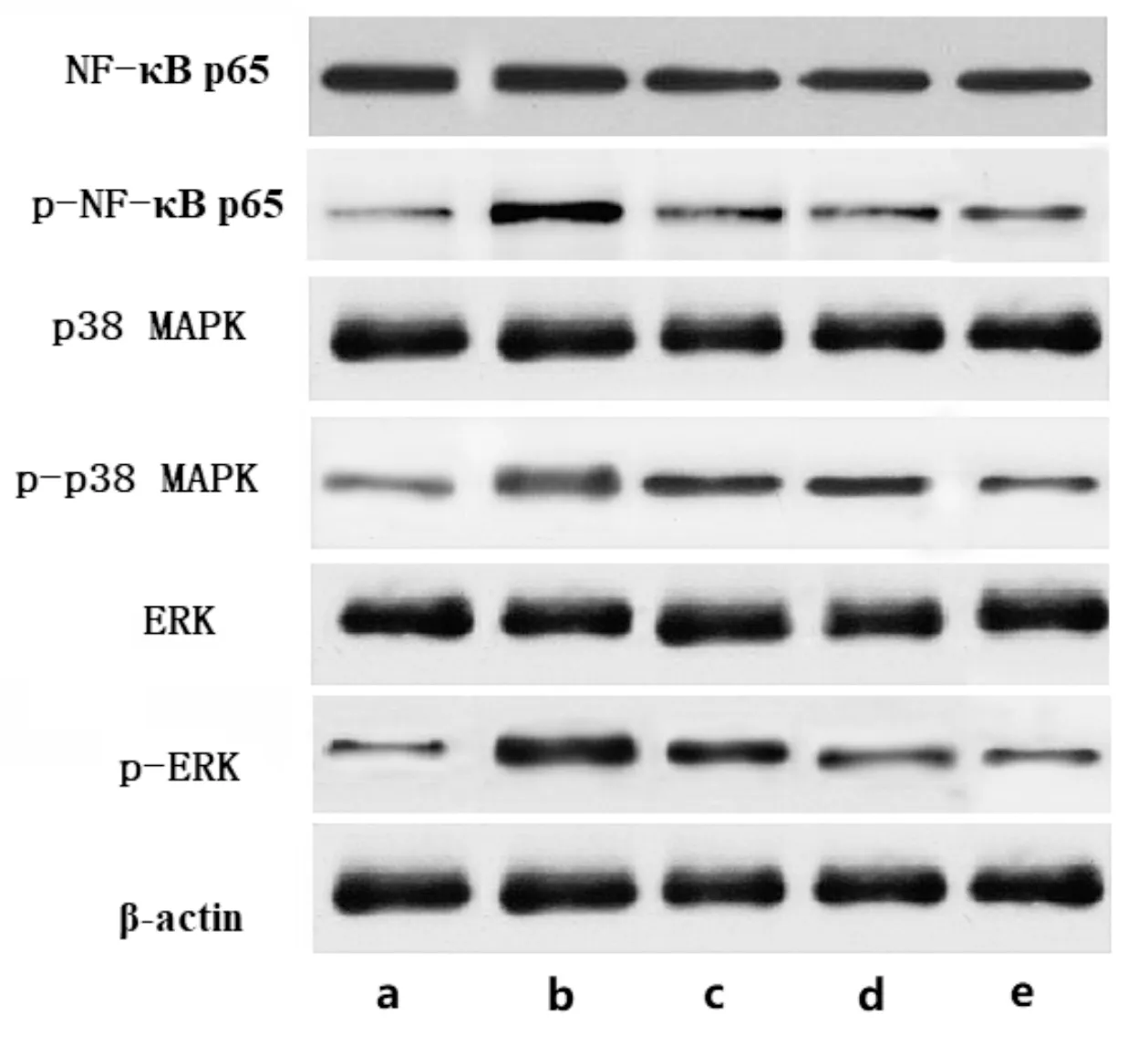
图2 大鼠肺组织相关蛋白免疫印迹图
表3 各组大鼠肺组织p-NF-κB p65/NF-κB p65、p-p38 M APK/p38 MAPK、p-ERK/ERK水平比较 (±s)

表3 各组大鼠肺组织p-NF-κB p65/NF-κB p65、p-p38 M APK/p38 MAPK、p-ERK/ERK水平比较 (±s)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05
组别 n p-NF-κB p65/NF-κBp65 p-p38MAPK/p38MAPK p-ERK/ERK 3 0.25±0.03 0.19±0.02 0.32±0.03模型组 3 0.73±0.08* 0.65±0.06* 0.79±0.08*鱼藤素低剂量组3 0.54±0.06# 0.58±0.05# 0.66±0.07#鱼藤素中剂量组3 0.49±0.05# 0.44±0.04# 0.42±0.05#鱼藤素高剂量组3 0.36±0.04# 0.31±0.03# 0.38±0.04正常组#
4 讨论
AA病因复杂,过敏性体质、空气污染、职业接触、家族遗传史等均为该病发生的危险因素[6-8]。临床研究认为,AA的发病机制与嗜酸性粒细胞气道浸润、淋巴细胞亚群失衡、肺泡巨噬细胞功能失常、细胞因子与免疫球蛋白水平异常升高等有关[9-10]。吸入性糖皮质激素是AA常用治疗药物,可有效控制部分患者急性症状,但长期用药可能导致骨代谢异常、生长抑制等不良反应[11-12]。故探寻有效抑制气道炎症反应的药物,是促进AA转归、改善预后的关键。
研究发现,NF-κB/MAPK信号通路被过度激活,在AA的发生、发展中具有重要作用[13-14]。正常生理状态下,NF-κB以非活性物质的形式存在于细胞质中,当机体应激状态下其抑制物IκB磷酸化后,对NF-κB的抑制作用消失,NF-κB被激活,磷酸化后的NF-κB可转至细胞核中促使基因转录,从而上调炎症因子水平,加剧炎症反应[15-16]。MAPK通路在炎症反应中同样扮演着重要角色,其中包括p38 MAPK、ERK介导的级联反应,该通路被激活后将促使炎症因子的分泌量增加,从而加剧炎症反应[17-19]。研究证实,与正常组大鼠比较,哮喘模型大鼠MAPK通路活性显著增强[20]。本研究结果显示,鱼藤素低、中、高剂量组p-NF-κB p65/NF-κB p65、p-p38 MAPK/p38 MAPK、p-ERK/ERK水平均低于模型组,且呈剂量依赖性。提示鱼藤素可能通过抑制NF-κB/MAPK信号通路发挥抗AA作用。
IL-1β来源于树突状细胞、中性粒细胞及巨噬细胞,可上调黏蛋白5ac表达,促使黏液分泌,导致气道重塑加剧[21-22]。IL-13为炎症因子级联反应中始动因子,与对应受体结合后,可导致肺泡间弹力纤维断裂,造成胸膜增厚、黏液增加,参与AA进程。本研究结果显示,正常组大鼠未观察到炎症细胞浸润,模型组大鼠肺泡结构异常,可观察到大量炎症细胞浸润,鱼藤素低、中、高剂量组上述变化均显著改善,其中高剂量组减轻最为明显,提示鱼藤素可减轻AA模型大鼠肺组织病理改变;鱼藤素低、中、高剂量组大鼠的呼吸速率及BALF中IL-1β、IL-13水平降低,吸气峰流量、呼气峰流量上升,提示鱼藤素可改善大鼠的肺功能,降低BALF中炎症因子水平,且呈剂量依赖性。鱼藤素是一种鱼藤酮类化合物,提取自鱼藤属、灰叶属植物,具有抗肿瘤、抑制血管生成的功效,且对周围正常细胞影响甚微,广泛应用于癌症、血管性疾病的治疗[23-25]。有报道显示,鱼藤素具有显著的抗炎作用,可通过抑制促炎因子释放等减轻炎症反应[26-28]。本研究采用鱼藤素干预AA模型大鼠后,BALF中IL-1β、IL-13水平显著降低,且可减轻肺组织病理变化,与张培[29]的研究结果基本一致,进一步证实鱼藤素在AA中的抗炎作用。
综上所述,鱼藤素可改善AA大鼠的肺功能,缓解气道炎症,减轻肺组织病理变化,作用机制可能与抑制NF-κB/MAPK信号通路有关。