Hsa-miR-98-5p/DKK3信号轴对乳腺癌细胞生物学行为的影响
2021-10-10李冠乔杨时平苏慧銮
姚 嘉,李冠乔,杨时平,苏慧銮
1.海南省人民医院乳腺外科,海南 海口 570311;
2.海南省人民医院放疗科,海南 海口 570311;
3.海南省人民医院肾内科,海南 海口 570311
乳腺癌是发生于女性的常见癌症,美国每年有25万多例新发病例和4万多例死亡病例[1-2]。目前,手术切除、化疗或放疗仍然是乳腺癌的主要治疗方法[3]。然而,这些治疗方法不能有效地抑制乳腺癌的转移,这被认为是乳腺癌患者死亡的主要原因[4-5]。此外,许多患者确诊时已为癌症晚期,这在很大程度上限制了这种疾病的治疗[6]。因此,了解乳腺癌进展的机制至关重要。最近,高通量测序技术和生物信息学分析方法已经确定了许多与癌症进展相关的异常表达蛋白编码基因和非编码基因[7-9]。
微小RNA(micro RNA,miRNA)是含有18~22个核苷酸的非编码小分子RNA,其可以通过靶向信使RNA(messenger RNA,mRNA)进行切割或抑制翻译进而导致其同源靶基因的沉默[10]。miRNA具有促癌或抑癌的作用。miRNA在正常组织和肿瘤组织中的表达谱非常不同,并且miRNA与特定的临床生物学特征相关[11]。miRNA表达谱分析已经用来揭示人类乳腺癌中特有的miRNA的特征。应用miRNA微阵列技术研究[12]发现,人miR-99a可抑制乳腺癌的进展,miR-99a在乳腺肿瘤组织中的表达与癌旁正常组织相比表达下调。
本研究计划从癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库中获取测序数据,进而构建乳腺癌中miRNA-mRNA调控网络。通过对miRNA靶点的分析,构建与乳腺癌进展相关的miRNA-Hub mRNA网络,最终进行相应的实验验证。
1 材料和方法
1.1 数据下载及差异miRNAs的筛选
从TCGA数据库下载乳腺癌相关miRNA测序数据,使用R语言中的DEM Limma包鉴定癌组织和正常组织间的差异miRNA。
1.2 差异miRNA靶基因的预测
miRDB数据库(http://mirdb.org/)是一个用于miRNA靶点预测和功能注释的在线数据库,其中的所有靶点都是由一个生物信息学工具miRTarget预测的。miRTarget是通过分析高通量测序实验中数千个miRNA靶点的相互作用而开发的。miRTarBase数据库(http://mirtarbase.cuhk.edu.cn/php/index.php)已经积累了36万多个miRNA-靶点相互关系,通常收集的miRNA-靶点相互关系通过报告基因分析、蛋白质印迹法(Western blot)、微阵列和测序实验进行验证。StarBase数据库(http://starbase.sysu.edu.cn/)是一个开源平台,可用于研究miRNA-mRNA相互作用,本研究使用这3个数据库查找差异miRNA对应的靶基因,并将3个数据库的靶基因取交集,将交集靶基因作为最终的研究对象。
1.3 靶基因的基因本体(Gene Ontology,GO)及京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)分析
GO数据库把基因的功能分成3个部分,分别是细胞组分(cellular component,CC)、分子功能(molecular function,MF)和生物学过程(biological process,BP)。利用GO数据库,可以得到目标基因在CC、MF和BP三个层面上主要与什么有关。KEGG数据库对基因的功能及其参与的信号转导通路进行注释。本研究使用R语言中的ClusterProfiler包对交集靶基因进行富集分析。
1.4 蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络分析及Hub基因的筛选
使用String(https://string-db)数据库进行PPI分析,之后将数据导入Cytoscape 3.6.2软件进行可视化构建网络图,并使用Cytoscape 3.6.2软件的CytohHubba插件筛选该网络图中的前10位基因,并绘制miRNA-Hub基因网络图。
1.5 实验材料和方法
1.5.1 实验材料
人乳腺上皮细胞系MCF-10A,以及人乳腺癌细胞系MCF-7、MDA-MB-231、MDAMB-453、SV40T转化的人胚肾细胞293T细胞均购自中国医学科学院基础医学研究所细胞资源中心,DMEM/F12培养基、DMEM高糖培养基培养、L15培养基均购自美国Gibco公司(货号:11320033、12800082、11415064),TRIzol试剂购自美国Thermo Fisher Scientific公司(货号15596026),PrimeScript RT Master Mix反转录试剂盒、SYBR染料法荧光定量试剂盒均购自日本TaKaRa公司(货号:RR036A、RR82LR),LipofectamineTM2000转染试剂购自美国Invitrogen公司(货号:11668-019),micrON hsa-miR-98-5p mimic(5 nmol)、micrOFFhsa-miR-98-5p inhibitor(5 nmol)均购自广州锐博生物技术有限公司(货号miR10000096-1-5、miR20000096-1-5),Annexin Ⅴ-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)/碘化丙啶(propidium iodide,PI)双染细胞凋亡检测试剂盒购自美国BioLegend公司(货号:640914),细胞计数试剂盒-8(cell counting kit-8,CCK-8)、结晶紫水溶液均购自北京索莱宝科技有限公司(货号:CA1210、G1064),吉姆萨染色液(Giemsa)购自上海创赛科技有限公司(货号:PM10631),pGL4.10质粒、pRL-SV40质粒、Dual-Glo Luciferase Assay System(货号E2920)均购自美国Promega公司。
1.5.2 细胞培养
将MCF-10A细胞培养于含1%非必需氨基酸、5%硫酸乙酰肝素、10 μg/mL胰岛素、20 ng/mL表皮生长因子、100 ng/mL霍乱毒素、0.5 μg/mL氢化可的松、100 U/mL青霉素和100 μg/mL链霉素的DMEM/F12培养基中。将HEK-293T、MCF7细胞培养于含10%胎牛血清(fetal bovine serum,FBS)、100 U/mL青霉素、100 μg/mL链霉素的DMEM高糖培养基中。将MDA-MB-231、MDA-MB-453细胞培养于含10%FBS、100 U/mL青霉素、100 μg/mL链霉素的L15培养基中。所有细胞均在37 ℃、CO2体积分数为5%的培养箱中培养。
1.5.3 实时荧光定量聚合酶链反应(realtime fluorescence quantitative polymerase chain reaction,RTFQ-PCR)检测hsa-miR-98-5p和DKK3的表达
采用T R I z o l 一步法提取总R N A,使用PrimeScript RT Master Mix反转录试剂盒将2 μg总RNA反转录为cDNA。按照SYBR Green RTFQPCR试剂盒的说明书建立终体积为20 μL的PCR体系。PCR热循环参数设置为:95 ℃、5 min,然后进行3步反应:94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,反应进行45个循环。引物对由Primer Premier Software 5.0(美国Premier Biosoft International公司)设计并合成,在ABI 7500系统进行RTFQ-PCR。实验以GAPDH和U6作为内参,引物序列见表1。实验结果采用2-ΔΔCt法进行计算。
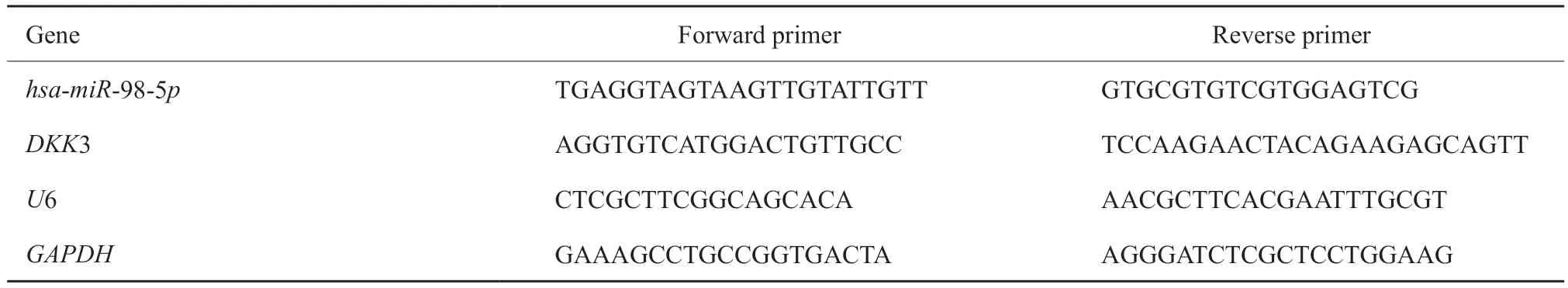
表1 基因引物序列Tab.1 Gene primer sequence
1.5.4 细胞转染和凋亡分析
细胞转染前1天,将细胞接种于96孔板中,接种密度为1×106个细胞/孔,待细胞密度达到50%~80%时,按照LipofectamineTM2000转染试剂说明书进行操作,将miR-NC mimics、miR-98-5p mimics、miR-NC inhibitor和miR-98-5p inhibitor转染于细胞中。转染48 h后,收集细胞并用磷酸盐缓冲液(phosphate-buffered saline,PBS)冲洗2次。将细胞与500 μL预冷的1×结合缓冲液和5 μL Annexin Ⅴ-FITC混合,室温避光温育15 min,于上机前5 min加入2.5 μl PI,使用流式细胞仪检测细胞凋亡率。实验重复3次。
由于每个国家的经济发展实际和财政收支计划不同,因此国债的发行规模也有很大差异。我国改革开放至今,经济增长迅速,其中,国债的发行在我国基础设施建设、项目资金筹集以及产业结构的调整过程中都起着非常重要的作用,但同时,由于我国的特色社会主义道路是符合我国国情、难以被复制的发展道路。因此,在评估我国国债规模和现状时,应当结合我国的经济实际,而不是片面地进行数据的分析。
1.5.5 CCK-8实验检测细胞增殖能力
实验前1 d,将对数生长期的MCF7细胞以1000个细胞/孔的密度接种于96孔板中,并将细胞置于37 ℃的培养箱中培养,第2天转染miR-NC mimics、miR-98-5p mimics、miR-NC inhibitor和miR-98-5p inhibitor,转染后将细胞分别培养24、48、72和96 h后,向培养孔内加入10 μL CCK-8溶液,于37 ℃温育1 h,用酶标仪于450 nm下检测吸光度(D)值,每组设置6个重复孔,绘制细胞增殖曲线。
1.5.6 平板克隆形成实验
将转染24 h后的细胞,用0.25%胰蛋白酶消化,制成单细胞悬液。将细胞接种于6孔培养板中,每孔500个细胞,并设置3个重复孔。细胞置于37 ℃、CO2体积分数为5%的培养箱中培养,培养期间每3 d更换1次培养基,培养15 d后,培养皿中出现肉眼可见的克隆时,终止培养。弃去培养基上清液,使用4 ℃预冷的PBS清洗细胞2~3次,加纯甲醇5 mL室温固定15 min后,PBS清洗3次,加适量Giemsa染色液染色15 min,用流水缓慢洗去染色液,空气干燥,拍照留存。在显微镜(低倍镜)下计数大于10个细胞的克隆数。计算克隆形成率。将对照组的克隆形成率设为100%,其余组别与对照组比较。
1.5.7 Transwell实验检测细胞迁移能力
细胞转染miR-NC mimics、miR-98-5p mimics、miR-NC inhibitor和miR-98-5p inhibitor后,每组取1×105个细胞重悬于500 μL无血清培养基中,并置于transwell板的上室中,下室中加入2 mL完全培养基,于细胞培养箱中培养48 h后,擦去上层细胞,侵入的下层细胞用甲醛固定,并用0.1%结晶紫溶液染色。在显微镜下计数5个独立的视野。
全基因合成DKK3野生型与突变型3’非翻译区(3’-untranslated region,3’-UTR),之后插入pGL4.10质粒中,经测序鉴定正确后,提取质粒备用。HEK-293T细胞以1×104个细胞/孔接种于24孔板中,培养24 h后,按照LipofectamineTM2000试剂说明书将miR-98-5p mimics或miR-NC mimics(50 nmol/L)与DKK3野生型或突变型质粒(0.5 μg)及10 ng pRL-SV40海肾荧光素酶质粒共转染细胞。转染48 h后,采用Dual-Glo Luciferase Assay System进行检测,具体操作为:从细胞培养箱中取出细胞,恢复至室温(20~25 ℃),加入Dual-Glo试剂,室温温育10~120 min,检测萤火虫荧光素酶活性;加入Dual-Glo终止反应液和Glo试剂,再次室温温育10~120 min,采用多功能酶标仪检测海肾荧光素酶活性。相对荧光素酶活性=萤火虫荧光素酶活性/海肾荧光素酶活性。
1.6 统计学处理
采用SPSS 18.0统计软件进行数据分析。两两比较应用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 差异miRNAs筛选
将处理后的数据进行筛选,其筛选的标准值设定为|log2(FC)|>4,P<0.05。之后得到两个差异miRNAs,分别为hsa-miR-133b和hsa-miR-98-5p,且两个差异miRNAs均上调(表2)。

表2 差异miRNAsTab.2 Differential miRNAs
2.2 差异miRNAs靶基因预测结果分析
在miRDB数据库预测得到1574个靶基因,在miRTarBase数据库预测得到863个靶基因,在StarBase数据库预测得到3993个靶基因。将3个数据库得到的靶基因取交集后,结果显示,2个差异miRNAs共有278个靶基因(图1),将结果绘制成miRNA-靶点网络图(图2)。
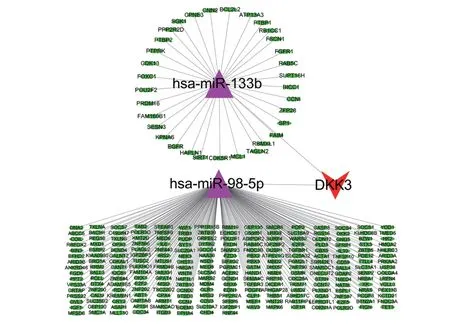
图2 miRNA-靶点网络图Fig.2 miRNA-target network
2.3 靶基因GO和KEGG通路分析结果
对靶基因进行富集分析,结果发现,靶基因未富集到MF,其中BP主要富集于positive regulation of cell cycle process、cellular response to amyloid-beta和positive regulation of cell cycle等,CC主要富集于transferase complex、transfering phosphorus-containing groups、heterochromatin和protein kinase complex等。KEGG通路富集分析显示,主要富集在microRNAs in cancer、signaling pathways regulating pluripotency of stem cells、FoxO signaling pathways和Wnt signaling pathways(图3)。
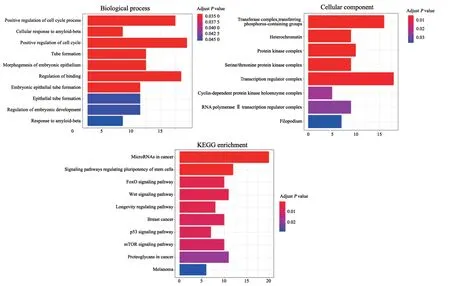
图3 靶基因GO分析和KEGG分析结果图Fig.3 Results of GO analysis and KEGG analysis of target gene
2.4 Hub基因筛选及miRNA-Hub基因网络图绘制结果分析
使用String数据库得到靶基因PPI数据,导入Cytoscape进行可视化(图4),筛选Hub前10位基因,得到的前10位Hub基因包括DKK1、WIF1、WNT2B、WNT6、DKK3、DVL3、SFRP1、SFRP5、DKK2和FZD3(图5A),绘制的miRNA-Hub基因网络结果显示,hsa-miR-133b和hsa-miR-98-5p共同作用于DKK3基因,且作用于hsa-miR-98-5p的Hub基因较多(图5B),以上结果提示hsa-miR-98-5p/DKK3轴可能在乳腺癌的进展中发挥关键作用,因此,本研究选择hsamiR-98-5p/DKK3信号轴进行后续实验。

图4 靶基因PPI分析结果图Fig.4 PPI analysis results of target gene
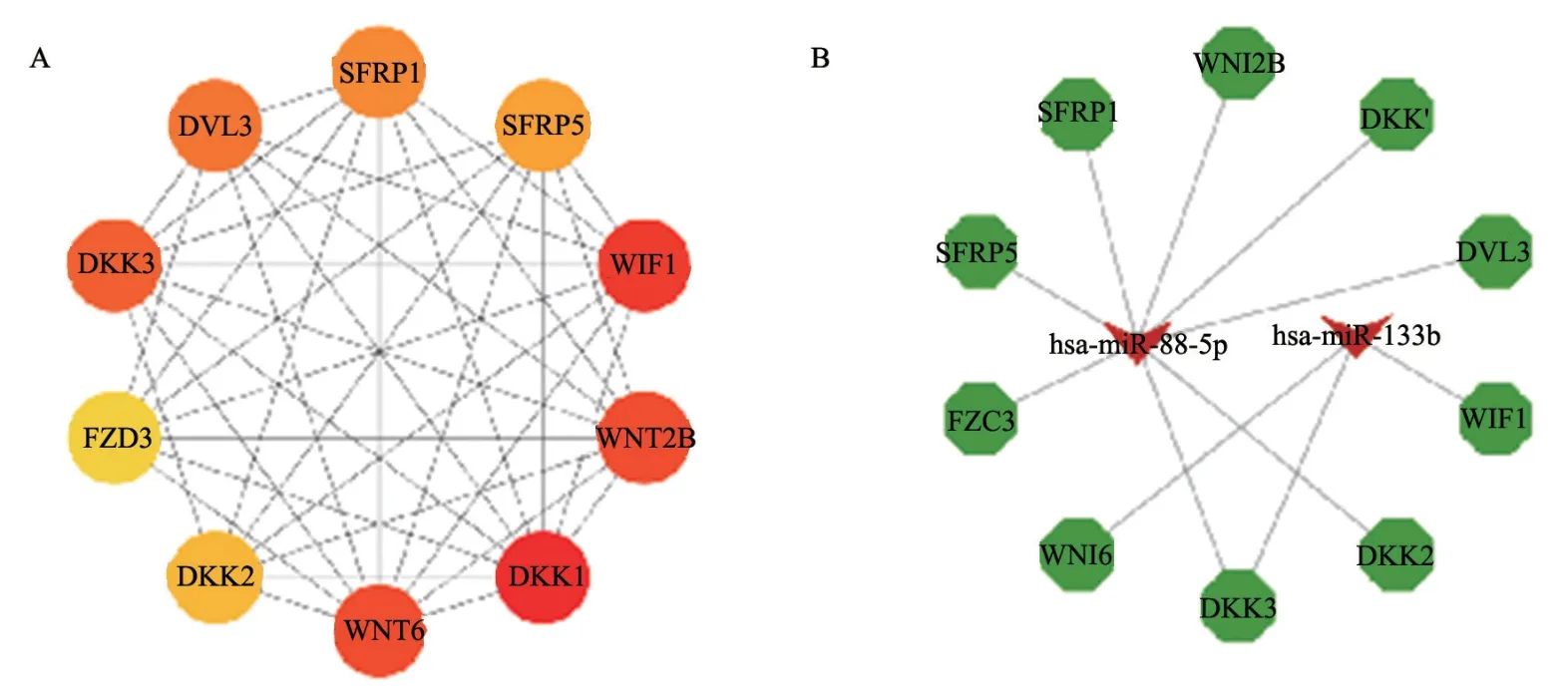
图5 前10位Hub基因筛选网络图和miRNA-Hub基因网络图Fig.5 Top 10 Hub gene screening network and miRNA-Hub gene network
2.5 Hsa-miR-98-5p在乳腺癌细胞系中的表达及其对DKK3表达的影响
在人正常乳腺细胞和人乳腺癌细胞系中检测hsa-miR-98-5p的表达,结果显示,与正常乳腺细胞相比,乳腺癌细胞系中hsa-miR-98-5p的表达水平均升高,且MCF-7细胞系升高的水平较高(图6A),后期实验均在MCF-7细胞上进行。过表达hsa-miR-98-5p后,DKK3表达下降;干扰hsamiR-98-5p后,DKK3表达上升,说明hsa-miR-98-5p与DKK3存在负性调控关系,DKK3可能为hsamiR-98-5p的下游靶基因(图6B)。
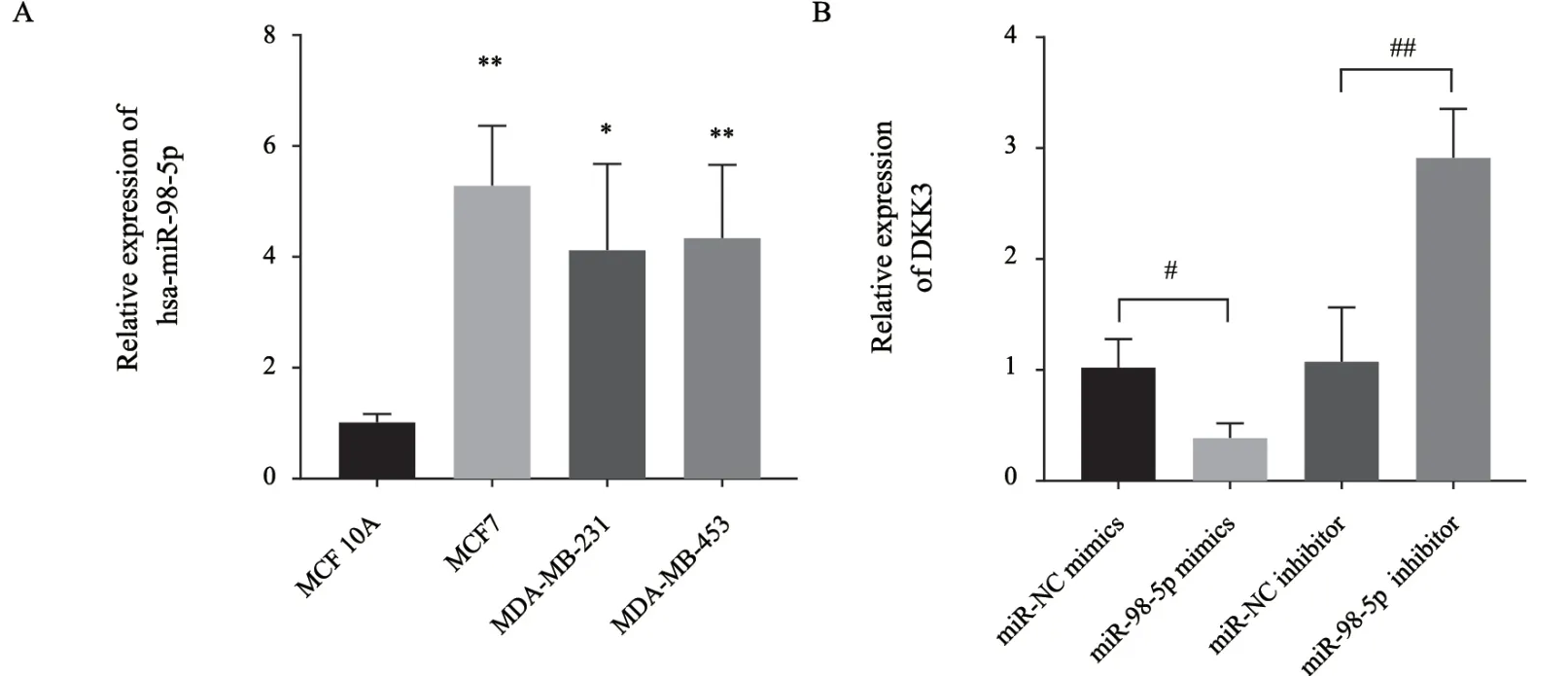
图6 Hsa-miR-98-5p在人正常乳腺细胞和乳腺癌细胞系中的表达及其对DKK3表达的影响Fig.6 Expression of hsa-miR-98-5p in human normal breast cells and breast cancer cell lines and its effect on DKK3 expression
2.6 Hsa-miR-98-5p对乳腺癌细胞凋亡、增殖、迁移的影响
细胞凋亡检测结果表明,与NC对照组比较,hsa-miR-98-5p的过表达显著抑制MCF-7细胞凋亡,hsa-miR-98-5p的干扰促进细胞凋亡(图7A、7B)。MTT实验结果表明,与NC对照组比较,hsa-miR-32-5p的过表达显著促进MCF-7细胞的增殖,hsa-miR-98-5p的干扰使细胞增殖能力显著下降(图7C)。平板克隆实验表明,与NC对照组比较,hsa-miR-98-5p的过表达能够显著增加MCF-7细胞克隆形成率,hsa-miR-98-5p的干扰使MCF-7细胞克隆形成率下降(图7D)。Transwell实验表明,与NC对照组比较,过表达hsa-miR-98-5p的MCF-7细胞侵袭能力增强,hsa-miR-98-5p的干扰使MCF-7细胞侵袭能力下降(图7E)。
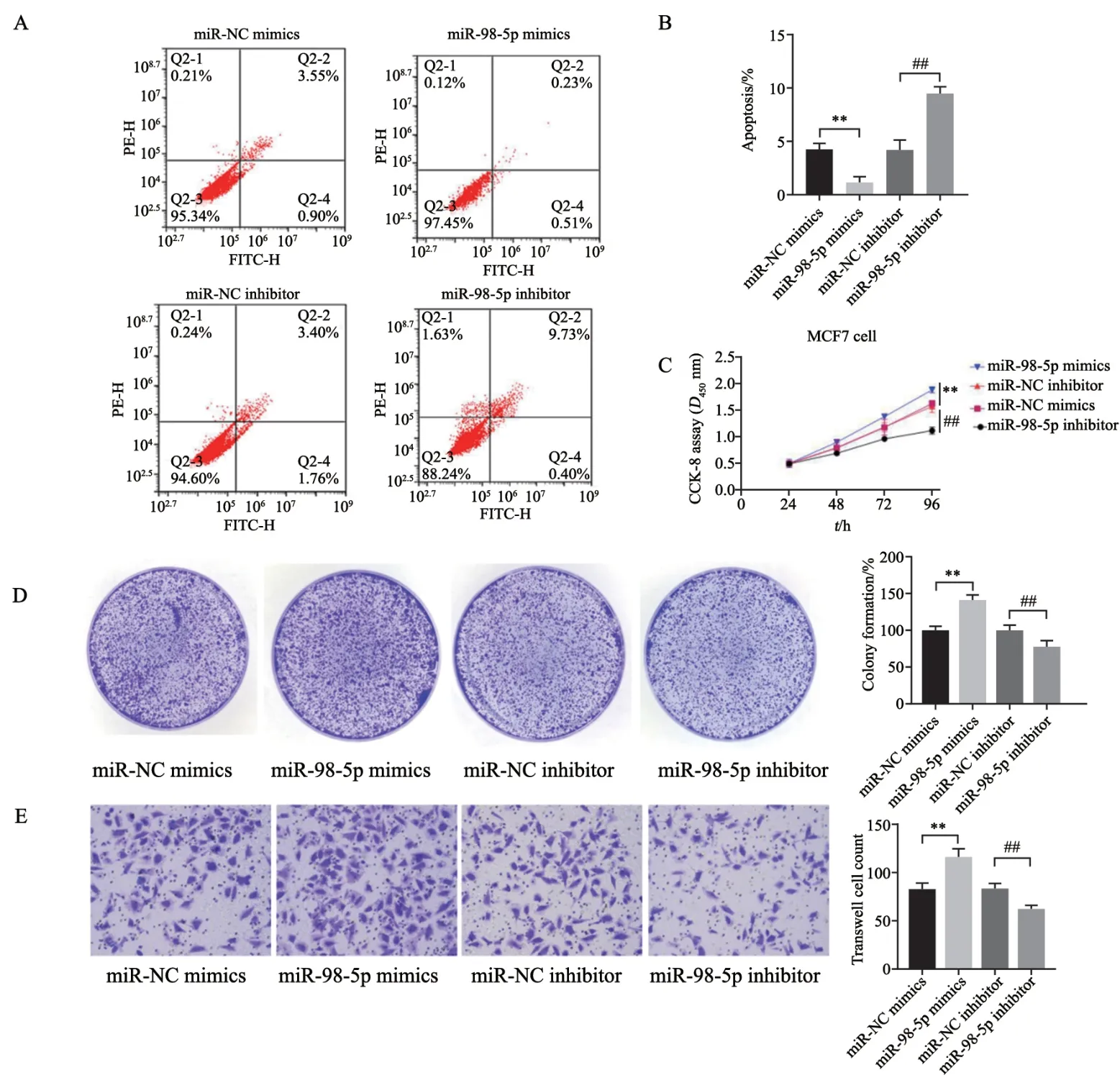
图7 hsa-miR-98-5p对MCF7细胞凋亡、增殖、迁移的影响Fig.7 Effect of hsa-miR-98-5p on apoptosis,proliferation and migration of breast cancer cells
2.7 DKK3和hsa-miR-98-5p的结合验证
根据Targetscan数据库的预测结果,DKK3和hsa-miR-98-5p有1个结合位点,其具体序列详见图8A。通过荧光素酶基因报告实验构建了野生型及突变型重组双荧光素酶报告基因质粒。双荧光素酶活性检测结果表明,共转WT-DKK3和hsamiR-98-5p的细胞荧光素酶报告基因的活性较其他组明显降低(P<0.01),而共转hsa-miR-98-5p和MUT-DKK3组的荧光素酶活性与对照组差异无统计学意义(P>0.05),证实hsa-miR-98-5p可直接作用于WT-DKK3(图8B)。
3 讨 论
目前,乳腺癌进展的确切分子机制尚未完全阐明,miRNA的发现和鉴定可能会为癌症研究开辟一条新的途径。有研究[13]显示,miRNA-382-5p/MXD1轴与乳腺癌进展相关,并促进细胞恶性表现。miRNA通过靶向FOXO3影响乳腺癌的进展[14],miRNA-99a靶向FGFR3抑制乳腺癌进展[15]。高通量生物检测技术可以同时获得癌症发生过程中大量基因的表达信息。通过生物信息学的方法分析这些基因表达信息,可以了解活细胞中的生物分子及其相互作用,从而确定疾病发生的关键因素,为临床治疗中的靶向设计提供参考[16]。
本研究通过TCGA数据库分析乳腺癌相关的miRNA测序数据,得到两个差异miRNAs,分别为hsa-miR-133b和hsa-miR-98-5p。通过对差异miRNAs进行靶基因预测,共获得靶基因278个。进一步对靶基因进行GO和KEGG功能富集分析,发现靶基因大多富集在癌症相关的途径中。结合String和Cytoscape,鉴定出PPI网络中前10位的Hub基因,并构建miRNA-Hub基因网络图,发现靶向hsa-miR-98-5p的基因较多,且Hub基因中DKK3同时靶向hsa-miR-133b和hsa-miR-98-5p,因此对hsa-miR-98-5p/DKK3轴进行进一步研究。
研究[17-18]表明,hsa-miR-98-5p在人类癌症中的作用有争议,其可以作为抑癌基因或癌基因发挥作用。研究[17]显示,hsa-miR-98-5p下调可通过反向调节MAP4K4的表达促进胰腺导管腺癌的进展,表明hsa-miR-98-5p具有肿瘤抑制作用。相反,Wang等[18]的研究显示,hsa-miR-98-5p在上皮性卵巢癌中表达增强,并且调节癌细胞对顺铂的敏感性。DKK3是DKK家族的一员,被广泛地认为具有肿瘤抑制作用[19],有研究[20]报道,DKK3基因的缺失会促进基底细胞样乳腺癌的发生。
基于以上分析,通过体外实验证实了hsamiR-98-5p/DKK3轴在乳腺癌中的存在。首先,发现hsa-miR-98-5p在乳腺癌细胞中的表达增加,这与之前的生物信息学分析结果一致。此外,利用荧光素酶活性报告基因实验验证hsa-miR-98-5p与DKK3的结合作用,发现hsa-miR-98-5p降低了携带WT-DKK3的乳腺癌细胞的荧光素酶活性,表明hsa-miR-98-5p与DKK3有直接联系。细胞功能学实验结果显示,hsa-miR-98-5p过表达可抑制细胞凋亡,促进细胞增殖、迁移和侵袭,提示hsa-miR-98-5p在乳腺癌中发挥重要作用。
本研究初步探讨了hsa-miR-98-5p/DKK3轴对乳腺癌细胞生物学行为的影响。后续将通过动物实验对hsa-miR-98-5p/DKK3轴在乳腺癌中的作用进行研究;其次,还需进一步明确DDK3的潜在下游分子和信号转导通路。
