卵巢癌与宫颈癌PIK3CA基因拷贝数变异及意义
2021-10-09郝佳星彭真邹淑花
郝佳星 彭真 邹淑花

[摘要] 目的 探讨卵巢癌及宫颈癌病人PIK3CA基因拷贝数变异的意义及其信号转导机制。方法 从癌症基因组图谱(TCGA)数据库得到宫颈癌(275例)和卵巢癌(201例)病人PIK3CA基因的mRNA表达矩阵、拷贝数变异情况及相关基因,进行生物信息学分析。结果 卵巢癌及宫颈癌PIK3CA基因拷贝数变异比例均较高。临床病理特征分析显示,卵巢癌病人PIK3CA基因扩增变异的病人预后较差,而宫颈癌病人PIK3CA基因扩增变异病人高级别病理分级占比较低。生存分析表明,PIK3CA基因扩增变异对卵巢癌及宫颈癌病人无病生存期和总生存期无显著影响。KEGG分析表明,宫颈癌及卵巢癌PIK3CA基因拷贝数扩增与不携带该基因拷贝数变异病人所激活的信号通路类似,PIK3CA基因拷贝数扩增会激活PI3K-AKT信号通路进而促进卵巢及宫颈上皮细胞发生恶性转化。GO分析表明,PIK3CA基因拷贝数扩增对细胞内的生物进程、分子功能、细胞组分均有显著影响。结论 PIK3CA基因拷贝数异常在卵巢癌及宫颈癌中极为常见,可能成为临床治疗的分子指标。
[关键词] 卵巢肿瘤;宫颈肿瘤;磷酸肌醇3-激酶类;基因剂量
[中图分类号] R737.3
[文献标志码] A
[文章编号] 2096-5532(2021)04-0493-05
拷貝数变异是后基因组时代被逐渐认识到的肿瘤性疾病特征性改变。人类基因组有众多频率、强度不等的重复序列,而拷贝数变异被定义为涉及范围从1 kb到数Mb不等的基因片段的删除、插入、复制及多位点变异的改变类型[1-2]。目前研究认为,拷贝数变异不仅是个体遗传差异的基础,也在体细胞恶性转化、肿瘤发生、进展及转移定植中发挥着重要作用,拷贝数变异相关指标或可成为理想的肿瘤诊断标志物。磷脂酰肌醇-3激酶(PI3K)/AKT是经典的肿瘤信号转导通路,PI3K/AKT通路的高活化与多种肿瘤凋亡抑制、侵袭转移及促血管生成密切相关,而PI3K是该通路的关键分子[3]。在哺乳动物中编码催化PI3K亚基的8种基因中,只有编码普遍表达的p110α催化亚基的PIK3CA常有高突变率[4]。突变的PIK3CA持续活化,上调PI3K/AKT通路水平进而参与肿瘤发生。既往已有较多关于结直肠癌、乳癌中PIK3CA突变及拷贝数变异的研究报道,而PIK3CA在卵巢癌、宫颈癌等妇科肿瘤中研究并不多见[3]。本文借助癌症基因组图谱(TCGA)数据库,将临床样本数据与RNA-Seq数据相结合,探讨PIK3CA基因拷贝数异常在卵巢癌、宫颈癌中的表型及信号转导机制,以期为卵巢癌及宫颈癌恶性进展机制研究及诊断提供思路[5]。
1 材料和方法
1.1 研究对象
相关数据自TCGA数据库网站中下载获取,检索TCGA数据库中有关宫颈癌及卵巢癌的 Illumina HiSeq_RNA-Seq测序数据并进行打包整理。
1.2 数据分析
1.2.1 纳入研究样本数量 在TCGA可视化数据库cBioPortal(https://www.cbioportal.org)中选择Ovary/Fallopain Tube→Ovarain Epithelial Tu-mor→Ovarain Serous Adenocarcinoma(TCGA, Pan Cancer Atlas),共获得了201例符合要求的研究样本;选择Cervix→Cervical Squamous Cell Carcinoma(TCGA, Pan Cancer Atlas),共获得275例符合要求的研究样本。
1.2.2 病人总体样本及PIK3CA基因的拷贝数扩增分析 分别选择Mutations;Putative copy-number alteration from GISTIC;mRNA Expression Zscores,RSEM(Batch normalized from Illumina HiSeq_RNASeqV2)。选择完毕后提取mRNA表达矩阵,运用R语言的R Bioconductor/DESeq2、ggplot等软件包进行生物信息学分析,并进行可视化作图。
1.2.3 病理特征分析 在所获取样本中,二次检索宫颈癌及卵巢癌病人中PIK3CA拷贝数扩增病人与不携带该基因拷贝数变异者的临床信息,分别收集具有完整病史及临床病理诊断结果等临床信息的卵巢癌及宫颈癌病人。
1.2.4 卵巢癌、宫颈癌肿瘤信号转导通路生物信息学发掘 根据RNA-Seq数据表达矩阵的矩阵分组,比较卵巢癌、宫颈癌PIK3CA拷贝数扩增病人与不携带该基因拷贝数变异者的基因差异,差异基因表达分析的数据要求先进行标准化以避免误差。所获得的数据使用软件edgeR(3.12.1)R Bioconductor包进行解析,以P<0.05为差异有统计学意义。采用功能分析(Gene Ontology, GO)方法及通路分析(Kyoto Encyclopedia of Genes and Genomes, KEGG)并富集分析差异基因功能。
1.2.5 生存分析 采用Kaplan-Meier及Cox模型对所获得的样本进行生存分析,对结果进行Log-rank检验,P<0.05表示差异有统计学意义。
2 结 果
2.1 两组病人PIK3CA基因的拷贝数扩增情况
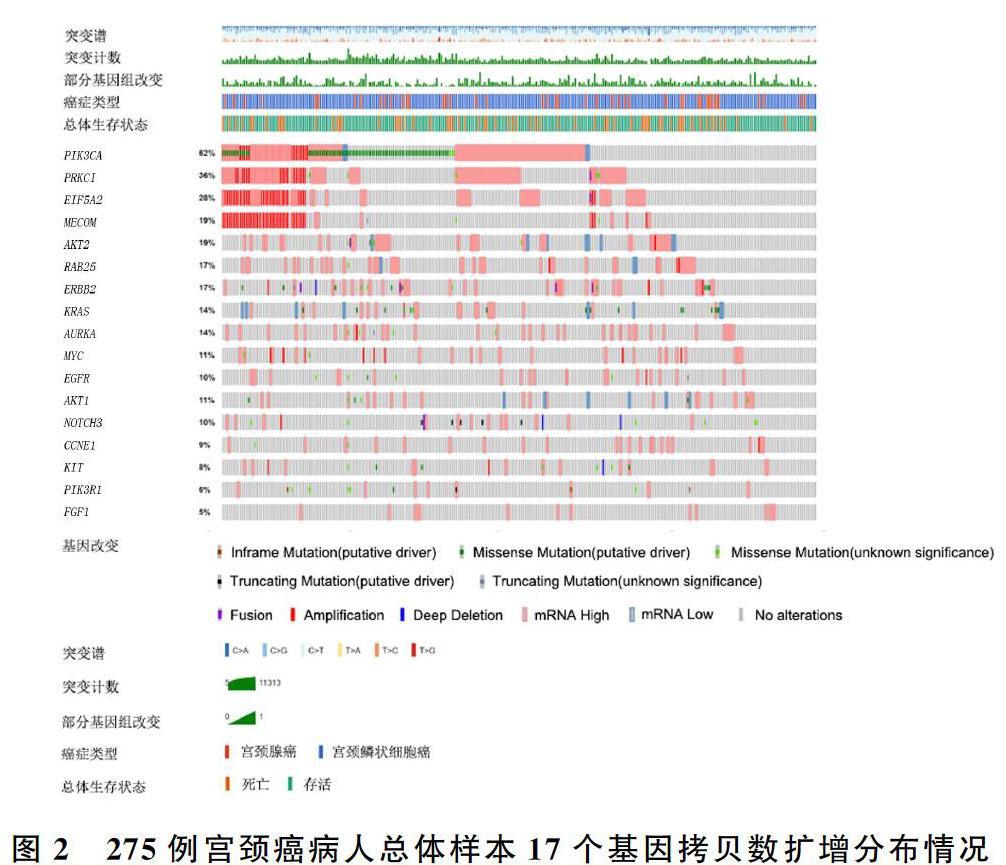
在纳入的卵巢癌201例研究样本中,对17个基因的扩增情况进行分析,扩增前5位的基因分别为PIK3CA(55%,110/201)、PRKCI(48%,96/201)、MYC(41%,82/201)、MECOM(35%,70/201)和KRAS(33%,66/201),其病理分型均为卵巢上皮性肿瘤。在纳入的宫颈癌275例研究样本中,对17个基因的扩增情况进行分析,扩增前5位的基因分别为PIK3C(62%,170/275)、PRKCI(36%,99/275)、EIF5A2(28%,77/275)、MECOM(19%,52/275)和AKT2(19%,52/275);病理分型中宫颈鳞状细胞癌占84.5%,宫颈腺癌占8.8%,宫颈黏液腺癌占5.7%,子宫内膜样癌占1.0%。病人总体样本17个基因拷贝数扩增分布见图1、2。
2.2 卵巢癌及宫颈癌PIK3CA基因拷贝数扩增病人的临床及病理特征
在纳入的201例卵巢癌研究样本中,PIK3CA基因拷贝数扩增110例;在纳入的275例宫颈癌研究样本中,PIK3CA基因拷贝数扩增170例。对PIK3CA基因拷贝数扩增病人的临床及病理特征分析显示,PIK3CA基因拷贝数扩增在卵巢癌及宫颈癌41~60岁年龄病人占比最高,均超过50%。在卵巢癌病人中,PIK3CA基因拷贝数扩增与不携带该基因拷贝数变异病人肿瘤各病理分级比例接近,其中病理分级为3级者占比均超过80%,而且PIK3CA基因拷贝数扩增病人的病死率(50.91%)明显高于不携带该基因拷贝数变异者(39.56%)。而在宫颈癌病人中,PIK3CA基因拷贝数扩增病人高级别病理分级占比(32.94%)明显低于不携带该基因拷贝数变异者(53.33%),而PIK3CA基因拷贝数扩增病人的病死率(20.49%)低于不携带该基因拷贝数变异者(24.76%)。PIK3CA基因拷贝数扩增影响卵巢癌病人病死率,而在宫颈癌病人中对肿瘤的病理分级具有显著影响。见表1。
2.3 PIK3CA基因拷贝数扩增与预后相关性
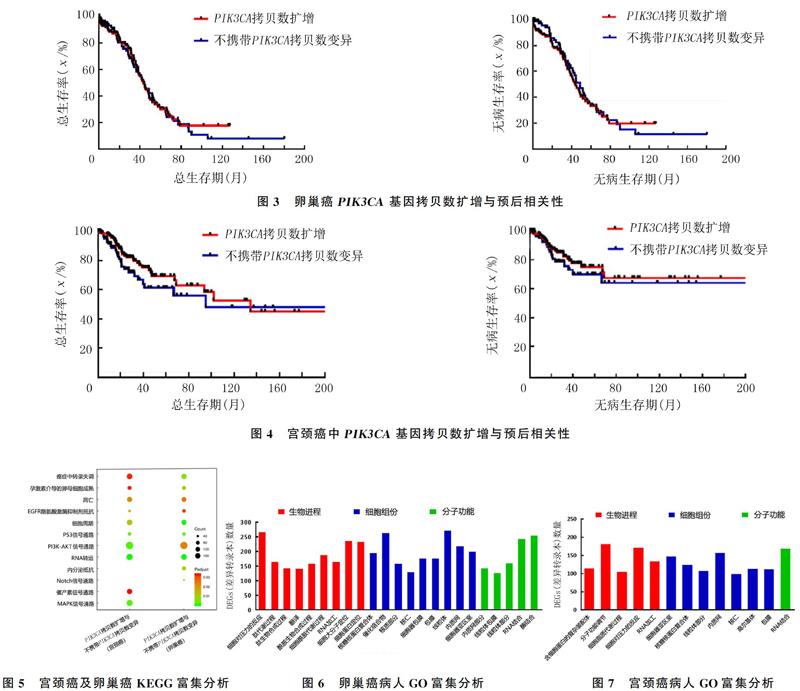
生存分析显示,卵巢癌病人不携带PIK3CA基因拷贝数变异病人的无病生存期和总生存期长于PIK3CA基因拷贝数扩增者,但差异无显著性(P>0.05);宫颈癌病人不携带PIK3CA基因拷贝数变异者与PIK3CA基因拷贝数扩增者的总生存期与无病生存期无明显差异(P>0.05)。见图3、4。
2.4 宫颈癌及卵巢癌病人中的生物信息学分析
KEGG分析表明,宫颈癌及卵巢癌PIK3CA基因拷贝数扩增与不携带该基因拷贝数变异病人所激活的信号通路类似,PIK3CA基因所参与的较为有关联性的信号通路见图5。对PIK3CA基因拷贝数扩增病人与不携带该基因拷贝数变异者的差异基因进行比较,结果显示PIK3CA基因拷贝数扩增可能会引起一些基因表达网络调控的变化,从而激活下游一些信号通路。PIK3CA的激活可参与调节第二信使PIP3的传导以及PI3K磷酸化,激活PI3K-AKT信号通路。KEGG富集分析表明,在宫颈癌及卵巢癌病人中,PIK3CA拷贝数扩增与细胞转录失调、RNA转运密切相关。利用DAVID数据库(https://david.ncifcrf.gov/home.jsp)对差异基因数目大于100的通路进行GO分析显示,细胞内的三大板块生物进程、分子功能、细胞组分很多方面均受到显著影响。见图6、7。
3 讨 论
随着肿瘤生物学研究的深入,人们对肿瘤的认知深入到了分子水平。目前就肿瘤细胞恶性转化及进展机制,最广泛被接受的是“突变致癌”学说[6-7]。基因拷贝数变异是一种常见的基因多位点突变形式,其可影响肿瘤的生物学表型及异质性,驱动肿瘤复杂性生长。卵巢癌、宫颈癌均是极为常见的妇科恶性肿瘤[8-10]。开发出理想的实验室诊断标志物,对卵巢癌和宫颈癌早期诊断、明确肿瘤分期进而制定正确治疗方案及改善病人预后均有重大意义[11-13]。
肿瘤细胞中存在着多条信号转导通路异常表达,PI3K/AKT为其中常见的通路之一。PI3K是影响该通路表达水平的决定性分子[14],PI3K的持续活化常预示着肿瘤细胞发生恶性转化。PI3K为异源二聚分子,其基本结构由一个起催化作用的PI3KC亚基和一个起调节作用的PI3KR亚基组成,而PI3KC亚基又由PI3KCA、PI3KCB等亚单位构成[15-16]。其中,PI3KCA分子结构的改变常导致PI3K持续激活,上调PI3K/AKT水平进而导致肿瘤的发生[17]。
本文的研究結果显示,卵巢癌以及宫颈癌病人PIK3CA基因均有显著的扩增,其占比分别为55%和62%;宫颈癌病人PIK3CA基因扩增最多的为鳞状细胞癌(84.5%),而卵巢癌病人病理类型均为卵巢浆液性上皮肿瘤,提示PIK3CA基因扩增检测有助于卵巢肿瘤的鉴别诊断。本文研究对TCGA数据库及cBioPortal网站检索到的卵巢癌及宫颈癌PIK3CA基因拷贝数扩增病人的临床数据与表达矩阵分析显示,相较于正常人群[18],PIK3CA基因在卵巢癌及宫颈癌病人中扩增率与拷贝数变异增加明显;同时,卵巢癌及宫颈癌病人PIK3CA基因拷贝数扩增病人中41~60岁所占比例均超过50%;卵巢癌病人中,病理分级3级比例最高,而宫颈癌病人PIK3CA基因拷贝数扩增病人病理分级中、高级别比例接近。从临床转化医学的观点来看[19],或许PIK3CA突变可作为卵巢癌病理分型的依据,但具体价值需要进一步的临床研究。本文结果还显示,卵巢癌及宫颈癌PIK3CA基因拷贝数扩增病人与不携带PIK3CA拷贝数变异者的病死率不同,可能与本文样本量不够大有关,结论有待进一步验证。本文生存分析显示,卵巢癌病人中不携带PIK3CA拷贝数变异的病人总生存期与无瘤生存期可能更长,PIK3CA拷贝数变异可能预示不良结局;对宫颈癌而言,并无证据证实PIK3CA拷贝数扩增和病人不良结局有关。
本文KEGG与GO分析结果显示,PI3K-AKT信号通路在正常的生理状况下能够促进细胞生长,PIK3CA扩增或突变会引起转录调控失活,这与其他学者的研究结果一致[20]。PIK3CA的激活可参与调节第二信使PIP3的传导以及PI3K磷酸化,激活PI3K-AKT信号通路。其中PTEN磷酸酶活性增加可以被氧化应激反应激活,而AKT磷酸化的变化会引起其下游蛋白的变化,包括下游凋亡、细胞周期、孕酮介导的卵母细胞成熟等相关基因蛋白的表达变化。在卵巢癌病人中,PIK3CA拷贝数扩增除了影响上述信号通路外,还影响内分泌抵抗信号通路。这预示着PIK3CA拷贝数扩增对卵巢癌病人的影响作用更加广泛,生物功能更为多样。
有富集分析结果显示,PIK3CA扩增和多种细胞恶性转变相关,主要影响细胞生长、分化和维持、凋亡以及信号传导等过程以及基因产物在细胞中的位置[20],同时内质网、核或蛋白酶体等也受到显著影响,如包括细胞应激反应、细胞的蛋白质定位等。此外,转录组测序研究可以帮助我们找到更加复杂详细的基因蛋白互作网路,了解下游基因蛋白的类型与功能。PIK3CA基因作为一种重要的癌基因,对其进行深入研究将为阐述肿瘤的分子发生机制、早期诊断、病理监测、肿瘤生物学行为判断、预后评估提供丰富的临床资料。
综上所述,PIK3CA基因在卵巢癌及宫颈癌中具有特征性的拷贝数改变,PIK3CA基因突变与卵巢癌、宫颈癌恶性转化及进展密切相关。对卵巢癌、宫颈癌拷贝数变异数据进行深入探索及综合分析,可为妇科恶性肿瘤标志物开发、分子病理分型及制定个体化治疗策略提供思路。
[参考文献]
[1]KINROSS K M, MONTGOMERY K G, KLEINSCHMIDT M, et al. An activating Pik3ca mutation coupled with Pten loss is sufficient to initiate ovarian tumorigenesis in mice[J]. The Journal of Clinical Investigation, 2012,122(2):553-557.
[2]SHI X L, QU M Y, JIN X, et al. Relationship between TSHR, BRAF and PIK3CA gene copy number variations and thyroid nodules[J]. Endocrine, 2021(prepublish).
[3]DAI J F, WANG L, LI L, et al. Interplay of microRNAs to genetic, epigenetic, copy number variations of cervical cancer related genes[J]. Journal of Reproductive Immunology, 2020,142:103184.
[4]BOCHTLER T, REILING A, ENDRIS V, et al. Integrated clinicomolecular characterization identifies RAS activation and CDKN2A deletion as independent adverse prognostic factors in cancer of unknown primary[J]. International Journal of Can-cer, 2020,146(11):3053-3064.
[5]RODRIGUES C, JOY L R, SACHITHANANDAN S P, et al. Notch signalling in cervical cancer[J]. Experimental Cell Research, 2019,385(2):111682.
[6]張钏,郝胜菊,王惠玲. 基因组拷贝数变异与妇科恶性肿瘤的相关性研究进展[J]. 中国妇幼保健, 2019,34(10):2411-2414.
[7]JI X, CHEN F, ZHOU Y F, et al. Copy number variation profile in noninvasive prenatal testing (NIPT) can identify co-existing maternal malignancies: case reports and a literature review[J]. Taiwanese Journal of Obstetrics & Gynecology, 2018,57(6):871-877.
[8]李佳佳,陈默,尧良清. 基于循环肿瘤DNA的染色体不稳定性检测在卵巢癌中的研究进展[J]. 中国肿瘤, 2018,27(7):521-524.
[9]WANG L M, SHEN H, ZHU D, et al. Increased high mobility group A 2 expression promotes transition of cervical intraepithelial neoplasm into cervical cancer[J]. Oncotarget, 2018,9(8):7891-7901.
[10]YAN D, YI S, CHIU W C, et al. Integrated analysis of chromosome copy number variation and gene expression in cervical carcinoma[J]. Oncotarget, 2017,8(65):108912-108922.
[11]李蕾,沈铿. PIK3CA基因在浆液性卵巢癌中的拷贝数扩增分析及其机制探讨[J]. 现代妇产科进展, 2017,26(7):481-484.
[12]CHEN L, SUN F H, YANG X D, et al. Correlation between RNA-Seq and microarrays results using TCGA data[J]. Gene, 2017,628:200-204.
[13]康雅芳,孙蓬明. 拷贝数变异在妇科恶性肿瘤中的研究进展[J]. 国际妇产科学杂志, 2016,43(5):493-496.
[14]OKKENHAUG K, GRAUPERA M, VANHAESEBROECK B. Targeting PI3K in cancer: impact on tumor cells, their protective stroma, angiogenesis, and immunotherapy[J]. Cancer Discovery, 2016,6(10):1090-1105.
[15]ZHAO W H, HAO M, CHENG X T, et al. C-myc gene copy number variation in cervical exfoliated cells detected on fluorescence in situ hybridization for cervical cancer screening[J]. Gynecologic and Obstetric Investigation, 2016,81(5):416-423.
[16]LI X C, LIU C L, HUANG T, et al. The occurrence of gene-tic alterations during the progression of breast carcinoma[J]. BioMed Research International, 2016,2016:5237827.
[17]VANHAESEBROECK B, WHITEHEAD M A, PIEIRO R. Molecules in medicine mini-review: isoforms of PI3K in biology and disease[J]. Journal of Molecular Medicine, 2016,94(1):5-11.
[18]BELLMUNT J, WERNER L, LEOW J J, et al. Somatic copy number abnormalities and mutations in PI3K/AKT/mTOR pathway have prognostic significance for overall survival in platinum treated locally advanced or metastatic urothelial tumors[J]. PLoS One, 2015,10(6):e0124711.
[19]SUGA Y, SUGAI T, UESUGI N, et al. Molecular analysis of isolated tumor glands from endometrial endometrioid adenocarcinomas[J]. Pathology International, 2015,65(5):240-249.
[20]DATTA S R, DUDEK H, TAO X, et al. Akt phosphorylation of BAD couples survival signals to the cell-intrinsic death machinery[J]. Cell, 1997,91(2):231-241.
(本文編辑 黄建乡)
