磁性MOFs材料Fe3O4@SiO2@UiO-66-SO3H对Co(Ⅱ)的吸附性能
2021-10-09古建杉刘德蓉袁果园
古建杉,刘德蓉,周 倩,李 建,汤 毅,袁果园,*,熊 伟,刘 宁
(1.重庆科技学院 化学化工学院,重庆 401331; 2.四川大学 原子核科学技术研究所 辐射物理及技术教育部重点实验室, 四川 成都 610064)
60Co是一种堆造放射性同位素,由慢中子源轰击59Co获得,半衰期为5.27 a。因其能释放γ射线,广泛应用于辐射育种、虫害防治、辐射消毒和放射治疗等领域[1-2]。在60Co的生产和使用过程中,不可避免地会产生含60Co放射性废水,这些废水未经处理直接排放,极易对环境和人体造成放射性污染和辐射损伤。因此,从含60Co放射性废水中分离60Co对环境治理具有十分重要的意义。
金属-有机骨架材料(MOFs)是由无机单元(金属离子中心或金属簇等)和有机连接剂(羧酸盐、偶氮盐等)桥连而成的多空配位聚合物,具有功能性强、孔隙率高、比表面积大等特点,广泛用于金属离子的分离研究[3]。Huang等[4]采用柔性配位合成后修饰策略制备了铋硫醇功能化HKUST-1材料并用于Hg2+的分离,吸附量为264 mg/g。Ahmed等[5]将乙二胺嫁接在具有游离羧基的UiO-66上得到UiO-66-COOH-ED,其对Gd3+的最大吸附量达78.4 mg/g。Yuan等[6]将希夫碱接枝到锆基MOFs材料UiO-66-NH2上制得希夫碱功能化的MOFs材料UiO-66-Schiff base,对Co(Ⅱ)的最大吸附量达256.4 mg/g。随后,他通过结合密度泛函理论(DFT)计算和合成后修饰法进一步研究了不同功能基团(酯基、酰胺基、腈基、磺酸基)修饰的MOFs材料对Co(Ⅱ)的分离性能,结果发现几种基团功能化的MOFs材料对Co(Ⅱ)均具有较好的吸附效果且与理论计算一致。然而,通过合成后修饰尽管能提高MOFs材料对Co(Ⅱ)的吸附量,却存在制备工艺复杂、接枝量难以准确计算等问题。因此,本工作希望通过一步法将磺酸基功能化的锆基MOFs材料UiO-66-SO3H与SiO2包裹的磁性颗粒Fe3O4相结合制得功能化的磁性MOFs材料Fe3O4@SiO2@UiO-66-SO3H,并用于Co(Ⅱ)的分离研究,以解决合成后修饰制备工艺繁琐等问题,实现Co(Ⅱ)的磁性高效分离。
1 实验
1.1 主要试剂与仪器
氢氧化钠,分析纯,成都科隆有限公司;N,N-二甲基甲酰胺、对苯二甲酸、2-磺酸基对苯二甲酸单钠、四氯化锆、2-(环己基氨基)-乙磺酸(CHES)、Fe3O4、六水硝酸钴,分析纯,中国麦克林有限公司。
DHG-9023A电热鼓风干燥箱,合恒公司;T6紫外可见分光光度计,普析通用公司;THZ-82AS冷冻水浴恒温振荡器,荣华公司;BRUKER TENSOR Ⅱ傅立叶红外光谱仪(FT-IR),德国布鲁克公司;JSM-7001F热场发射扫描电子显微镜,日本电子公司;XRD-7000 X射线衍射仪(XRD)、AXIS-ULTRA DLD型X射线光电子能谱仪(XPS),日本岛津公司;EZ7振动样品磁强计,美国MicroSense公司。
1.2 实验水样
称取4.938 0 g 六水硝酸钴于250 mL烧杯中,加入含2%硝酸的去离子水溶解后转移至1 000 mL容量瓶中稀释定容,即得到1 000 mg/L Co(Ⅱ)储备液。实验前用0.050 0 mol/L的2-环己胺基乙磺酸(CHES)溶液(缓冲溶液)稀释至相应浓度,再用氢氧化钠溶液或硝酸溶液进行pH值调节。
1.3 Fe3O4@SiO2@UiO-66-SO3H制备
1) Fe3O4@SiO2制备
将1.50 g Fe3O4加入到7.5 mL 氨水和240 mL无水乙醇混合溶液中,机械搅拌下滴加9 mL正硅酸乙酯和30 mL无水乙醇的混合溶液,常温下搅拌反应12 h,所得产品使用磁铁分离并用超纯水和无水乙醇洗涤数次,在60 ℃下真空干燥即得Fe3O4@SiO2。
2) Fe3O4@SiO2@UiO-66-SO3H制备
取2.38 g ZrCl4、1.34 g对苯二酸、0.540 g 2-磺酸基对苯二甲酸单钠溶于180 mL DMF和20 mL冰乙酸中,再加入1.20 g Fe3O4@SiO2,超声15 min后转入500 mL圆底烧瓶中,120 ℃油浴机械搅拌24 h,待溶液冷却至室温后,产品用磁铁进行分离,并用蒸馏水和DMF洗涤数次,所得样品在80 ℃下真空干燥即得Fe3O4@SiO2@UiO-66-SO3H。
1.4 Fe3O4@SiO2@UiO-66-SO3H对Co(Ⅱ)的吸附
称取10 mg 吸附剂于250 mL锥形瓶中,加入100 mL调节pH值后的一定浓度的Co(Ⅱ)溶液,放入恒温振荡箱中,在一定温度下进行振荡吸附。吸附完成后,使用磁铁对吸附剂进行磁性分离,取上层清液并用紫外分光光度计测定其Co(Ⅱ)浓度。采用下式计算吸附量:
(1)
其中:qt为t时刻的吸附量,mg/g;c0和ct分别为溶液中Co(Ⅱ)的初始浓度和t时刻的浓度,mg/L;V为溶液体积,mL;m为吸附剂质量,g。
2 结果与讨论
2.1 吸附剂的表征
Fe3O4@SiO2和Fe3O4@SiO2@UiO-66-SO3H吸附Co(Ⅱ)前后的XRD谱示于图1a。从图1a可知,磁基体Fe3O4@SiO2(2θ=30.1°、35.5°、43.1°、57.1°)及UiO-66-SO3H包裹后的磁性Fe3O4@SiO2@UiO-66-SO3H材料(2θ=7.3°、8.4°、17.0°、25.7°)的XRD谱与文献报道的Fe3O4[7]和UiO-66[8]的XRD谱一致,表明成功制得Fe3O4@SiO2和Fe3O4@SiO2@UiO-66-SO3H。

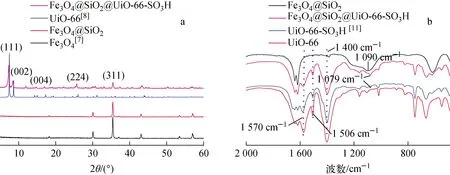
图1 磁性MOFs材料的XRD谱(a)和FT-IR谱(b)Fig.1 XRD (a) and FT-IR (b) patterns of magnetic MOFs
Fe3O4@SiO2@UiO-66-SO3H的SEM图像示于图2,其N2吸附-脱附曲线示于图3。从图2可见,材料呈堆积状态,表面具有分布均匀的细小块状体,块状体棱角分明且表面较为光滑。根据图3可得到材料的孔结构参数,与磁基体Fe3O4@SiO2相比,吸附剂的比表面积从29.4 m2/g增加至739.6 m2/g,孔容从0.023 cm3/g增加至0.047 cm3/g,而平均孔径从7.12 nm降低至3.56 nm,进一步证明所制备吸附剂为Fe3O4@SiO2@UiO-66-SO3H,且该吸附剂兼具磁基体的磁性和MOFs材料的多孔结构等优异性能。

图2 Fe3O4@SiO2@UiO-66-SO3H的SEM图像Fig.2 SEM image of Fe3O4@SiO2@UiO-66-SO3H

图3 Fe3O4@SiO2和Fe3O4@SiO2@UiO-66-SO3H 的N2吸附-脱附等温线Fig.3 N2 adsorption-desorption isotherm for Fe3O4@SiO2 and Fe3O4@SiO2@UiO-66-SO3H
Fe3O4@SiO2和Fe3O4@SiO2@UiO-66-SO3H的磁滞回归曲线示于图4。从图4可看出,此材料的饱和磁化强度为12.4 A·m2/kg与磁基体Fe3O4@SiO2的饱和磁化强度(48.4 A·m2/kg)相比有所下降,这是由于磁基体表面包裹了一层非磁性的UiO-66-SO3H所致。

图4 Fe3O4@SiO2@UiO-66-SO3H的磁滞回归曲线Fig.4 Hysteresis regression curve of Fe3O4@SiO2@UiO-66-SO3H
2.2 Fe3O4@SiO2@UiO-66-SO3H吸附Co(Ⅱ)的影响因素
1) 初始pH值
c0=10 mg/L、温度298 K、t=24 h、m=10 mg下,初始pH值对Fe3O4@SiO2和Fe3O4@SiO2@UiO-66-SO3H吸附Co(Ⅱ)的影响示于图5。由图5可见,在实验所设初始pH值下,Fe3O4@SiO2@UiO-66-SO3H对Co(Ⅱ)的吸附量均较Fe3O4@SiO2的高。表明UiO-66-SO3H功能化后的材料吸附性能更好。当初始pH值由4增加到7时,Fe3O4@SiO2@UiO-66-SO3H对Co(Ⅱ)的吸附量随溶液初始pH值的增加而增加,但总的吸附量较低,这主要是由于pH≤7时,溶液中存在大量的质子与Fe3O4@SiO2@UiO-66-SO3H的吸附位点的结合较与Co(Ⅱ)的结合更强,因此Co(Ⅱ)的吸附量较低[12]。当初始pH值由7增加到9时,Fe3O4@SiO2@UiO-66-SO3H对Co(Ⅱ)吸附量显著增加,这是因为随着初始pH值的增加,溶液中质子逐渐减少,Fe3O4@SiO2@UiO-66-SO3H暴露出更多的吸附位点与Co(Ⅱ)结合,吸附量逐渐增加。Fe3O4@SiO2@UiO-66-SO3H在初始pH=9时的吸附量较高,主要是由于此时已有部分Co(Ⅱ)以Co(OH)2形式沉淀[13]。因此,后续研究选择在初始pH=8.3下进行。
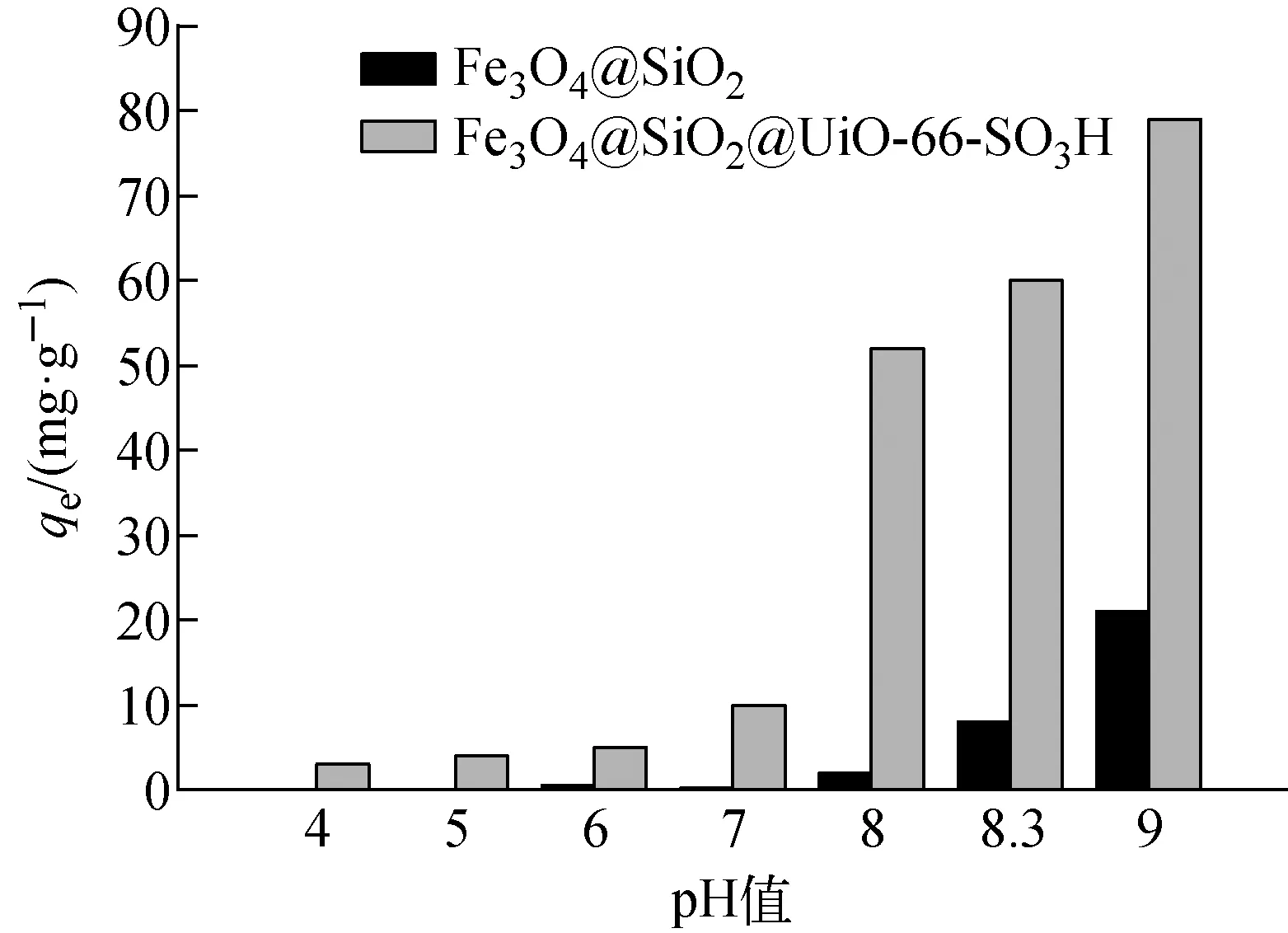
图5 初始pH值对Fe3O4@SiO2和 Fe3O4@SiO2@UiO-66-SO3H吸附Co(Ⅱ)的影响Fig.5 Effect of initial pH on adsorption of Co(Ⅱ) on Fe3O4@SiO2 and Fe3O4@SiO2@UiO-66-SO3H
2) 吸附时间
c0=10 mg/L、温度298 K、初始pH=8.3、m=10 mg下,吸附时间对Fe3O4@SiO2@UiO-66-SO3H吸附Co(Ⅱ)的影响示于图6。由图6可见,在前4 h内Fe3O4@SiO2@UiO-66-SO3H对Co(Ⅱ)的吸附是一快速过程,此后随着时间的延长,吸附速率逐渐降低并趋于平衡,最大吸附量为62 mg/g,吸附平衡时间为24 h。

图6 吸附时间对Fe3O4@SiO2@UiO-66-SO3H 吸附Co(Ⅱ)的影响Fig.6 Effect of time on adsorption of Co(Ⅱ) on Fe3O4@SiO2@UiO-66-SO3H
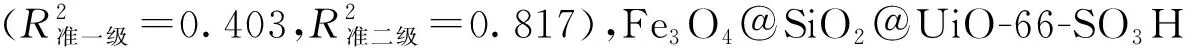
ln(qe-qt)=lnqe-k1t
(2)
(3)
式中:qe为平衡吸附量,mg/g;k1(min-1)和k2(g/(mg·min))分别为准一级动力学模型和准二级动力学模型的吸附速率常数。
3) Co(Ⅱ)初始浓度
t=24 h、温度298 K、初始pH=8.3、m=10 mg下,Co(Ⅱ)初始浓度对Fe3O4@SiO2@UiO-66-SO3H吸附Co(Ⅱ)的影响示于图7。由图7可见,随着Co(Ⅱ)初始浓度的增加,Fe3O4@SiO2@UiO-66-SO3H对Co(Ⅱ)的平衡吸附量逐渐增大,25 mg/L时平衡吸附量最大,为92 mg/g。
为进一步研究吸附模式,采用Langmuir吸附等温模型(式(4))和Freundlich吸附等温模型(式(5))[15-16]对图7中的实验数据进行拟合,结果列于表1。表1表明,Fe3O4@SiO2@UiO-66-SO3H对Co(Ⅱ)的吸附更符合Langmuir吸附等温模型(R2=0.991),说明吸附过程以单层吸附为主。采用Langmuir吸附等温模型可得,Fe3O4@SiO2@UiO-66-SO3H对Co(Ⅱ)的理论最大吸附量为106 mg/g。

表1 Langmuir和Freunlich等温吸附模型参数 Table 1 Parameter of Langmuir and Freunlich isotherms model
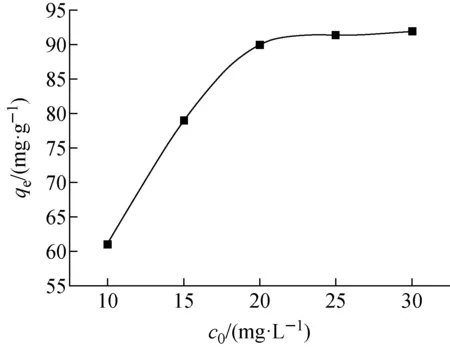
图7 Co(Ⅱ)初始浓度对Fe3O4@SiO2@UiO-66-SO3H 吸附Co(Ⅱ)的影响Fig.7 Effect of initial concentration of Co(Ⅱ) on adsorption of Co(Ⅱ) on Fe3O4@SiO2@UiO-66-SO3H
(4)
(5)
式中:ce为平衡浓度,mg/L;qm为理论最大吸附量,mg/g;KL为Langmuir吸附平衡常数,L/mg;KF(mg/(g·(L/mg)1/n))和n分别为与吸附能力和吸附强度相关的Freundlich常数。
4) 温度
c0=10 mg/L、t=24 h、初始pH=8.3、m=10 mg下,温度对Fe3O4@SiO2@UiO-66-SO3H吸附Co(Ⅱ)的影响示于图8。由图8可见,Fe3O4@SiO2@UiO-66-SO3H对Co(Ⅱ)的吸附量随温度的升高而增加,在288、298、308 K下平衡吸附量分别85、92、103 mg/g,表明升温有利于Co(Ⅱ)的吸附。

图8 温度对Fe3O4@SiO2@UiO-66-SO3H 吸附Co(Ⅱ)的影响Fig.8 Effect of temperature on adsorption of Co(Ⅱ) on Fe3O4@SiO2@UiO-66-SO3H
为进一步研究吸附过程的热力学参数,对图8中的实验数据进行拟合,采用式(6)、(7)[17]计算其焓变(ΔH⊖,kJ/mol)、熵变(ΔS⊖,J/mol/K)和吉布斯自由能变(ΔG⊖,kJ/mol):
(6)
ΔG⊖=ΔH⊖-TΔS⊖
(7)
式中:T为绝对温度,K;R为理想气体常数,取8.314 J/(mol·K);Kd为热力学常数,其值由Khan[18]公式计算,即以ln(qe/ce)对qe作图,qe=0时的截距即为lnKd的值。
Fe3O4@SiO2@UiO-66-SO3H吸附Co(Ⅱ)的热力学参数列于表2。由表2可见,ΔG⊖<0 kJ/mol,说明吸附过程是自发的;ΔH⊖>0,说明吸附过程吸热。综上可知,Fe3O4@SiO2@UiO-66-SO3H对Co(Ⅱ)的吸附是一自发吸热过程。

表2 Fe3O4@SiO2@UiO-66-SO3H 对Co(Ⅱ)的吸附热力学参数Table 2 Thermodynamics parameter for Co(Ⅱ) adsorption on Fe3O4@SiO2@UiO-66-SO3H
2.3 Fe3O4@SiO2@UiO-66-SO3H的循环利用
c0=10 mg/L、t=24 h、初始pH=8.3、m=10 mg、T=298 K下,Fe3O4@SiO2@UiO-66-SO3H的循环再生性能示于图9,实验中采用0.1 mol/L硝酸作洗脱剂。由图9可知,Fe3O4@SiO2@UiO-66-SO3H循环使用5次后,平衡吸附量从60 mg/g下降至48 mg/g,可能是因为包裹在Fe3O4@SiO2表面的UiO-66-SO3H有微量脱落以及多次循环吸附后Fe3O4@SiO2@UiO-66-SO3H的量略有减少所致。
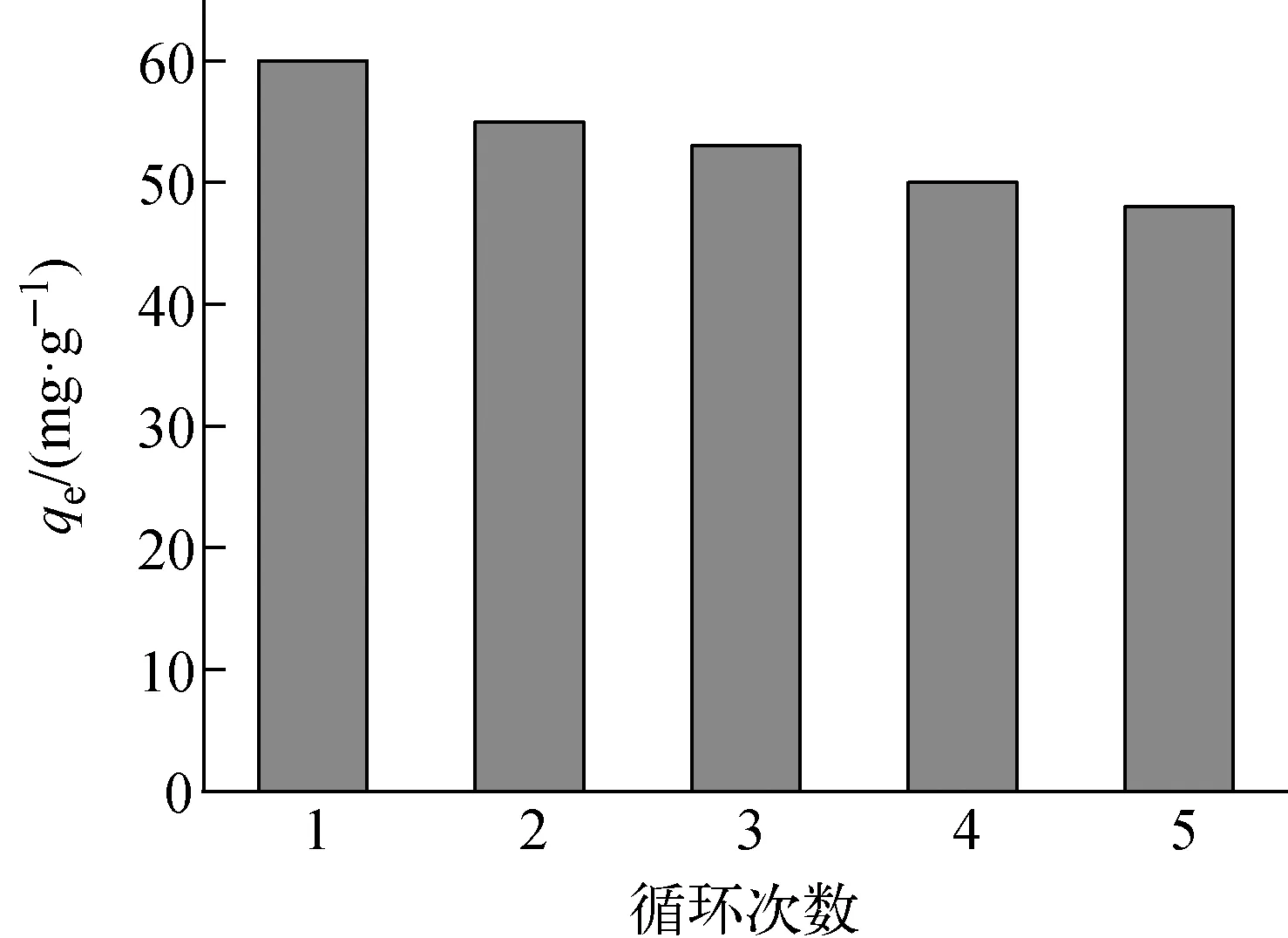
图9 Fe3O4@SiO2@UiO-66-SO3H的循环再生性能Fig.9 Recycling performance of Fe3O4@SiO2@UiO-66-SO3H
2.4 吸附机理
Fe3O4@SiO2@UiO-66-SO3H吸附Co(Ⅱ)前后的XPS扫描全谱和元素分谱示于图10a、b。由图10a、b可知,Co(Ⅱ)被成功吸附到Fe3O4@SiO2@UiO-66-SO3H上。
Fe3O4@SiO2@UiO-66-SO3H吸附前后S的2p谱示于图10c。由图10c可见,吸附后结合能由168.2 eV变为168.4 eV,表明磁性MOFs材料中磺酸基中的S与Co发生了配位反应[19]。169.8 eV处是2-环己胺基乙磺酸中的S[20],表明一定量的2-环己胺基乙磺酸被吸附在此吸附剂上。综上所述,整个吸附过程是一种配位效应,主要结合位点是磁性Fe3O4@SiO2@UiO-66-SO3H上的S原子。

a——XPS扫描全谱;b——Co 2p 谱;c——S 2p 谱图10 Fe3O4@SiO2@UiO-66-SO3H吸附前后的XPS谱Fig.10 XPS spectra of Fe3O4@SiO2@UiO-66-SO3H before and after adsorption
3 结论
1) 通过水热法成功将磺酸基功能化的MOFs材料UiO-66-SO3H与SiO2包裹的磁基体Fe3O4相结合,制得磁性MOFs材料Fe3O4@SiO2@UiO-66-SO3H。
2) FT-IR、XRD、SEM、BET、VSM等的表征结果表明,所制得的Fe3O4@SiO2@UiO-66-SO3H具有高比表面积、磺酸基官能团、多孔结构、超顺磁性、高稳定性。
3) Fe3O4@SiO2@UiO-66-SO3H对Co(Ⅱ)吸附效果明显,在c0=25 mg/L、t=24 h、温度298 K、初始pH=8.3、m=10 mg下,平衡时吸附量为92 mg/g;Fe3O4@SiO2@UiO-66-SO3H对Co(Ⅱ)的吸附符合准二级动力学模型和Langmiur模型,属于自发的吸热过程;XPS分析证明,吸附剂对Co(Ⅱ)优异的吸附能力主要归因于配位效应。因此,Fe3O4@SiO2@UiO-66-SO3H作为一种磁性吸附材料,具有良好的吸附性能,易于利用外加磁场实现Co(Ⅱ)吸附后的固-液分离。
