利用扩增子测序技术分析不同红茶菌中微生物多样性
2021-10-09黎琪王晴檀馨悦李晓敏张晓琳
黎琪,王晴,檀馨悦,李晓敏,张晓琳*
1(中粮营养健康研究院有限公司,北京,102209)2(营养健康与食品安全北京市重点实验室,北京,102209)3(老年营养食品研究北京市工程实验室,北京,102209)
红茶菌是一种由多种细菌和酵母菌组成的共生菌群发酵糖茶水而成的传统发酵饮品[1]。红茶菌酸甜可口,被报道具有保护肝脏、抗氧化、抗菌和抗癌等诸多健康功效[2-3],最新研究发现红茶菌还能通过激活调节性T细胞和Th2细胞改善实验性自身免疫性脑脊髓炎[4]。据报道,红茶菌最早出现在我国秦朝,后逐渐传入日本、德国等地,近年来,全球多家饮料巨头已涉足红茶菌饮品市场,发展前景十分广阔。红茶菌的生产起初仅以红茶或绿茶为底料,后来陆续有乌龙茶、黑茶和茉莉花茶等茶叶作为底料的研究,其所用糖类一般以蔗糖为主,众多学者在红茶菌发酵生产中加入蔬果汁或中草药以丰富红茶菌饮品的风味和健康功效[5]。目前我国市场上出现的红茶菌饮品,风味与传统红茶菌相比仍有一定差距,这主要因为传统红茶菌复杂的菌群结构[6],促进了其丰富独特风味的形成[7-8],而工业化生产为了保证产品品质稳定,通常选择一种或者几种常见食品用于菌种复配发酵,难以产生传统红茶菌的特殊风味。因此,研究红茶菌中微生物多样性,探究菌群与风味之间的关联性,对于红茶菌产品的开发和工业化生产至关重要。
目前对于红茶菌中微生物的研究主要分为培养依赖分析法和非培养依赖分析法[9]。扩增子测序技术作为非培养依赖分析法的一种,利用保守区设计通用引物进行PCR扩增,然后对高变区进行测序[10-11],通过相关分析获得样品中微生物的物种组成、物种丰度、系统进化和群落比较等诸多信息[12]。本研究采用扩增子测序技术对11个红茶菌样品中微生物多样性进行分析,结合感官评价结果,以期挖掘红茶菌中风味相关的优势菌群,为开发适用于标准化、工业化生产红茶菌饮品的发酵菌剂提供基础数据。
1 材料与方法
1.1 材料与试剂
红茶菌样品包括10个国内样品和1个国外样品,具体信息见表1。
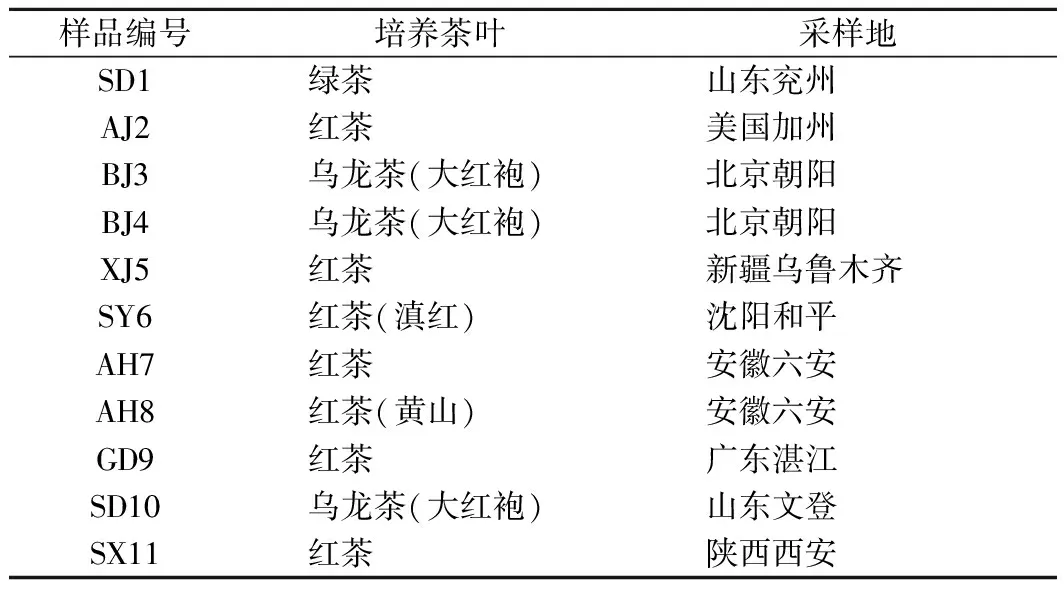
表1 红茶菌样品基本信息Table 1 Basic information of kombucha samples
茶叶和白砂糖均购自电商;DNA抽提试剂盒,美国MP Biomedicals公司;2%琼脂糖凝胶,西班牙Biowest公司;FastPfu DNA Polymerase,北京全式金生物技术有限公司;AxyPrep DNA凝胶回收试剂盒,美国AXYGEN公司;TruSeqTMDNA样本制备试剂盒,美国Illumina公司。
1.2 仪器与设备
ME3002E型分析天平、S210-K型pH计,美国梅特勒-托利多公司;LRH-250F型生化培养箱,上海一恒科学仪器有限公司;DK-8D型电热恒温水槽,上海精宏实验设备有限公司;NanoDrop2000型分光光度计,美国Thermo公司;ABI GeneAmp®9700型PCR仪,美国ABI公司;MISEQ测序仪,美国Illumina公司。
1.3 实验方法
1.3.1 红茶菌饮品的制备和感官评价方法
将11个红茶菌样品分别以10%接种量接种至糖茶水(0.5%茶叶、8%白砂糖)中,于30 ℃恒温培养箱中培养至发酵液pH<3.2后,发酵液经过滤和巴氏灭菌处理制得红茶菌饮品。饮品经冷藏后分装至一次性透明塑料小品评杯中,隐去样品代表性信息,由15位具有食品专业背景的人员(年龄23~46岁、男∶女=8∶7),在食品实验室中按表2对红茶菌饮品进行感官评分,不同样品之间使用纯净水漱口以减少误差。

表2 红茶菌饮品感官评价标准Table 2 Sensory evaluation criteria for kombucha beverages
1.3.2 DNA提取、PCR扩增和测序
按照DNA抽提试剂盒说明书进行总DNA提取,检测DNA浓度和纯度,利用1%琼脂糖凝胶电泳检测DNA质量。细菌用338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTC-TAAT-3′)引物进行PCR扩增,真菌用SSU0817F(5′-TTAGCATGGAATAATRRAATAGGA-3′)和SSU1196R(5′-TCTGGACCTGGTGAGTTTCC-3′)引物进行PCR扩增;引物扩增程序为:95 ℃ 预变性3 min,35个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s),最后72 ℃延伸10 min;扩增体系为20 μL,其中4 μL 5×FastPfu缓冲液,2 μL 2.5 mmol/L dNTPs, 0.8 μL 引物(5 μmol/L),0.4 μL FastPfu聚合酶;10 ng DNA模板。使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA凝胶回收试剂盒进行纯化,根据Illumina MiSeq 平台标准操作规程将纯化后的扩增片段构建PE 2×300的文库,利用Illumina公司的Miseq PE300平台进行测序。
1.3.3 数据处理
首先对原始测序数据进行过滤处理得到有效数据,然后基于有效数据进行操作分类单元(operational taxonomic unit,OTU)聚类,选取OTU的代表性序列,与核糖体RNA数据库(Greengenes Database 13.8版本)进行比对获得物种注释信息。基于数据均一化后的OTU物种丰度谱,利用qiime2 diversity软件评估样品的Alpha多样性。
2 结果与分析
2.1 红茶菌饮品感官评价结果
统计色泽、气味、滋味和整体喜好度评分平均分,除气味评分最高样品为GD9外,其他项目评分最高均为样品AH7,评分最低均为样品SY6(表3)。按对应权重计算最终得分,并根据得分将样品分为好(100~85分)、中(84~70分)和差(69分及以下)3组,用于后文基于感官评价的微生物聚类分析。

表3 红茶菌饮品感官评价结果Table 3 Sensory evaluation results of kombucha beverages
2.2 红茶菌中DNA提取与定量
提取新鲜红茶菌菌膜及菌液混合物的DNA,测定其质量与纯度,样品中DNA的OD260nm/OD280nm值为1.72~2.41,OD260nm/OD230nm值为0.01~0.05,其质量浓度为0.10~7.50 ng/μL(表4)。OD260nm/OD280nm值>1.8表示DNA纯度高,OD260nm/OD230nm值<2.0表明样品可能受到盐类和有机物等污染。经PCR扩增,产物目的条带均大小正确,浓度合适,可进行后续试验。
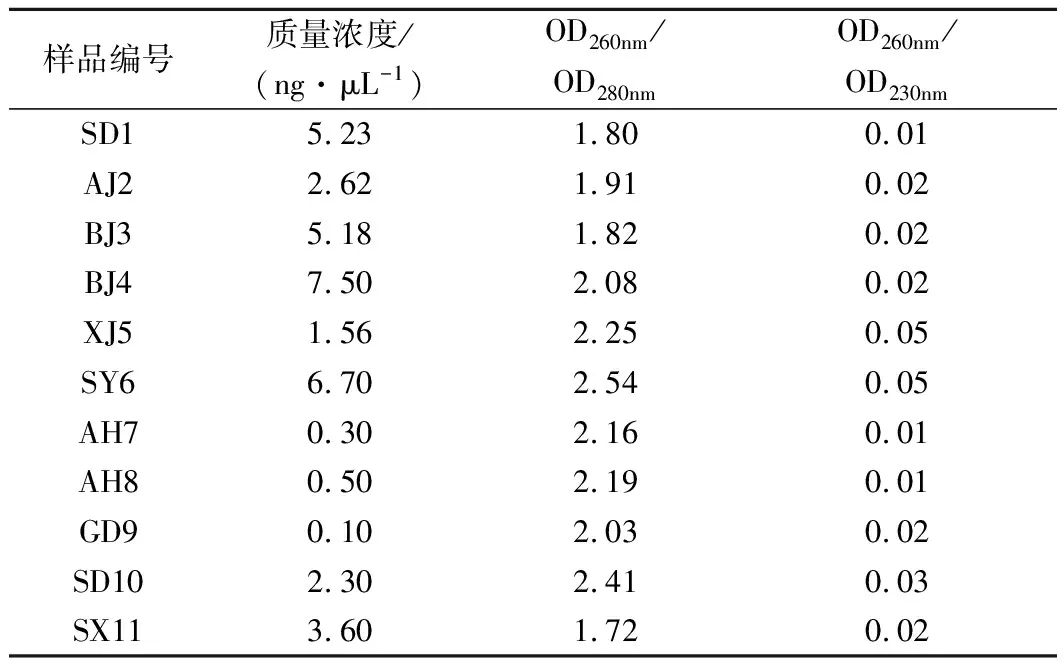
表4 红茶菌样品DNA质量浓度分析Table 4 DNA concentration analysis of kombucha samples
2.3 Alpha多样性分析
Alpha多样性指数用于研究环境样品中微生物的多样性,包括Shannon指数、Simpson指数、Chao1指数和覆盖度。Shannon指数值越高,Simpson指数值越低,表示微生物多样性越丰富。Chao1指数主要用于衡量样本中的微生物种类丰富度,其数值越大,表示微生物种类越多。覆盖度是指各样本中低丰度OTU的覆盖情况,其数值越高,则样本中序列被测出的概率越高[13-14]。
如表5所示,就细菌而言,样品GD9和SD10的Shannon指数值较高、Simpson指数值较低,表明这2个样品细菌OTU多样性水平较高。Chao1指数值较高的样品为BJ4、SY6、AH8、GD9和SD10,表明这些样品细菌OTU种类较多,样品AJ2的Chao1指数值最低,表明其细菌OTU种类较少。就真菌而言,样品BJ3、BJ4 和AH7的Shannon指数值较高、Simpson指数值较低,表明这3个样品真菌OTU多样性水平较高。Chao1指数值较高的样品为XJ5、BJ4、SY6、AH7和SX11,表明这些样品真菌OTU种类较多,样品SD1的Chao1指数值最低,表明其真菌OTU种类较少。表5中覆盖度数值均为1.00,说明测序已经较大程度覆盖低丰度OTU,表明本次测序结果可以代表样本中细菌和真菌的真实情况。
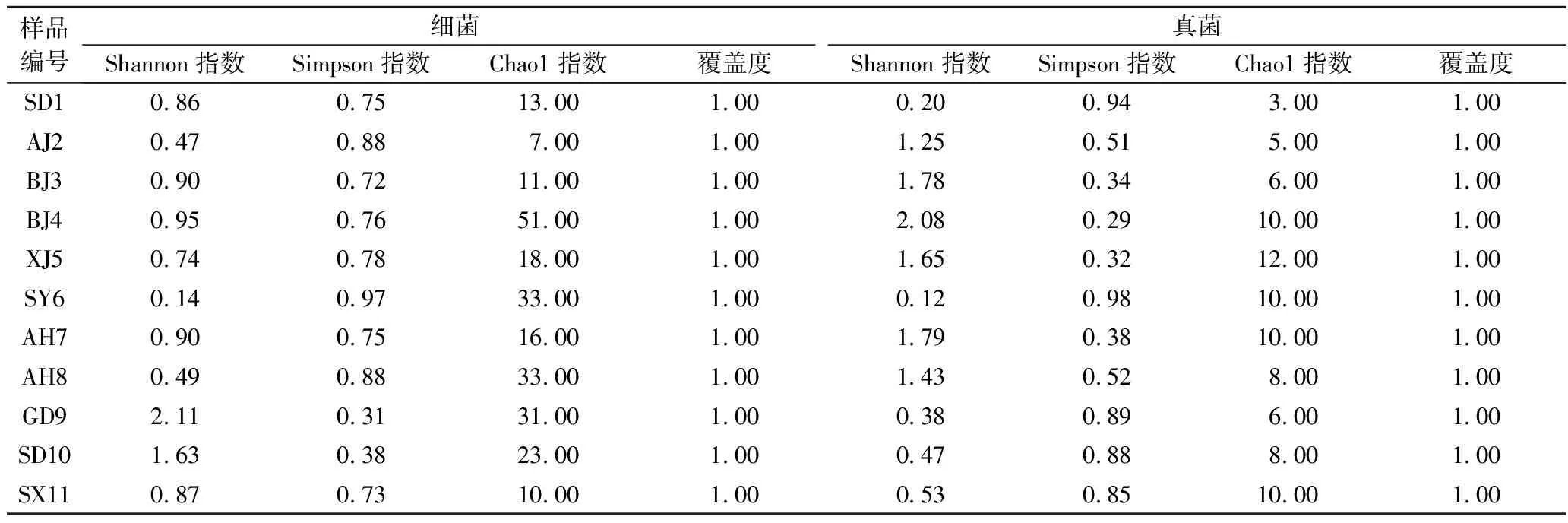
表5 样品细菌和真菌多样性指数Table 5 Microbial α-diversity index of kombucha samples
2.4 红茶菌中细菌群落结构分析
2.4.1 物种组成
在门水平上,样品中共出现9个门,包括8个已知门:变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、梭杆菌门(Fusobacteria)、绿菌门(Chlorobi)、绿弯菌门(Chloroflexi)、疣微菌门(Verrucomicrobia)和放线菌门(Actinobacteria),1个未鉴定。所有样品中变形菌门均占优势,相对丰度占98.92%以上,其中样品AJ2和SX11达100%。厚壁菌门存在于9个样品中,拟杆菌门存在于5个样品中,两者相对丰度占比最高的均为样品BJ4,分别为0.25%和0.76%。表明样品BJ4较其他样品在门水平上的细菌种类更为丰富。
在属水平上,样品共出现74个属,其中相对丰度排名前20的属如图1所示。所有样品的优势菌属一致,均为葡糖醋杆菌属(Gluconacetobacter),在样品SY6中相对丰度最高为99.56%。虽然各样品优势菌属一致,但相对丰度第2的菌属表现不同,除样品SY6外,仅样品SD10相对丰度第2的菌属(10.5%)为葡糖杆菌属(Gluconobacter),其余样品均为假单胞菌属(Pseudomonas),并且占比差异较大,在样品GD9中占比最高(13.91%),在样品AJ2中占比最低(2.62%)。在样品SD10中相对丰度第3(1.24%)的菌属为假单胞菌属,在样品AH7、AH8和SX11中相对丰度第3的菌属均为葡糖杆菌属,在样品SD1、XJ5和GD9中相对丰度第3的菌属都是罗尔斯通菌属(Ralstonia)。另外,红球菌属(Rhodococcus)、拟杆菌属(Bacteroides)、副拟杆菌属(Parabacteroides)、芽孢杆菌属(Bacillus)、葡萄球菌属(Staphylococcus)、乳杆菌属(Lactobacillus)、瘤胃球菌属(Ruminococcus)、硫杆菌属(Thiobacillus)、Sulfurimonas、Odoribacter和Herminiimonas在部分样品中少量出现。
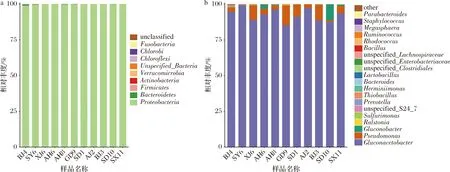
a-门水平;b-属水平图1 不同红茶菌样品中细菌在门水平和属水平上的相对丰度Fig.1 Relative frequency of bacteria in different kombucha samples at phylum and genus levels
2.4.2 基于感官评价的物种分析
对3组不同感官评价样品中细菌组成进行分析(图2),细菌种类139种,共有物种12个,包括葡糖醋杆菌属的3个种(总序列数和为377 693)、假单胞菌属的3个种(总序列数和为22 740)、葡糖杆菌属的1个种(序列数为6 338)、罗尔斯通菌属的1个种(序列数为618)、unspecifiedSulfurimonas(序列数223)、unspecifiedHerminiimonas(序列数为140)、unspecifiedOdoribacter(序列数为19)和普雷沃菌属(Prevotella)的1个种(序列数为16)。感官评价为好的组特有细菌种类有41个,其中葡糖醋杆菌属相对丰度最高(89.75%),假单胞菌属次之(5.85%);评价为中的组特有细菌种类有9个,其中葡糖杆菌属相对丰度最高(71.76%);评价为差的组特有细菌种类有62个,其中普雷沃菌属相对丰度最高(22.78%)。
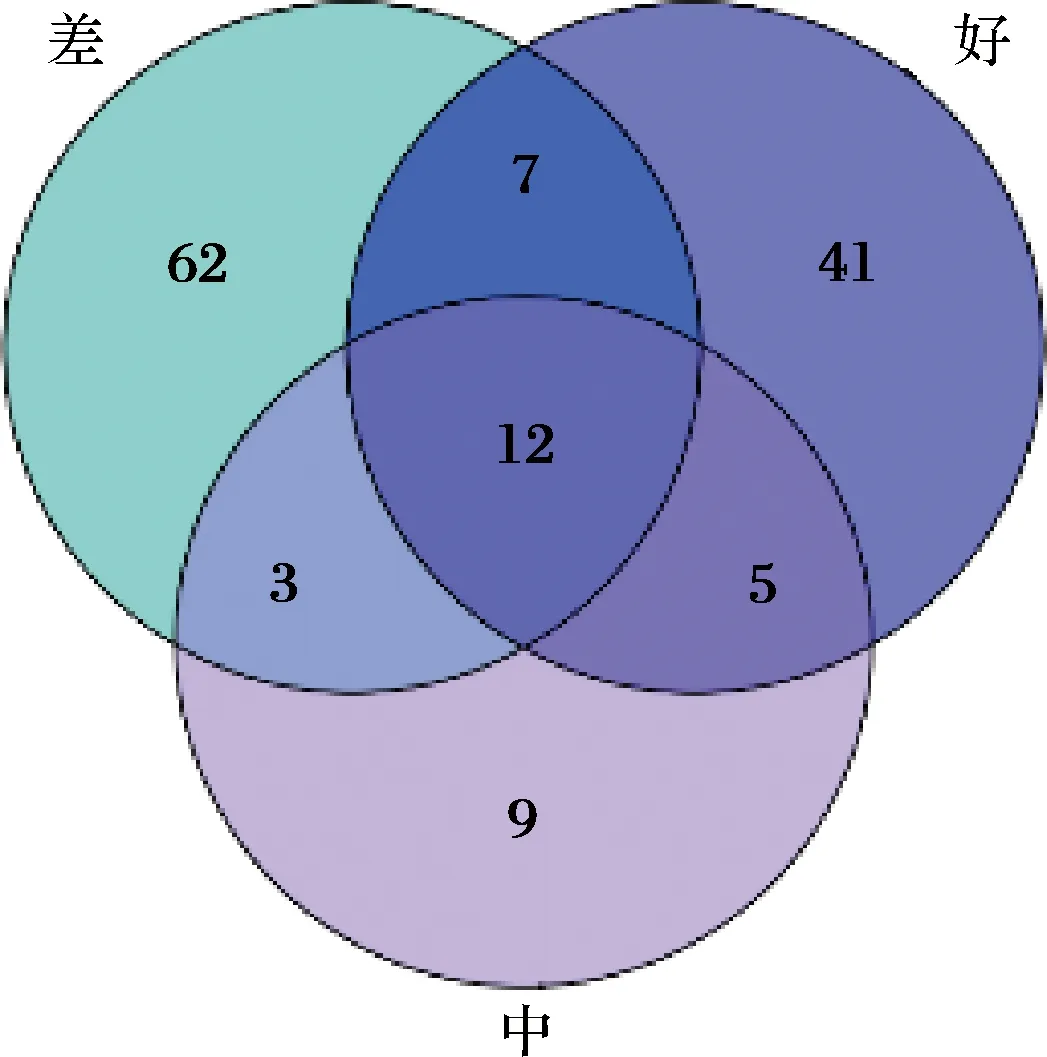
图2 不同感官评价分组中共有和特有细菌物种韦恩图Fig.2 Venn diagram of common and endemic bacterial species based on sensory evaluation
3组不同感官评价分组(图3)中unspecifiedGluconacetobacter丰度均最高,且差别不大,其次为居间葡糖醋杆菌(Gluconacetobacterintermedius)、假单胞菌属的2个种、unspecifiedRalstonia和unspecifiedGluconobacter,表明unspecifiedGluconacetobacter是构成各分组红茶菌细菌的绝对优势菌种。MARSH等[15]研究发现在大多数红茶菌样品中葡糖醋杆菌属占比达85%以上,与本文研究结果一致。葡糖醋杆菌属是产生有机酸的重要菌种,能促进醇类和酯类等芳香物质的形成[16-17]。结合红茶菌样品中细菌特有物种分析,表明葡糖醋杆菌属的某些种可促进红茶菌独特风味物质的形成。王洁琛等[18]从红茶菌样品中分离的优势细菌为居间驹形杆菌(Komagataeibacterintermedius),MUZAFFER等[19]利用宏基因组结合扩增子测序方法测得红茶菌发酵过程中不同时间点的优势细菌也为驹形杆菌属。根据图3结果表明居间葡糖醋杆菌(该菌中文名因分类原因更为居间驹形杆菌,本文便于统计分析暂用此名称)相对含量与红茶菌风味不呈相关性,但是红茶菌中较为重要的菌种。此外,假单胞菌属在一定范围内相对含量越高越好,unspecifiedRalstonia相当含量对红茶菌风味影响不大,unspecifiedGluconobacter相对含量适度增高可能利于好的风味物质形成,硫杆菌、红球菌、瘤胃球菌、拟杆菌、普氏菌和Enterobacteriaceae的出现会使红茶菌感官品质变差。

图3 不同感官评价分组细菌种类热图Fig.3 Heatmaps of bacteria based on sensory evaluation at species levels
2.5 红茶菌中真菌群落结构分析
2.5.1 物种组成
在门水平上,样品中共出现4个门,包括子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、Mucoromycota和线虫门(Nematoda)(图4)。所有样品中优势菌门为子囊菌门,均占99.45%以上,其中样品AH8、AJ2、GD9、SD1和SD10达100%,较优势的菌门为担子菌门,存在于5个样品中,其中样品SY6相对丰度最高为0.50%。表明样品SY6较其他样品在门水平上的真菌物种更为丰富。仅存在样品SX11中的线虫门相对丰度极低,不足0.01%。单齿类线虫(Nematoda Mononchida)为捕食性线虫,常用于植物生物防治[20],因红茶菌样品中含有茶叶成分,推测可能由茶叶原料带入。
在属水平上,样品共出现38个属,其中相对丰度排名前20的属如图4所示。各样品优势菌属均不一致,其中样品AH7、AH8、AJ2、BJ3和XJ5的优势菌属为酒香酵母属(Brettanomyces),相对丰度为40%~75%;样品SD1、SD10、SX11和SY6的优势菌属为接合酵母属(Zygosaccharomyces),相对丰度均达95%以上;样品BJ4和GD9的优势菌属为假丝酵母属(Candidas),相对丰度分别为40.54%和97.40%。各样品相对丰度第2的菌属也表现不同,包括上述3种菌属以及酵母目(Saccharomycetales),其中酵母目作为相对丰度第2出现的样品数量最多。所有样品中,除样品BJ4(96.88%)外,其他样品中存在的接合酵母属、假丝酵母属、酒香酵母属和酵母目相对丰度之和均在99%以上,其中样品SD1仅含有接合酵母属,样品SY6含菌属种类最多。表明接合酵母属、假丝酵母属、酒香酵母属和酵母目共为红茶菌样品的优势酵母。另外,毕赤酵母属(Pichia)、粗糙孔菌属(Trechispora)、马拉色菌属(Malassezia)、镰刀菌属(Fusarium)、锁霉属(Itersonilia)和枝孢菌属(Cladosporium)等也在部分样品中少量出现。
2.5.2 基于感官评价的物种分析
对3组不同感官评价样品中真菌组成进行分析(图5),真菌种类38种,共有物种6个,包括接合酵母属的1个种(序列数为149 574)、酒香酵母属的2个种(总序列数和为132 427)、假丝酵母属的1个种(序列数为74 445)、酵母目的1个种(序列数为40 128)和肉座菌目(Hypocreales)的1个种(序列数为584)。感官评价为好的组特有真菌种类有6个,其中假丝酵母属相对丰度最高(46.20%),接合酵母属次之(19.88%);评价为中的组特有真菌种类有7个,其中接合酵母属相对丰度最高(68.48%),酒香酵母属次之(29.17%);评价为差的组特有真菌种类有12个,其中毕赤酵母属相对丰度最高(48.24%),酒香酵母属次之(35.13%)。
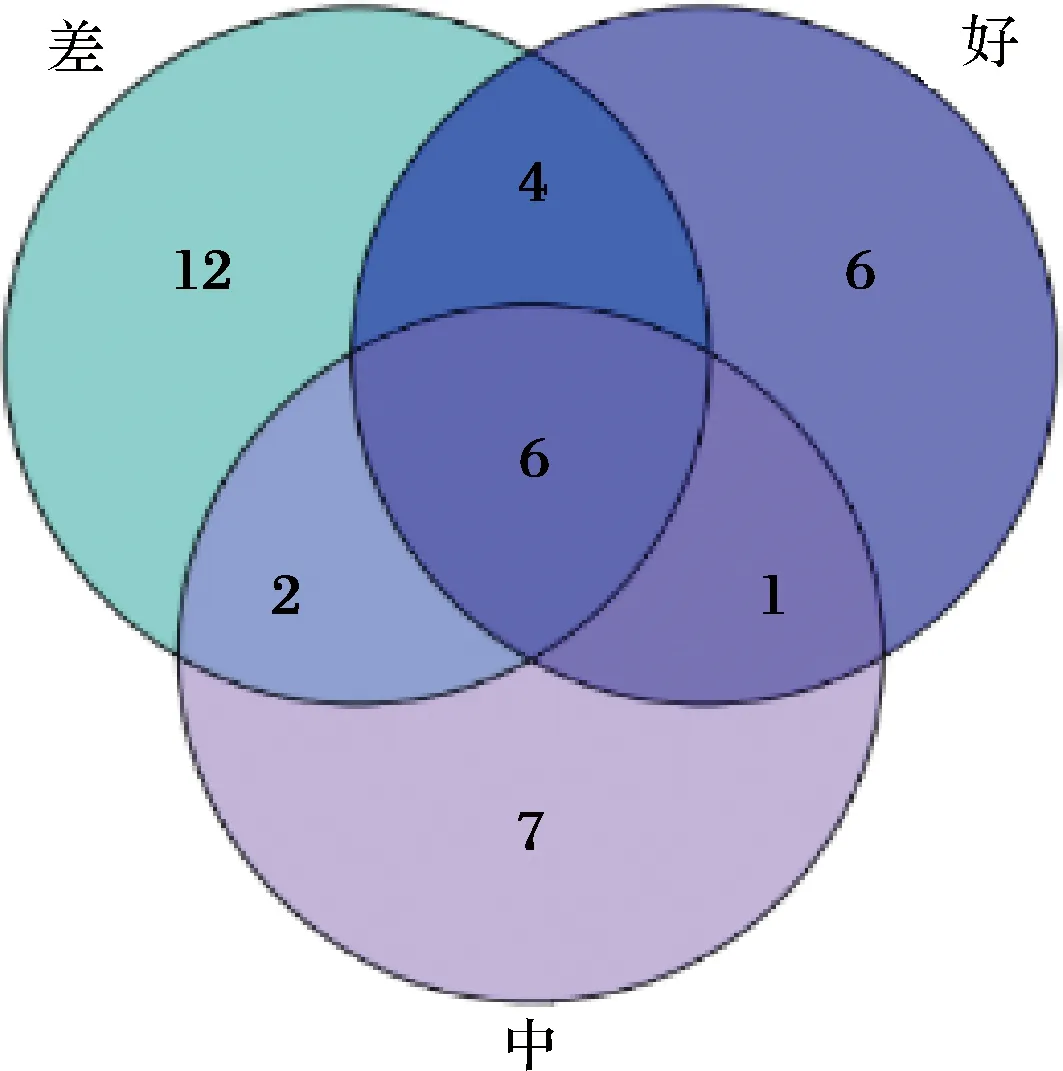
图5 不同感官评价分组中共有和特有真菌物种韦恩图Fig.5 Venn diagram of common and endemic fungus species based on sensory evaluation
3组不同感官评价分组(图6)中unspecifiedZygosaccharomyces丰度最高,其次为unspecifiedBrettanomyces、unspecifiedCandida、酵母目的1个种、肉座菌目的1个种。表明接合酵母属和酒香酵母属是构成红茶菌中酵母的优势菌属,其次是假丝酵母属和酵母目。MARSH等[15]研究发现大多数红茶菌样品中接合酵母属占比达95%以上,王洁琛等[18]也从红茶菌样品中分离出二孢接合酵母(Zygosaccharomycesbisporus),ARIKAN等[19]同样发现红茶菌中优势真菌为接合酵母属,与本文研究样品SD1、SD10、SX11和SY6优势真菌表现一致。TRAN等[21]从红茶菌样品中分离出酒香酵母和有孢汉逊酵母(Hanseniaspora),苏家跃等[22]从红茶菌样品中分离出异酒香酵母(Brettanomycesanomalus),蒋立文[23]与林娟等[24]皆在红茶菌样品中分离出假丝酵母,表明不同来源红茶菌样品优势酵母种类差异较大。根据图6可以初步推测假丝酵母属与接合酵母属适当比例混用能促进红茶菌好的风味物质形成,高水平的酒香酵母属和毕赤酵母都会使红茶菌风味变差。檀馨悦等[16]总结发现复配多种非酿酒酵母可提高红茶菌风味的丰富程度,WANG等[25]混菌发酵制备的红茶菌与传统菌膜的风味相近,因此,利用适当比例混合优势酵母发酵有助于标准化生产味道更接近传统风味的红茶菌饮品。此外,肉座菌目在一定范围内相对含量越低越好,毕赤酵母、球囊菌、粗糙孔菌、牛肝菌、曲霉镰刀菌和枝孢菌的出现会使红茶菌感官变差。
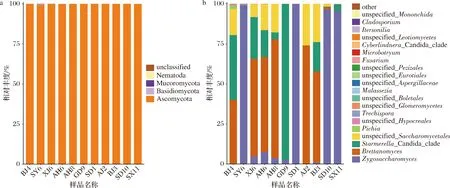
a-门水平;b-属水平图4 不同红茶菌样品中真菌在门水平和属水平上的相对丰度Fig.4 Relative frequency of fungus in different kombucha samples at phylum and genus levels
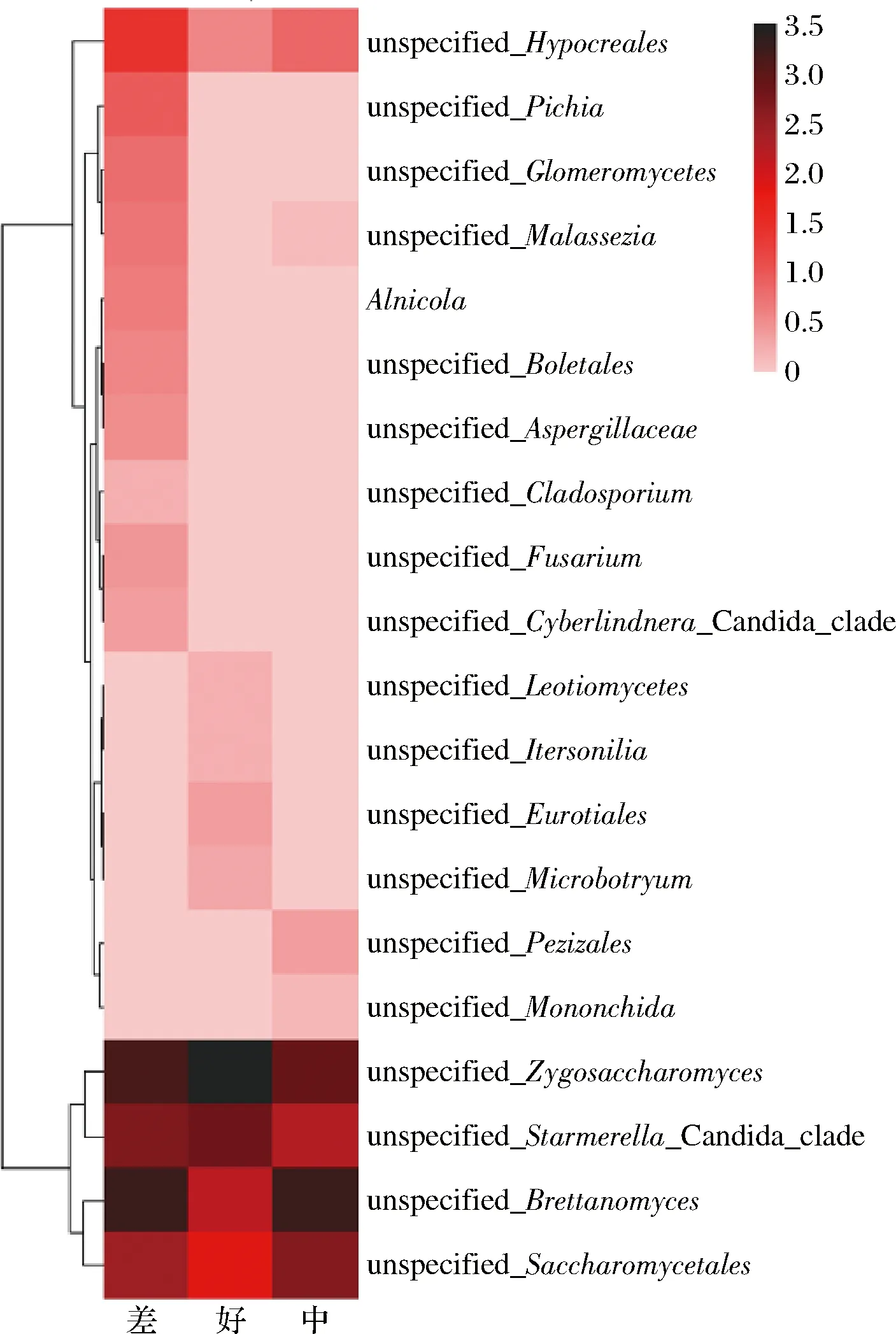
图6 不同感官评价分组真菌物种热图Fig.6 Heatmaps of fungus based on sensory evaluation at species levels
3 结论
通过扩增子测序技术对11个红茶菌样品中的微生物多样性进行分析,确定不同红茶菌样品中优势细菌为葡糖醋杆菌属(相对丰度为85.40%~99.56%),其次为假单胞菌属(相对丰度为<14%);优势真菌种类差异较大,样品SD1、SD10、SX11和SY6中优势菌属为接合酵母属(相对丰度为95.43%~99.99%),样品BJ4和GD9中优势菌属为假丝酵母属(相对丰度为40.54%和97.40%),样品AH7、AH8、AJ2、BJ3和XJ5中优势菌属为酒香酵母属(相对丰度为54.81%~74.09%)。
基于感官评价对微生物种类进行聚类分析发现,非优势细菌和优势真菌会不同程度地影响红茶菌的风味。细菌中假单胞菌属与红茶菌的风味呈相关性,假单胞菌属在一定范围内相对含量越高风味越佳。真菌中接合酵母属与假丝酵母属水平相对偏高,酒香酵母属与酵母目水平相对偏低有利于红茶菌良好风味的形成。硫杆菌、红球菌、瘤胃球菌、拟杆菌、普氏菌和Enterobacteriaceae等细菌,毕赤酵母、球囊菌、粗糙孔菌、牛肝菌、曲霉镰刀菌和枝孢菌等真菌的少量出现都会使红茶菌风味变差。
综上所述,利用葡糖醋杆菌和接合酵母、酒香酵母等多种非酿酒酵母混菌发酵,并严格控制过程微生物污染,可能有助于稳定生产接近于传统红茶菌风味的饮品,为工业化生产红茶菌饮品提供理论依据。
