风热清口服液对免疫低下小鼠免疫调节作用的研究
2021-09-28欧凯西刘捷张缘周子意赵玉民余成浩
欧凯西 刘捷 张缘 周子意 赵玉民 余成浩


摘要 目的:探究风热清口服液对免疫低下小鼠免疫调节的作用。方法:通过给小鼠腹腔注射免疫抑制剂环磷酰胺50 mg/kg,1次/d,连续3 d,建立免疫功能低下的动物模型。应用碳廓清实验、溶血素生成实验和迟发型变态反应,评价风热清口服液对免疫低下小鼠非特异性免疫、體液免疫和细胞免疫的调节作用。结果:风热清口服液低、中剂量组可不同程度提高环磷酰胺致免疫低下小鼠的廓清指数K值(P<0.05)和吞噬指数α值(P<0.05)。风热清口服液低、中、高剂量组可不同程度提高免疫低下小鼠血清溶血素水平(P<0.05)。风热清口服液低、中剂量组可不同程度促进免疫低下小鼠迟发型变态反应(P<0.05)。风热清口服液低剂量组可提高免疫低下小鼠脾脏中CD4+细胞数(P<0.01),并使CD4+/CD8+细胞比值上升(P<0.001),同时抑制免疫低下小鼠脾脏中CD8+细胞数(P<0.05);风热清口服液中、高剂量组可提高免疫低下小鼠脾脏中CD4+/CD8+细胞比值(P<0.01),同时抑制免疫低下小鼠脾脏中CD8+细胞数(P<0.05)。风热清口服液低、中剂量组可显著提高免疫低下小鼠脾指数(P<0.001),风热清口服液低、中、高剂量组均可提高免疫低下小鼠胸腺指数(P<0.05或P<0.01)。结论:风热清口服液通过提高免疫低下小鼠非特异性免疫、体液免疫和细胞免疫,进而增强免疫低下小鼠的免疫功能。
关键词 风热清口服液;非特异性免疫;体液免疫;细胞免疫;免疫调节;免疫低下小鼠
Study on Immunomodulatory Property of Fengreqing Oral Liquid on Immunosuppressive Mice
OU Kaixi1,2,LIU Jie1,2,ZHANG Yuan1,2,ZHOU Ziyi1,2,ZHAO Yumin1,2,YU Chenghao1,2
(1 Basic Medical College,Chengdu University of Traditional Chinese Medicine,Chengdu,611137,China; 2 State Key Laboratory of Southwestern Chinese Medicine Resources,Chengdu 611137,China)
Abstract Objective:To study the immunomodulatory activity of Fengreqing Oral Liquid on immuno-suppressive mice.Methods:Through intraperitoneal injection of 50 mg/kg immunosuppressant cyclophosphamide into mice,once a day for 3 consecutive days,an animal model of immunocompromised function was established.Carbon clearance test,quantitative hemolysis test and DNFB induced delayed-type hypersensitivity(DTH) were applied to assay the regulating effects of Fengreqing Oral Liquid on nonspecific immunity,humoral immunity and cellular immunity in immunocompromised mice.Results:The clearance index K(P<0.05) and values of phagocytic index α(P<0.05) of cyclophosphamide-induced immunocompromised mice could be elevated to varying degrees by Fengreqing Oral Liquid low and medium dose group.Productions of HClgM in serum were enhanced in different extent in immunosuppressive mice by Fengreqing Oral Liquid low,medium and high dose groups(P<0.05).Fengreqing Oral Liquid low and medium dose group variously increased DTH reactivity in immunosuppressive mice(P<0.05).Fengreqing Oral Liquid low dose group can not only increased percentages of T cells expressing CD4+(P<0.01) in the spleen of immunocompromised mice,but also enhanced the ratio of CD4+/CD8+ cells(P<0.001).And Fengreqing Oral Liquid low dose group suppressed percentages of T cells expressing CD8+(P<0.05) in the spleen of immunocompromised mice.Fengreqing Oral Liquid medium and high dose group enhanced the ratio of the two subset of T lymphocyte(P<0.01),while suppressed percentages of T cells expressing CD8+(P<0.05).Fengreqing Oral Liquid low and medium dose group obviously increased spleen index in immunosuppressive mice(P<0.001).Fengreqing Oral Liquid low,medium and high dose group all increased thymus index in immunosuppressive mice(P<0.05 or P<0.01).Conclusion:Fengreqing Oral Liquid enhances the immune function of immunocompromised mice by improving non-specific immunity,humoral immunity and cellular immunity of immunocompromised mice.
Keywords Fengreqing Oral Liquid; Nonspecific immunity; Humoral immunity; Cellular immunity; Immunoregulation; Immunosuppressive mice
中图分类号:R285.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.17.013
风热清口服液由“桔梗汤”和“青黛饮”两方加上熊胆粉构成[1],方中含金银花、青黛、熊胆粉、瓜蒌皮、桔梗、甘草,用来治疗外感风热所致的发热、微恶风寒、头痛、咳嗽、流涕、口渴、咽痛,以及急性上呼吸道感染见上述症状者。前期研究发现,风热清口服液有抗炎镇痛等作用,而炎症与免疫有着密不可分的联系。因此,本实验用环磷酰胺建立免疫力低下小鼠模型,并通过碳廓清实验、溶血素生成实验和迟发型变态反应(Delayed Type Hypersensitivity,DTH),进一步探究风热清口服液对免疫功能低下小鼠的免疫调节作用,为风热清口服液临床运用提供依据。
1 材料与方法
1.1 材料
1.1.1 动物 SPF级昆明种小鼠168只,雌雄各半,体质量18~22 g,由斯贝福(北京)生物技术有限公司提供,实验动物生产许可证号:SCXK(京)2019-0010,饲养于成都中医药大学动物中心,温度维持在20~25 ℃,湿度维持在40%~70%。本实验已通过成都中医药大学实验动物伦理委员会审查(伦理学批号2020-13)。
1.1.2 药物 风热清口服液(四川省新鹿药业有限公司,生产批号:Z10950074);左旋咪唑(广东华南药业集团有限公司,生产批号:200601);环磷酰胺(Baxter Oncology GmbH公司,德国,生产批号:0C372A)。
1.1.3 试剂与仪器 印度墨汁(大连美仑生物有限公司,批号:D1223A);绵羊红细胞(Sheep Red Blood Cells,SRBC,平睿生物科技有限公司,批号:20201117);豚鼠血清(源叶生物科技有限公司,批号:H19N11Q131643);碳酸钠(天津市致远化学试剂有限公司,批号:2020050195);2,4-二硝基氟苯(1-fluoro-2,4-dinitrobenzene,DNFB,上海麦克林生化科技有限公司,批号:C11446846);单克隆抗体PE-CD8a(Invitrogen公司,美国,批号:25-0081-82);单克隆抗体FITC-CD4(Invitrogen公司,美国,批号:11-0041-82);单克隆抗体APC-CD3(Invitrogen公司,美国,批号:17-0032-82);电子天平(上海越平科学仪器制造有限公司,型号:FA2004B);酶标仪(BioTek公司,美国,型号:CYT5MFV);低温离心机(四川蜀科仪器有限公司,型号:TGL-17);流式细胞仪(Backman公司,美国,型号:CytoFLEX)。
1.2 方法
1.2.1 分组与模型制备
1.2.1.1 环磷酰胺诱导免疫低下小鼠碳廓清实验 选取昆明小鼠48只,雌雄各半。随机分为空白对照组、模型对照组、阳性对照组、风热清口服液高剂量组、风热清口服液中剂量组、风热清口服液低剂量组,每组8只。第3、4、5天除空白对照组小鼠外,均腹腔注射50 mg/kg环磷酰胺生理盐水溶液,注射容积为10 mL/kg,建立免疫力低下模型[2-3],并观察小鼠状态。
1.2.1.2 环磷酰胺诱导免疫低下小鼠血清溶血素生成的测定 取昆明小鼠60只,雌雄各半。随机分为空白对照组、模型对照组、阳性对照组、风热清口服液高剂量组、风热清口服液中剂量组、风热清口服液低剂量组,每组10只。第3天每只小鼠腹腔注射10%的SRBC 0.2 mL致敏,第3、4、5天除空白对照组小鼠外每只小鼠腹腔注射环磷酰胺50 mg/kg,制备免疫低下模型[2],并觀察小鼠状态。
1.2.1.3 DNFB诱导免疫低下小鼠DTH 取昆明小鼠60只,雌雄各半。随机分为空白对照组、模型对照组、阳性对照组、风热清口服液高剂量组、风热清口服液中剂量组、风热清口服液低剂量组,每组10只。第2天,每只小鼠腹部用8%硫化钠脱毛,面积3 cm×3 cm。第3天,于脱毛部位皮肤均匀涂抹1%的DNFB丙酮麻油溶液50 μL,第6天同剂量强化1次。除空白对照组外,其余小鼠均在第5、6、7天腹腔注射环磷酰胺50 mg/kg,制备免疫低下模型。第9天,将1%DNFB丙酮麻油溶液20 μL均匀涂抹于小鼠右耳正反两面[2-4]。
1.2.2 给药方法
1.2.2.1 环磷酰胺诱导免疫低下小鼠碳廓清实验 阳性对照组灌胃左旋咪唑药液(0.030 0 g/kg),风热清口服液高、中、低剂量组,分别灌胃风热清口服液20.050 0、10.025 0、5.012 5 g/kg浓度药液,空白对照组和模型组灌胃蒸馏水,给药体积10 mL/kg,1次/d,连续9 d。
1.2.2.2 环磷酰胺诱导免疫低下小鼠血清溶血素生成的测定 阳性对照组灌胃左旋咪唑药液(0.030 0 g/kg),风热清口服液高、中、低剂量组,分别灌胃风热清口服液20.050 0、10.025 0、5.012 5 g/kg浓度药液,空白对照组和模型组灌胃蒸馏水,给药体积10 mL/kg,1次/d,连续9 d。
1.2.2.3 DNFB诱导免疫低下小鼠DTH 阳性对照组灌胃左旋咪唑药液(0.030 0 g/kg),风热清口服液高、中、低剂量组,分别灌胃风热清口服液20.050 0、10.025 0、5.012 5 g/kg浓度药液,空白对照组和模型组灌胃蒸馏水,给药体积10 mL/kg,1次/d,连续10 d。
1.2.3 检测指标与方法
1.2.3.1 环磷酰胺诱导免疫低下小鼠碳廓清实验 末次给药1 h后,每只小鼠右眼内眦静脉丛注射20%的印度墨汁生理盐水溶液(10 mL/kg),2 min和10 min后分别从眼球取血40 μL并将其加到4 mL 0.1% Na2CO3溶液中,以正常小鼠血40 μL加到4 mL 0.1% Na2CO3溶液中做对照孔,600 nm波长测定吸光度OD值。取血后将小鼠颈椎脱臼处死,取动物肝、脾并称重,以下列公式计算廓清指数K值和吞噬系数α值:K=(logA1-logA2)/(t2-t1);α=3关节压痛数×体质量/(肝质量+脾质量),其中A1、A2分别表示2 min、10 min时吸光度值,t1表示2 min,t2表示10 min。
1.2.3.2 环磷酰胺诱导免疫低下小鼠血清溶血素生成的测定 第9天给药1 h后摘除眼球取血,将小鼠血离心后收集的血清作800倍稀释后,吸取0.5 mL稀释的血清放入另一试管中,并依次加入10% SRBC、10%豚鼠血清、生理盐水各0.5 mL,空白调零管用生理盐水代替血清,置37 ℃温箱温育30 min,冰浴10 min终止反应,1 000×g离心5 min,取上清液,用分光光度计在波长540 nm测OD值。计算溶血素水平(Hemolysin Concentration,HC)=样本稀释血清的OD值×稀释倍数。
1.2.3.3 DNFB诱导免疫低下小鼠DTH 小鼠右耳涂抹1%的DNFB丙酮麻油溶液24 h后将小鼠称重,随后脱臼处死小鼠,剪下左右耳郭,用打孔器取下直径8 mm的耳片并称重,耳郭肿胀度=右耳片重-左耳片重,同时摘取小鼠脾脏和胸腺,剔除旁边的筋膜和组织后称取湿质量,计算每只小鼠的免疫器官指数,计算公式:免疫器官指数=脏器质量(mg)/体质量(g)。将取出的脾脏称重后,迅速用机械法将小鼠脾脏组织处理成单细胞悬液,经300目滤布过滤后,加入PBS液将细胞浓度调整为106个/mL。取100 μL细胞悬液于流式管中,加入APC-CD3、FITC-CD4和PE-CD8a抗体各1 μg,混匀后4 ℃避光染色30 min。加入2 mL 4 ℃的PBS液,混匀,300×g离心5 min后弃上清液,加入400 μL的PBS液,立即流式细胞仪上机检测。
1.3 统计学方法 采用SPSS 25.0统计软件进行数据分析,计量资料用均数±标准差(±s)表示,数据比较采用单因素方差分析,组间两两比较,满足方差齐性检验者用LSD检验,不满足方差齐性检验者,转换数据后用秩和检验,以P<0.05为差异有统计学意义。
2 结果
2.1 风热清口服液对免疫低下小鼠碳粒廓清的影响 用环磷酰胺建立小鼠免疫力低下模型后,观察发现小鼠的进食量减少、体质量减轻、活动减少、易惊、掉毛、毛发光泽度降低。与模型组比较,风热清口服液低、中剂量组均能提高小鼠廓清指数K值(P<0.05),同时提高小鼠吞噬指数α(P<0.05)。见表1。
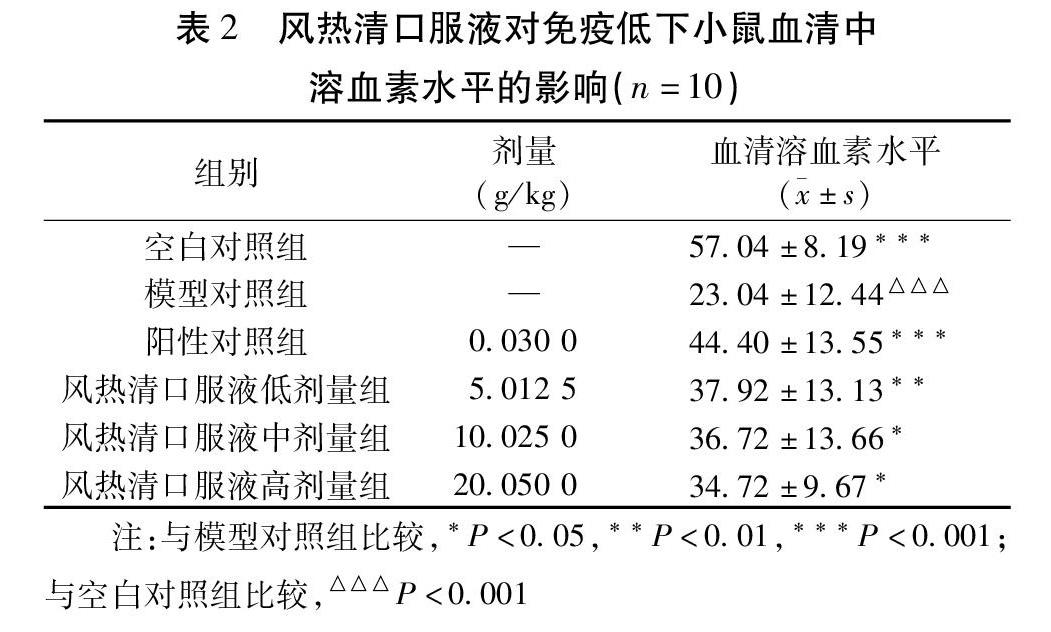
2.2 风热清口服液对免疫低下小鼠血清中溶血素含量的影响 小鼠血清中溶血素水平,模型对照组与空白对照组比较差异有统计学意义(P<0.001),风热清口服液低、中、高剂量组和模型对照组比较差异均有统计学意义(均P<0.05),风热清口服液能提高免疫低下小鼠血清中的溶血素水平。见表2。
2.3 风热清口服液对免疫低下小鼠DTH的影响 小鼠耳组织涂抹1%DNFB溶液24 h后,空白对照组小鼠与模型对照组小鼠耳肿胀度差异有统计学意义(P<0.001)。风热清口服液低剂量组与模型对照组小鼠耳肿胀度差异有统计学意义(P<0.01),风热清口服液中剂量组与模型对照组小鼠耳肿胀度差异有统计学意义(P<0.05)。风热清口服液低、中剂量组与模型组小鼠脾指数差异有统计学意义(P<0.001)。风热清口服液低、高剂量组与模型组小鼠胸腺指数差异有统计学意义(P<0.01),风热清口服液中剂量组与模型组小鼠胸腺指数差异有统计学意义(P<0.05)。见表3。
2.4 風热清口服液对免疫低下DTH小鼠T淋巴细胞亚群的影响 风热清口服液低剂量组与模型组小鼠脾脏中T淋巴细胞CD4+比较差异有统计学意义(P<0.01),风热清口服液低、中、高剂量组与模型组小鼠脾脏中T淋巴细胞CD8+比较均差异有统计学意义(P<0.05),风热清口服液低、中、高剂量组与模型组小鼠脾脏中T淋巴细胞CD4+/CD8+比值比较差异有统计学意义(P<0.01或P<0.001)。见表4,图1~2。
3 讨论
在机体的免疫系统中非特异性免疫是其关键组成部分,单核巨噬细胞的吞噬能力是衡量非特异性免疫功能的常用指标[5]。巨噬细胞是一种重要的免疫细胞,也是单核巨噬细胞系统的主要组成部分,在免疫应答和宿主防御中起着关键作用,其通过吞噬作用介导非特异性免疫反应,可通过细胞毒活性直接清除肿瘤、外部病毒、细菌甚至癌细胞[6]。同时,巨噬细胞受到刺激后能促进吞噬活性、调节各种细胞因子的分泌等[7]。小鼠碳廓清实验是反映非特异性免疫的经典实验方法,小鼠碳廓清实验中所测得的廓清指数K可反映网状内皮系统的吞噬功能,吞噬指数α则反映单核-巨噬细胞的吞噬能力[8-9]。实验结果说明,风热清口服液低、中剂量组能够提升环磷酰胺所致免疫低下小鼠廓清指数K及吞噬指数α,从而提示风热清口服液可以提高免疫低下小鼠巨噬细胞的吞噬功能,促进免疫低下小鼠的非特异性免疫功能。
SRBC致敏后小鼠血清溶血素水平的测定可作为体液免疫功能的评价指标[10]。淋巴细胞与SRBC抗原接触产生的一种特异性抗体血清溶血素,可使红细胞溶解,血清溶血素水平反映了淋巴细胞的增殖和分化水平,以及与体内特异性抗原SRBC接触后,淋巴细胞特异性抗体分泌到血液中的情况[11-12]。实验结果表明,风热清口服液低、中、高剂量组均能够提高环磷酰胺所致免疫低下小鼠血清溶血素水平,提示风热清口服液可以促进免疫低下小鼠的体液免疫功能。
DTH是由T细胞介导的免疫应答的一种类型,T淋巴细胞介导的DTH的强弱,是反映机体细胞免疫功能的敏感指标之一[13]。T淋巴细胞包括T辅助/诱导性T细胞(CD4+)和T抑制/细胞毒性T细胞(CD8+),是细胞免疫的重要效应细胞[14]。CD4+和CD8+T淋巴细胞的表达,可提示细胞免疫功能状态[15-16],当CD4+T淋巴细胞减少时,提示机体免疫功能下降,而CD8+可抑制B细胞CD4+功能,妨碍机体形成抗体,抑制产生细胞免疫应答,因此CD8+水平越高,免疫抑制越强;CD4+/CD8+比值则是反映机体T细胞免疫功能的重要指标之一,其比值越低,提示机体免疫功能越弱[17]。实验结果说明,风热清口服液低、中剂量组可增强环磷酰胺所致免疫低下小鼠耳肿胀度。并且风热清口服液低剂量组可显著提高免疫低下小鼠脾脏中T淋巴细胞CD4+和CD4+/CD8+比值,降低免疫低下小鼠脾脏中T淋巴细胞CD8+的水平,风热清口服中、高剂量组可显著提高免疫低下小鼠脾脏中T淋巴细胞CD4+/CD8+比值,降低免疫低下小鼠脾脏中T淋巴细胞CD8+的水平,提示风热清口服液可增强免疫低下小鼠的细胞免疫功能。
胸腺是中央免疫器官,是T淋巴细胞发育、分化和成熟的场所,脾脏是外周免疫器官,是成熟T、B淋巴细胞参与免疫应答的部位[18-19],在免疫激活过程中,免疫细胞的分化和增殖导致其体质量增加,胸腺指数和脾指数反映胸腺和脾的质量[20]。因此,胸腺和脾脏质量与免疫十分密切。胸腺指数和脾指数的降低意味着免疫细胞数量的减少和免疫功能的下降。实验结果表明,风热清口服液低、中剂量组可明显改善环磷酰胺所致免疫低下小鼠的脾指数,风热清口服液低、中、高剂量组均可改善环磷酰胺所致免疫低下小鼠的胸腺指数,从而增强免疫低下小鼠的免疫功能。
综上所述,风热清口服液可通过促进环磷酰胺所致免疫低下小鼠非特异性免疫、体液免疫及细胞免疫功能,以及对免疫器官脾脏和胸腺的保护,起到增强免疫低下小鼠的免疫功能的作用,但其具体机制尚不明确,待进一步研究验证。
参考文献
[1]吴锦.风热清口服液[J].中国新药杂志,1998,7(4):313-314.
[2]宋媛媛,周越,孙守兵,等.丁香苷对免疫功能低下小鼠的免疫调节作用[J].中药药理与临床,2013,29(2):44-47.
[3]李凤,袁静,王玉凤.肝康乐对免疫功能低下小鼠的免疫调节作用[J].中国老年学杂志,2015,35(8):2188-2189.
[4]李晓冰,王超,陈玉龙,等.绞股蓝多糖对环磷酰胺所致免疫低下小鼠脾脏免疫功能的影响[J].时珍国医国药,2015,26(10):2308-2310.
[5]徐雅,张景瑜,刘杜霞,等.麻花秦艽醇提物对小鼠免疫功能的影响[J].中药药理与临床,2020,36(3):111-115.
[6]Wynn TA,Vannella KM.Macrophages in tissue repair,regeneration,and fibrosis[J].Immunity,2016,44(3):450-462.
[7]Wang H,Xu L,Yu M,et al.Glycosaminoglycan from Apostichopus japonicus induces immunomodulatory activity in cyclophosphamide-treated mice and in macrophages[J].Int J Biol Macromol,2019,130:229-237.
[8]郭亚惠,刘志勇,陈丽玲,等.不同取浆时间的蜂王浆对小鼠免疫功能的影响[J].食品与生物技术学报,2016,35(8):828-833.
[9]王跃凤,杨喜花,陈丽霞,等.猫棒束孢对免疫抑制小鼠免疫功能的影响[J].中草药,2019,50(11):2651-2655.
[10]孙守坤,宋涛,卢义.刺五加酸性多糖对免疫低下小鼠的免疫调节作用[J].免疫学杂志,2018,34(10):863-868.
[11]Sheng X,Yan J,Meng Y,et al.Immunomodulatory effects of Hericium erinaceus derived polysaccharides are mediated by intestinal immunology[J].Food Funct,2017,8(3):1020-1027.
[12]李立萍,解丽君,郝娜,等.双肾同补胶囊对小鼠免疫调节作用研究[J].河北中医,2019,41(8):1230-1235.
[13]刘东方,陆军,陆煜,等.鼠李糖乳杆菌LV108及其发酵乳免疫调节作用的比较[J].中国微生态学杂志,2020,32(12):1365-1369,1378.
[14]刘淑集,许旻,苏永昌,等.牡蛎寡肽对免疫低下小鼠模型免疫功能的影响[J].华南师范大学学报:自然科学版,2018,50(2):70-76.
[15]Sun W,Meng K,Qi C,et al.Immune-enhancing activity of polysaccharides isolated from Atractylodis macrocephalae Koidz[J].Carbohydr Polym,2015,126:91-96.
[16]李华伟,游佳,易成.槐耳在抗肿瘤免疫应答中的研究进展[J].中国肿瘤,2021,30(3):227-233.
[17]李娟,晋宇清,李丽,等.建立虚瘀并存小鼠动物模型的初步探讨[J].中华中醫药杂志,2020,35(10):5241-5243.
[18]Yu J,Cong L,Wang C,et al.Immunomodulatory effect of Schisandra polysaccharides in cyclophosphamide-induced immunocompromised mice[J].Exp Ther Med,2018,15(6):4755-4762.
[19]Zdrojewicz Z,Pachura E,Pachura P.The thymus:a forgotten,but very important organ[J].Adv Clin Exp Med,2016,25(2):369-375.
[20]张涵,王芳,白静,等.冬虫夏草转录组SSR位点信息分析研究[J].中国中药杂志,2019,44(21):4605-4611.
(2021-05-18收稿 责任编辑:王明)
