牛溶血性曼氏杆菌及牛荚膜A型多杀性巴氏杆菌灭活疫苗对小鼠的保护性研究
2021-09-27谢黎卿王远兰彭远义李能章
李 甜,杨 洋,谢黎卿,王远兰,李 攀,彭远义,李能章
(西南大学动物医学院 重庆市牧草与食草动物重点实验室,重庆 400715)
牛溶血性曼氏杆菌(Mannheimiahaemolytica,Mh)和牛多杀性巴氏杆菌(Pasteurellamultocida,Pm)均为巴氏杆菌科成员,分属曼氏杆菌属(Mannheimia)和巴氏杆菌属,二者均可作为牛上呼吸道共栖菌,在应激状态下(断奶、长途运输、恶劣天气等)引起牛呼吸道疾病综合征(bovine respiratory disease complex,BRDC)[1]。近年来,我国肉牛规模化养殖逐年增多,肉牛养殖由低效益的分散饲养到高效益的集中规模化饲养转变,从分散到集中的过程中,肉牛的频繁调运、营养补充的缺乏及饲养环境变化等因素导致BRDC发生率剧增[2],其中最为主要的细菌性病原包括溶血性曼氏杆菌和多杀性巴氏杆菌[3-4],牛溶血性曼氏杆菌和牛A型多杀性巴氏杆菌也被认为是导致牛严重性或致死性支气管肺炎最常见和重要的致病病原[5]。
目前针对牛溶血性曼氏杆菌和牛A型多杀性巴氏杆菌的疫苗均为国外产品,临床应用后其免疫保护效果也并不理想[5]。国内缺乏针对二者的商品化疫苗,对其疫苗的研究也稍显薄弱,牛多杀性巴氏杆菌仅有荚膜B型灭活疫苗,但其对荚膜A型多杀性巴氏杆菌无交叉保护性[6]。本研究通过比较牛溶血性曼氏杆菌灭活苗、牛溶血性曼氏杆菌-牛多杀性巴氏杆菌二联灭活苗、牛多杀性巴氏杆菌灭活苗免疫保护效果差异,为牛溶血性曼氏杆菌和牛多杀性巴氏杆菌的疫苗研究奠定基础。
1 材料与方法
1.1 菌株、实验动物及主要试剂
6~8周龄雌性昆明小鼠(18~22 g)购自恩斯维尔实验动物中心。牛溶血性曼氏杆菌(Mh422株,血清型为A6)及牛荚膜A型多杀性巴氏杆菌(PmCQ2株)均由西南大学动物医学院预防兽医学实验室分离并暂存;马丁肉汤培养基购自青岛海博生物技术有限公司;15 A VG矿物油乳化剂为重庆澳龙生物制品有限公司赠送;羊抗鼠IgG-HRP购自Thermo Fisher Scientific公司;TMB(3,3′,5,5′-四甲基联苯胺)显色液购自Beyotime公司。
1.2 感染模型的建立
实验室前期研究已建立了PmCQ2株小鼠感染模型[7]。针对Mh422株,挑取2~3个单菌落接种5 mL马丁肉汤培养基,37 ℃、200 r·min-1震荡培养12 h,平板计数,取2.0×106、2.0×107和2.0×108CFU腹腔感染雌性昆明小鼠(6~8周龄,18~22 g),每组10只,随时观察,小鼠濒死前实施安乐死,记录死亡数,同时剖检观察病理变化,采集肺组织做病理切片,对照为生理盐水处理组。
1.3 灭活疫苗制备
取Mh422株与PmCQ2株种子液,按1%分别接种马丁肉汤培养基,37 ℃、200 r·min-1恒温震荡培养12 h,对培养后的Mh422株与PmCQ2株菌液,分别进行纯粹性检验和活菌计数后浓缩(即离心菌液后用原菌液1/4体积的培养上清悬浮菌体),浓缩后分别加入终浓度为0.15%的甲醛溶液,37 ℃静置灭活24 h,之后将两种菌的处理液各取100 μL涂布于马丁固体培养基上,于37 ℃培养24 h进行灭活检验。灭活检验合格后,将菌液和PBS分别与矿物油佐剂按4∶1的比例混合均匀,分别制成灭活疫苗和PBS乳化剂,使Mh422株和PmCQ2株终浓度均为1×1010CFU·mL-1。用PBS乳化剂稀释Mh422灭活苗和PmCQ2灭活苗,稀释后的两个浓度梯度分别均为2.5×109CFU·mL-1(Mh-1或Pm-1)和5.0×109CFU·mL-1(Mh-2或Pm-2);并将1×1010CFU·mL-1的Mh422株和PmCQ2株单价灭活苗按不同体积比混合制备成二联疫苗,使 Mh422株与PmCQ2株的浓度比例分别为1∶1、2∶1、3∶1,对应Mh422株与PmCQ2株的终浓度分别为5.0×109CFU·mL-1∶5.0×109CFU·mL-1(Mh-Pm-1)、6.6×109CFU·mL-1∶3.3×109CFU·mL-1(Mh-Pm-2)和7.5×109CFU·mL-1∶2.5×109CFU·mL-1(Mh-Pm-3)[8-9]。每种疫苗各取100 μL涂布于马丁固体培养基上,于37 ℃培养24 h进行无菌检验。无菌检验合格后,保存于4 ℃备用。
1.4 疫苗免疫保护测定分组设计
取6~8周龄雌性昆明小鼠,随机分为14组,每组10只。按照表1进行免疫及攻毒分组,其中,A组(Mh-1、Mh-2-1和Mh-2-2)免疫Mh疫苗,Mh-1组和Mh-2-1组攻毒Mh422,Mh-2-2组攻毒PmCQ2;B组(Pm-1、Pm-2-1和Pm-2-2)免疫Pm疫苗,Pm-1组和Pm-2-1组攻毒PmCQ2,Pm-2-2组攻毒Mh422;AB组(AB-1组:Mh-Pm-1、Mh-Pm-2和Mh-Pm-3;AB-2组:Mh-Pm-1、Mh-Pm-2和Mh-Pm-3)免疫Mh-Pm二联苗,AB-1组攻毒Mh422、AB-2组攻毒PmCQ2;C组为对照组,免疫PBS乳化剂,control-1组攻毒Mh422,control-2组攻毒PmCQ2。小鼠进行背部皮下多点注射疫苗,共免疫三次,首免后第7、17天进行加强免疫。所有小鼠初次免疫均为0.2 mL,二免和三免的剂量减半。一免后连续观察小鼠7 d,记录小鼠的精神状况及免疫部位的肿胀变化,3免后第7天尾静脉采集血液分离血清检测抗体水平,记录对应到每只小鼠。
1.5 抗体消长动态测定
参照“1.4”小鼠免疫分组,共设定7个疫苗免疫组(Mh-1、Mh-2、Pm-1、Pm-2、Mh-Pm-1、Mh-Pm-2、Mh-Pm-3)及1个PBS乳化剂免疫对照组和1个未免疫的空白对照组,每组5只小鼠,免疫剂量及方式参照表1,初次免疫第7天开始尾静脉采血,分离血清,其后每间隔5 d采集分离血清,监测到第87天,ELISA 方法检测各自特异性抗体水平,分析其抗体消长情况。
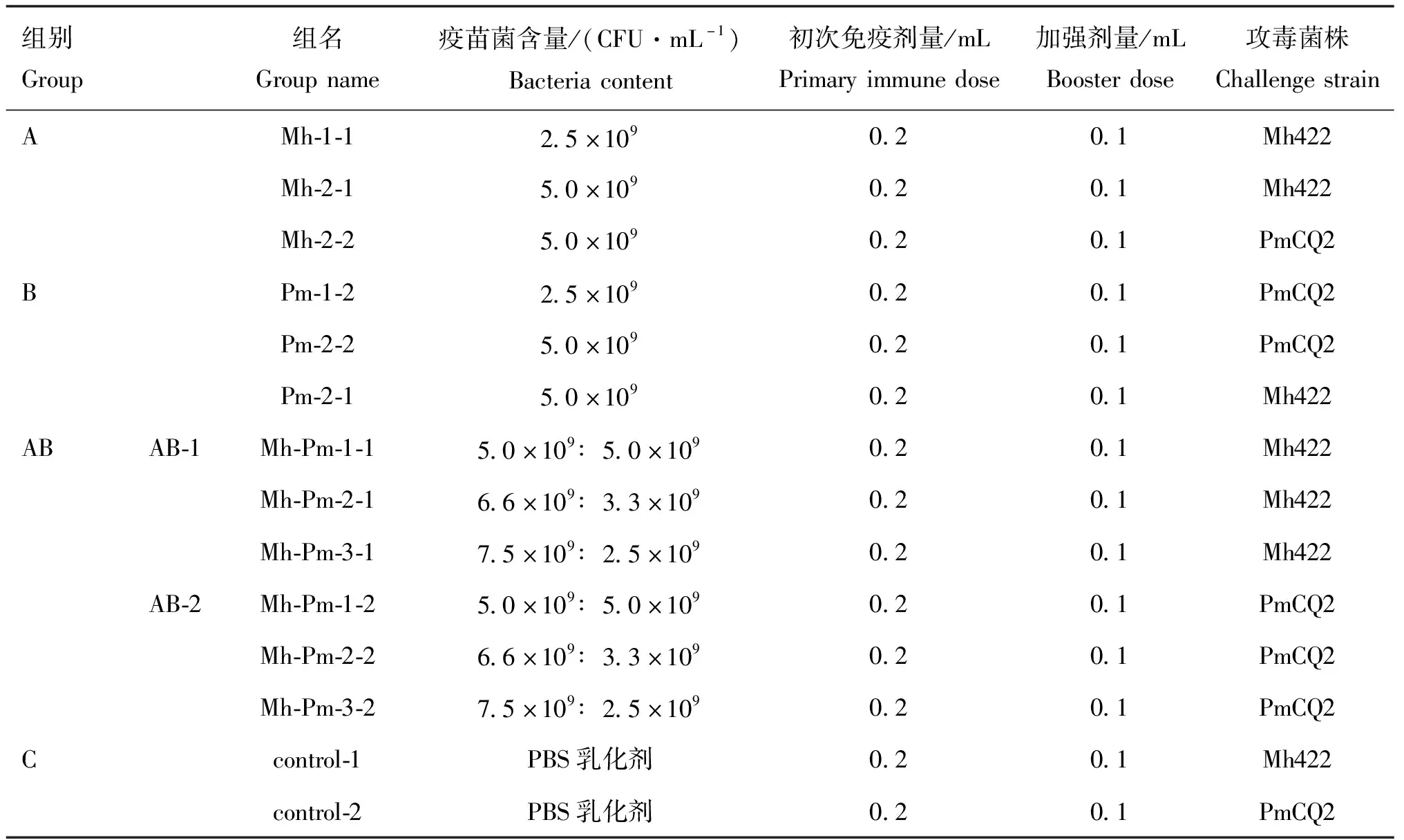
表1 小鼠免疫分组及攻毒设计
1.6 ELISA
参照“1.3”培养Mh422株和PmCQ2株,收集菌体,以超声破碎制备其全菌蛋白作为包被抗原,检测各自灭活疫苗免疫产生的特异性抗体水平,Mh-Pm二联疫苗免疫的小鼠分别检测Mh和Pm所产生的抗体水平。各组均以小鼠血清为一抗,羊抗鼠IgG-HRP为二抗。具体步骤:1)包被,每孔加入1 μg 菌体蛋白,4 ℃包被过夜,用PBST(含0.05% Tween20的PBS液)反复洗涤3次,每次5 min;2)封 闭,每孔加入200 μL 5%的脱脂奶粉,37 ℃封闭1 h,PBST洗涤3次,每次5 min;3)一抗孵育,第一孔加入2 μL血清和198 μL PBST,第2~12孔每孔加入100 μL PBST,其后2倍比稀释(1∶100~1∶204 800),37 ℃孵育1 h,PBST洗涤3次,每次5 min;4)二抗孵育,每孔加入100 μL PBST按1∶10 000稀释的HRP酶标羊抗鼠IgG,37 ℃孵育1 h,PBST洗涤3次,每次5 min;(5)显色,每孔加入100 μL TMB,37 ℃避光孵育10 min;(6)终止,每孔加入100 μL 1 mol·L-1H2SO4终止反应;(7)读数,酶标仪测OD450 nm处吸光值;(8)比较相应的样本血清(S)与阴性血清(N)的OD450 nm值的比值(S/N 值),以S/N 值 ≥ 2.1 判定为阳性值,S/N≥2.1的血清稀释最高倍数为样本血清的抗体效价。
1.7 攻毒保护试验
分别将PmCQ2株和Mh422株液体培养至对数生长期,用PBS稀释计数后,按照PmCQ2株2.0×104CFU(腹腔攻毒途径,LD50≈1 CFU),Mh422株2.0×108CFU(腹腔攻毒途径,LD50≈1.0×108CFU)的攻毒剂量,于三免后第20天,腹腔攻毒(参照表1)。攻毒后每天观察2次,记录小鼠临床症状,濒临死亡前尾静脉采血分离血清,其后实施安乐死,记录小鼠死亡数量,连续记录1周。疫苗保护率按以下公式计算:保护率=(对照组发病/死亡率-免疫组发病/死亡率)/对照组发病/死亡率×100%。应用于临床的疫苗其免疫保护率不得低于50%。
1.8 数据分析
采用Graphpad Prism 6进行试验数据的分析处理,t检验分析,P>0.05为无显著差异(ns);P<0.05(*)为显著差异;P<0.01(**)为显著极差异。
2 结 果
2.1 感染模型建立
实验室已构建PmCQ2株小鼠感染模型[7],PmCQ2感染初期,小鼠精神萎靡,被毛凌乱,感染后期,其食欲废绝,体重显著下降,行动迟缓,双眼紧闭,对外界刺激反应迟钝,最终死亡。感染后期剖检发现肺病变明显,心、肝、肺、脾中存在大量的菌体,肺组织病理特征[7]:支气管、肺泡和血管周围炎性细胞数量明显高于对照组,支气管出现退行性变化和坏死;毛细血管扩张、充血、出血;感染小鼠肺泡破裂、溶解,支气管和肺泡上皮细胞坏死、脱落。
Mh422株以不同剂量腹腔感染昆明小鼠,仅2.0×108CFU感染剂量组快速死亡,2.0×107CFU感染组仅死亡1只(图1A),小鼠多数在感染第2~3天死亡,初期无明显临床表现,后期精神萎靡,被毛凌乱,体重有轻微下降,死前剖检发现,肺病变不明显,但心、肝、脾、肺有大量的菌体(图1B)。肺组织病理观察,2.0×108CFU感染组与对照组相比,肺泡上皮细胞不同程度脱落,肺间质内较多炎性细胞浸润,主要为核分叶状的中性粒细胞,肺泡腔内少量炎性细胞浸润,主要为中性粒细胞,少量蛋白样物质渗出;血管显著扩张,见动脉和静脉血管管腔明显增宽,动脉血管壁变薄(图1C、1D)。

A.Mh422感染小鼠生存曲线;B.Mh422感染小鼠肺组织触片瑞特氏染色;C.Mh422感染小鼠肺组织HE染色;D.对照组
2.2 灭活疫苗安全性检验
对Mh422株和PmCQ2株菌体甲醛灭活后和乳化后均进行了无菌检验,结果显示,100 μL 处理菌液样本涂布马丁固体培养基上,37 ℃恒温培养24 h,无菌生长,表明疫苗无菌检验合格。
小鼠一免后进行安全检验,连续观察7 d,免疫小鼠精神状况及食欲均正常,触摸皮下注射部位,基本无肿块、硬块产生,个别产生肿块的小鼠在免疫3 d后均消退。表明疫苗安全性良好。
2.3 疫苗免疫抗体水平检测
三免后第7天采集血清,分别以Mh422株和PmCQ2株菌体蛋白为包被抗原,ELISA方法检测未免疫小鼠和各自灭活疫苗免疫小鼠产生的特异性抗体水平。未免疫空白小鼠均无抗-Pm和抗-Mh特异性抗体产生(图2A~D)。Mh单菌苗和二联疫苗均产生较高水平的抗-Mh抗体(图2A、C);Pm单菌苗和二联疫苗也能产生较高水平的抗-Pm抗体,二联疫苗中随着Pm含量降低,其抗-Pm的抗体水平呈下降趋势(图2B、D)。比较Mh和Pm,不管单苗还是二联疫苗,在免疫剂量相同的情况下,其产生的抗体量相当,表明在诱导机体产生抗体方面,Mh和Pm无相互抑制作用,这为Mh-Pm疫苗研制提供了基础。
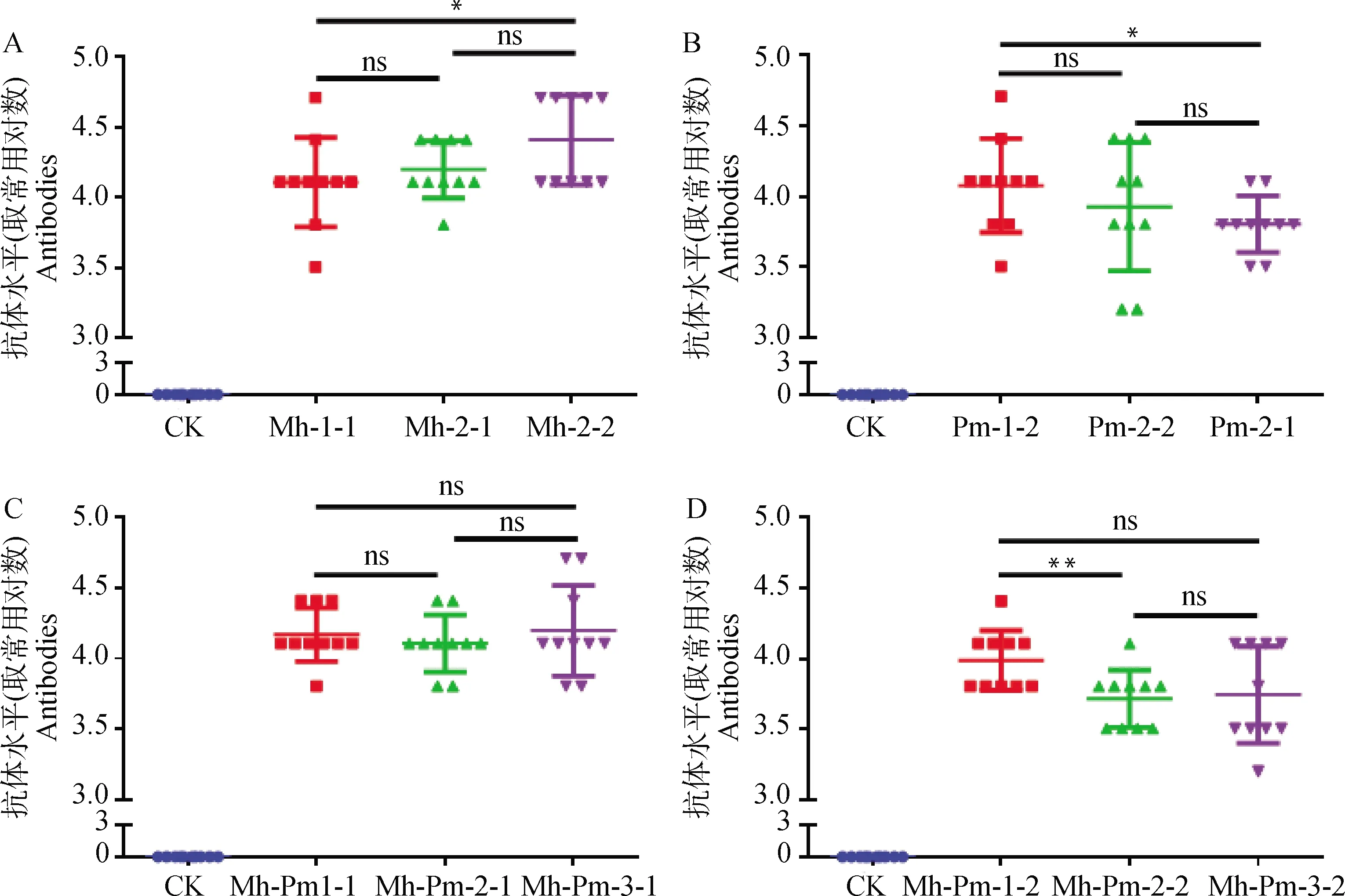
A.Mh单菌苗免疫抗体效价;B.Pm单菌苗免疫抗体效价;C.Mh-Pm疫苗免疫抗-Mh抗体效价;D.Mh-Pm疫苗免疫抗-Pm抗体效价
2.4 疫苗免疫抗体消长动态测定
疫苗免疫后测定其不同时间抗体产生情况,结果发现,不管是Mh或Pm单菌苗,还是Mh-Pm二联疫苗免疫,其各自抗体产生上升的趋势基本相同,同一时间段其抗体水平相当(图3A、B),初免后第17天(二免后第10天),抗体产生达到较高水平,其后再次加强免疫,抗体水平整体继续上升,在第32天达到最高值,相对稳定维持到第57天,其后抗体水平开始缓慢下降。
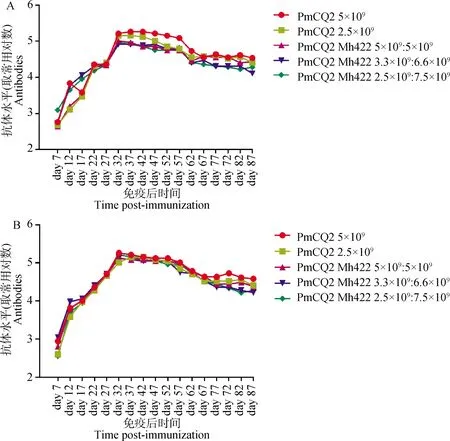
A.抗-Pm抗体效价;B.抗-Mh抗体效价
2.5 免疫保护性试验
对各免疫组小鼠攻毒,观察临床症状,计算攻毒保护率。结果显示,无论用Pm单苗还是Mh-Pm二联苗免疫的小鼠,用PmCQ2株攻毒后其保护率均能达到100%;Mh单苗对Mh422株无免疫保护作用,Mh-Pm二联苗对Mh422株有较高的保护率,3组不同浓度配比的Mh-Pm二联苗对Mh422株的保护率分别为57%、53%和71%;Mh与Pm间无交叉保护作用(表2)。结合其抗体水平分析(图2),Pm不管是单菌苗还是二联苗免疫,即便对产生较低抗体量的个体攻毒PmCQ2株也具有保护作用,而在Mh单菌苗免疫中,则相反,即便产生的抗体量也很高,但对Mh422株的攻毒却没有相应保护作用,表明Mh菌苗免疫的总抗体水平与其保护性间无相关性。以上结果表明,PmCQ2具有促进Mh422灭活苗对Mh422株的免疫保护作用。
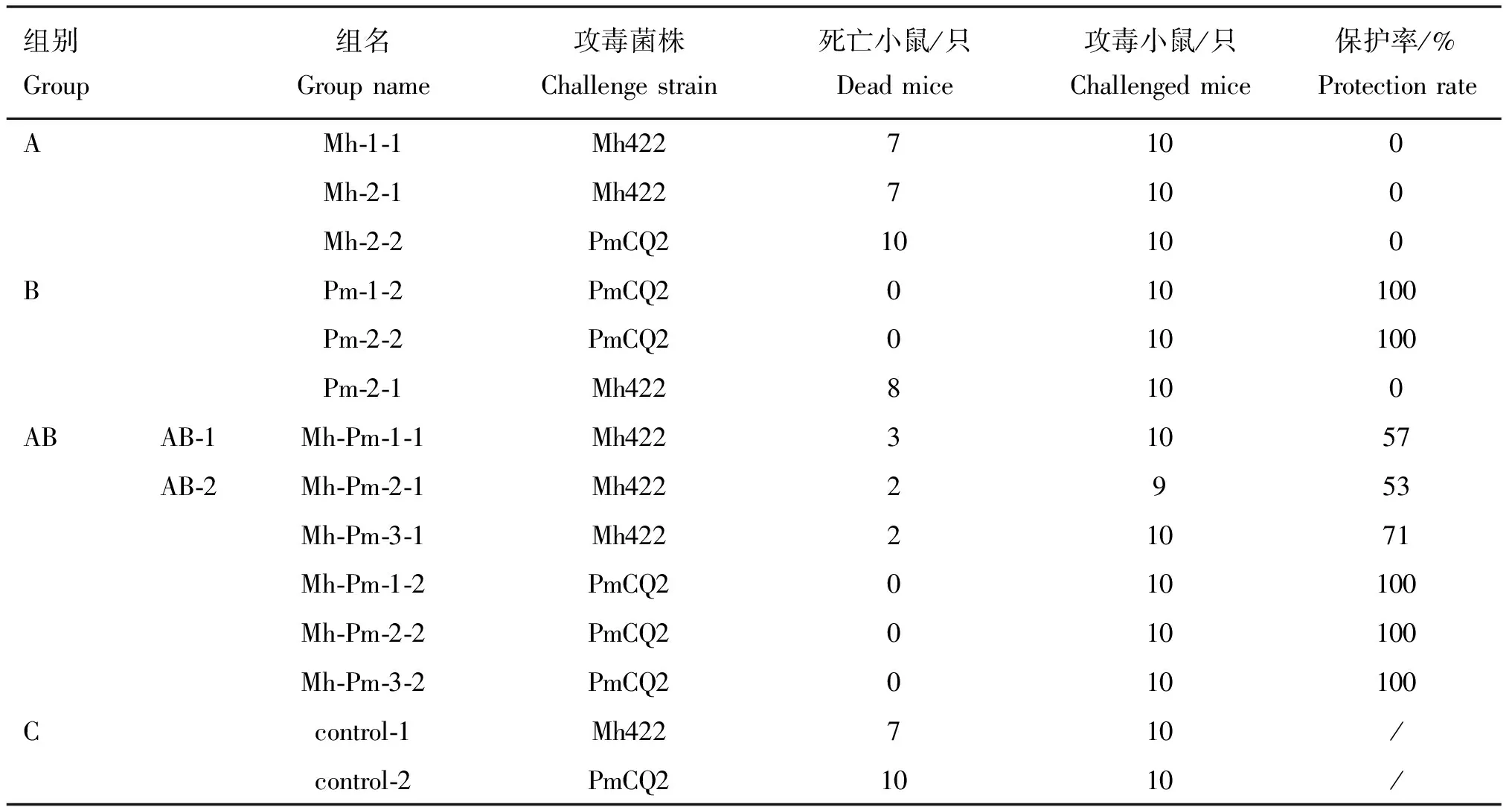
表2 疫苗保护率测定
3 讨 论
牛呼吸道疾病综合征(BRDC)是肉牛生产中危害最严重的疾病,据报道每头牛因BRDC造成的损失约为13美元,对世界肉牛养殖业造成了巨大经济损失[10-11]。近年来调查发现,我国肉牛疫病中BRDC占比可达65%,分离的主要细菌性病原溶血性曼氏杆菌占46.3%、睡眠嗜组织菌占5.6%,多杀性巴氏杆菌占6.5%[12]。目前,国内预防牛多杀性巴氏杆菌病主要是B型多杀性巴氏杆菌疫苗,但对国内主要流行型A型多杀性巴氏杆菌缺乏交叉免疫保护;而溶血性曼氏杆菌疫苗主要研究热点集中在LKT疫苗,但是国内仍缺乏商品化疫苗防控此类疾病[13],并且针对牛呼吸道疾病的多价苗欠缺[14]。因此,研制溶血性曼氏杆菌、多杀性巴氏杆菌疫苗对降低BRDC的发生率尤为重要。
本研究选择了BRDC中分离率较高的溶血性曼氏杆菌和多杀性巴氏杆菌,制备了单价苗和二联疫苗,并利用实验室前期建立的小鼠感染模型初步测试其免疫保护效果。前期发现,溶血性曼氏杆菌单菌苗首免后第14天加强免疫1次,第21天断尾采血分离血清,第28天同型攻毒测定,无保护作用,ELISA结果表明抗体水平整体不高,分析可能与抗体水平有关。而针对A型多杀性巴氏杆菌菌苗,前期发现仅1次加强免疫,即便其抗体水平不高的个体,都能抵抗Pm的感染,同型保护率达100%。结合溶血性曼氏杆菌的预试验结果与一般蛋白的多克隆抗体制备免疫程序及有关报道[15],因此,本研究中两种菌苗均选择了2次加强免疫。三免后7 d对免疫小鼠尾静脉采血分离血清,通过ELISA进行抗体效价的测定,结果显示,各疫苗组的免疫小鼠均能产生较高水平抗体。试验中,Mh-Pm-2组有1只小鼠在尾静脉采血后第5天死亡,考虑到采血应激及伤口感染等因素带来的试验差异,并未采血后立即进行攻毒测试。应该注意的是在疫苗效价评估中,血清中高水平的IgG抗体并不意味着能够清除或抵抗致病菌感染[16],因此基于IgG水平升高的疫苗研究仅供参考,更应该注重免疫保护状况、临床症状和病理损伤情况。
本研究发现,针对牛多杀性巴氏杆菌,即便采用2×104LD50攻毒测试,PmCQ2株制备的单价苗和二联疫苗对PmCQ2株的免疫保护率均为完全保护(100%),这表明可能低免疫剂量的PmCQ2都可能具有很好的免疫保护效果。测试PmCQ2单价苗对实验室分离的其他牛荚膜A型多杀性巴氏杆菌的免疫保护作用,其保护率也均大于85%,这与其他牛多杀性巴氏杆菌灭活疫苗研究结果一致[17]。而本研究中选用的牛溶血性曼氏杆菌Mh422株所制备的油佐剂单价苗却对Mh422株本身攻毒都无任何免疫保护作用,这与周金玲[18]采用不同佐剂制备的牛溶血性曼氏杆菌疫苗研究结果差异较大。周金玲等[18]以牛溶血性曼氏杆菌同一菌株分别制备了铝佐剂、油佐剂和蜂胶佐剂灭活疫苗,测试发现其同型保护率分别为70%、75%和75%[18]。为进一步探讨Mh422单苗无同型保护作用的原因,考虑通常情况下,活疫苗比灭活疫苗的免疫保护效果好,在本实验室后续的试验中,作者分别采用4.0×107CFU和3.0×108CFU Mh422肌内注射途径感染小鼠,感染后24 h,小鼠有轻微症状,第3天后恢复,21 d后,腹腔攻毒 Mh422(2 LD50),结果显示也无保护性(数据未显示),测试的另外一株溶血性曼氏杆菌Mh1443,制备的疫苗同样对同型无相应保护作用。由此推测,溶血性曼氏杆菌的同型保护作用可能与菌株本身免疫保护性抗原表达量及其表面暴露情况、疫苗佐剂及制备灭活疫苗的条件等有关。有趣的是,本研究制备的Mh-Pm二联疫苗却对Mh422株免疫保护率达到53%~71%,测定二联苗抗Mh422的血清抗体水平与其单价疫苗无显著差异,那么,是否是多杀性巴氏杆菌PmCQ2对溶血性曼氏杆菌Mh422具有交叉保护作用呢?结果发现,PmCQ2与Mh422间无交叉保护作用,由此推测Mh-Pm二联疫苗对Mh422株的保护作用是因为PmCQ2的促进作用。这种细菌促进其他疫苗免疫作用在其他的研究中也有发现,如口蹄疫灭活苗配合枯草芽胞杆菌(Bacillussubtilis)对牛进行鼻腔免疫,能增强牛呼吸道黏膜对口蹄疫病毒的免疫应答[19]。将灭活的脑膜炎球菌(Neisseriameninyitidis)或百日咳菌(Bordetellapertussis)加入流感病毒(influenza virus)灭活疫苗中,滴鼻免疫小鼠,通过诱导非特异性免疫应答,能显著提高血清中的抗流感病毒的IgG和IgA水平[20],推测PmCQ2在本试验中可能也发挥了类似的作用。相反的是,有研究表明溶血性巴氏杆菌疫苗(PhV)与改良疱疹病毒、副流感病毒活疫苗联合接种显著降低了PhV在预防BRD发病、BRD死亡率和纤维性肺炎死亡率方面的效力,也降低了对溶血性巴氏杆菌白细胞毒素的抗体反应[21]。另有研究表明接种含有传染性牛鼻气管炎病毒(IBRV)和I型、II型牛病毒性腹泻病毒(BVDV)的多价、改良型病毒活疫苗,以及溶血性曼氏杆菌和多杀性巴氏杆菌类毒素与接种含有IBRV、I型BVDV、牛呼吸道合胞体病毒、3型副流感病毒和Mh类毒素相比,前者免疫配伍方式显著降低BRD发生率和病死率,日增重显著[22]。因此,研究多价苗时,合理的接种程序以及疫苗配伍也应在考虑范围之内。鉴于溶血性曼氏杆菌的特殊性,其疫苗研究,需选用多个菌株,以不同制备方法、免疫方式及途径进行测试,筛出疫苗株及其最佳的制备及免疫程序。
4 结 论
无论是牛多杀性巴氏杆菌PmCQ2单苗还是Mh422-PmCQ2二联苗对PmCQ2攻毒保护率均为100%,并且Mh422-PmCQ2二联苗对Mh422也有较高的保护率。本研究为牛溶血性曼氏杆菌和牛荚膜A型多杀性巴氏杆菌细菌疫苗的研发奠定了基础。
