脱氧雪腐烯醇(DON)对牛卵母细胞体外成熟及发育能力的影响
2021-09-27孙克佳姜晓龙刘爱菊马晓菲韩红叶姚大为田树军
孙 欢,孙克佳,姜晓龙,刘爱菊,马晓菲,韩红叶,姚大为,马 毅*,田树军,3*
(1.河北农业大学动物科技学院,保定071001;2.天津市畜牧兽医研究所,天津300381;3.河北省牛羊胚胎技术创新中心,保定071001)
脱氧雪腐烯醇(deoxynivalenol,DON)是一种常见的霉菌毒素,普遍存在于玉米、小麦和大麦等谷物的秸秆与籽实中。因 DON 的理化性质十分稳定,在饲料加工过程中很难将其破坏,且分子量较小,可快速穿越肠壁进入血液循环并穿越血脑屏障,所以当按每公斤体重给小鼠灌服25 mg的DON时,在5 min后便可在大脑内检测到(0.8±0.1)μg·g-1DON[1]。当畜禽采食被DON污染的饲料后,其肉、奶、蛋中亦可检测到DON,雌性动物则出现卵泡退化、发情异常、流产、不孕等症状,严重威胁人类和动物健康[2]。
有研究发现,DON可在牛卵泡液中发生富集,牛卵泡液中的DON浓度与血浆中的DON浓度呈正相关(y=-0.71+1.50x,y为卵泡液中 DON 浓度,x为血浆中 DON 浓度),引起卵泡中孕酮和雌二醇等生殖激素分泌紊乱[3]。众所周知,卵泡是卵母细胞发育成熟的重要场所,并受卵泡液中生殖激素的调控。然而,DON究竟如何影响牛卵母细胞的发育成熟及其作用机制,目前尚不清楚。
卵母细胞成熟发育与包裹其外周的颗粒细胞存在复杂的联系,颗粒细胞对卵母细胞起着营养支持及信号传导等作用,对卵母细胞正常代谢及后续受精和胚胎发育能力都有着关键性的影响。颗粒细胞扩展程度越高越有利于卵母细胞与外界进行营养及信息交换,因此,卵丘颗粒细胞扩展程度可作为评判卵母细胞体外成熟效果的一个重要指标[4]。同时,在卵母细胞逐渐成熟的过程中,其胞质内部的诸多细胞器也会发生明显的变化,例如排出第一极体可作为卵母细胞的细胞核成熟的标志,细胞质成熟则可通过线粒体分布状态等指标进行评价。另外,活性氧(ROS)作为卵泡中重要的信号分子,在机体抗氧化系统参与下保持平衡,对保障卵母细胞成熟及其正常发育至关重要。一旦细胞内抗氧化系统不足以对抗应激所产生的ROS,细胞核中染色体就会受到不可逆损伤,使卵母细胞减数分裂无法正常进行。而机体抗氧化系统对抗ROS的分子机制则是通过上调过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)等相关基因表达,并通过转录和翻译合成CAT、GPx等相应的抗氧化酶来实现[5]。
因此,为探究DON对牛卵母细胞体外成熟发育的影响及其作用机制,本试验首先通过在牛卵母细胞体外成熟培养液中添加不同浓度的 DON,并检测卵丘细胞扩展程度及第一极体排出率,构建DON毒性模型;然后,借助此模型研究DON对卵母细胞的线粒体分布及后续受精卵裂率、囊胚发育率的影响,探究DON对牛卵母细胞体外成熟及后续发育能力的影响;通过检测体外成熟卵母细胞内的ROS、GSH水平和抗氧化基因CAT、GPx4的mRNA表达量,揭示DON影响牛卵母细胞体外发育能力的分子机制。
1 材料与方法
1.1 材料
卵巢取自屠宰场,置于盛有含80 IU·dL-1双抗的37 ℃生理盐水(经下简称“生理盐水”)的保温杯中,于4 h内运送至实验室。用新鲜生理盐水清洗卵巢1遍,用灭菌剪刀去掉卵巢系膜,随后用75%酒精快速清洗卵巢1遍,再用新鲜生理盐水清洗卵巢2遍。
1.2 主要仪器与试剂
主要仪器:CO2培养箱(美国Thermo公司)、体视显微镜(日本Olympus公司)、荧光显微镜(日本Nikon公司)。主要试剂:TCM199(美国Gibco公司)、胎牛血清(美国Gibco公司)、2’,7’-二氯荧光素二乙酸酯(美国 Invitrogen 公司)、ThiolTrackerTMViolet(美国Invitrogen公司),丙酮酸钠、Hepes-sodium、M199、L-谷氨酰胺、碳酸氢钠、葡萄糖、肝素、青霉素、链霉素、DON、FBS、FSH、E2、LH、HP、EGF、IGF、PS、EAA、NEAA、BSA、矿物质油、PBS、PVA 等其他化学药品均购自 Sigma 公司。
1.3 主要药品配制
卵母细胞成熟液(IVM液)为含10% FBS、0.01 IU·mL-1FSH、0.01 IU·mL-1LH、1 μg·mL-1E2、10 μg·mL-1肝素、50 ng·mL-1EGF、100 ng·mL-1IGF的TCM199(1×)。体外受精液(IVF液)为含6.55 mg·mL-1NaCl、0.23 mg·mL-1KCl、0.33 mg·mL-1CaCl2·2H2O、1.06 mg·mL-1MgCl2·6H2O、2.6 mg·mL-1NaHCO3、0.137 5 mg·mL-1丙酮酸钠、0.01 mg·mL-1肝素、2 μL·mL-1酚红的水溶液。体外胚胎发育培养液(IVC液)为含0.23 mg·mL-1KCl、2.2 mg·mL-1NaCO3、0.162 6 mg·mL-1MgCl2·6H2O、0.161 9 mg·mL-1KH2PO4、0.044 mg·mL-1丙酮酸钠、0.27 mg·mL-1葡萄糖、2 μL·mL-1酚红的水溶液。终止液:含10% FBS的TCM199液。
1.4 卵母细胞的采集、体外成熟培养及成熟效果评价
用一次性注射器吸取卵巢上3~5 mm卵泡中的卵丘卵母细胞复合体(COCs),将捡出的COCs在洗卵液中清洗2遍,选择外周包裹3层以上卵丘细胞且胞质均匀的COCs,在IVM液中清洗3遍,随后将其转入到含 DON 浓度分别为0、50、250、500、1 000 ng·mL-1的 IVM液的四孔板中,每孔40~50枚细胞,置于38.5 ℃、5% CO2的培养箱中成熟培养22 h,在显微镜下对 COCs 卵丘扩展情况进行评级,并计算卵丘扩展指数。待COCs卵丘扩展效果评价结束后,用浓度为0.1%的透明质酸酶除去卵母细胞外的所有颗粒细胞,用捡卵针轻轻拨动卵母细胞,观察卵母细胞第一极体是否排出,并计算各组的第一极体排出率。
将卵丘扩展分为 0~4 五个等级;0 级代表卵丘无扩展,计为0分;1 级代表只有卵丘最外周 1~2 层卵丘扩展,计为1分;2 级代表有2层以上卵丘细胞已扩展且呈放射状,计为2分;3 级代表除紧挨卵母细胞最内层放射冠外其他卵丘均完成扩展,计为3分;4 级代表所有卵丘细胞均扩展,计为4分。卵丘扩展指数=组内COCs卵丘扩展情况分值总和/组内COCs总数,卵丘扩展指数值越大表示卵丘扩展效果越好。
1.5 体外受精及早期胚胎体外发育培养
将从液氮罐中取出的冻精迅速投入到37 ℃温水中进行解冻,随后用洗精液充分洗涤精子并调整精子密度为1×106个·mL-1。用移液枪将50 μL的精子加入到去除外周卵丘的卵母细胞的50 μL受精滴中,每个微滴中含15~20枚卵母细胞。精卵共孵育16 h后用捡卵针辅助去除受精卵外所有的颗粒细胞,并将其转入到前期胚胎培养液中放入培养箱中培养,于受精后48 h统计其卵裂率,随后将受精卵由前期培养液转移至后期培养液中,每隔48 h进行半量换液,于受精第7天观察囊胚数并计算囊胚率。
1.6 卵母细胞内线粒体分布检测
用浓度为0.1%透明质酸酶消化除掉成熟培养22 h后胞质均匀的卵母细胞外所有颗粒细胞,随后将卵母细胞置于100 nmol·L-1的Mito Tracker Red CMXRos 中避光孵育 20 min,接着将各组卵母细胞移入到DPBS中洗涤3次,随后把卵母细胞在已预热的4%多聚甲醛溶液中固定15 min,在DPBS溶液中漂洗10 min后进行压片处理,将样品置于荧光显微镜下观察各组卵母细胞内线粒体的分布情况,整个试验过程避光操作。其中,将卵母细胞内线粒体分布分为两种类型,即卵母细胞内线粒体均匀分布和不均匀分布。均匀分布是指线粒体均匀分布于整个卵母细胞胞质中,不均匀分布是指卵母细胞胞质中存在没有线粒体分布的区域。
1.7 ROS及GSH含量检测
用浓度为0.1%透明质酸酶消化掉成熟培养22 h 的卵母细胞外的颗粒细胞,随后将卵母细胞分别置于2’,7’-二氯荧光素二乙酸酯(2’,7’-dichloro-fluorescin diacetate, DCHFDA)及ThiolTrackerTMViolet(Glutathione Detection Reagent)染料中进行避光孵育30 min,随后各组卵母细胞移入到0.1% PVA-DPBA中洗涤3次。在载玻片上点一滴DPBS,每次将10~15枚已染色处理的卵母细胞转移到载玻片上的微滴中,调整好曝光时间与参数,在荧光显微镜下用NIS Elements f软件对已进行染色的卵母细胞进行拍照,分别用470 nm与380 nm激发波长进行荧光激发,整个操作均在避光条件下进行。随后用Image J软件对细胞内ROS与GSH水平进行量化统计。
1.8 CAT与GPx4基因检测
1.8.1 样品收集 用浓度为0.1%透明质酸酶除去体外成熟培养22 h卵母细胞外的颗粒细胞,随后将裸卵置于终止液中终止消化,随后在DPBS中漂洗5 min,用捡卵管将处理好的卵母细胞转移至200 μL离心管中进行冻存处理,每次每组收集卵母细胞40~50个。
1.8.2 引物设计 试验共选取3个基因,包括1个 内参基因GAPDH和2个卵母细胞抗氧化应急相关基因CAT与GPx4,基因引物参照NCBI(http://www.ncbi.nlm.nih.gov/)中的NM_001034034.2、NM_001035386.2和NM_001034034.2,由生工生物工程(上海)股份有限公司合成,引物序列和扩增目标片段的大小如表1所示。

表1 引物序列及扩增目标片段的大小
1.8.3 cDNA制备 卵母细胞 cDNA 的制备采用 Cells-to-cDNA(Invitrogen,美国)试剂盒进行,具体操作步骤为:①裂解卵母细胞,即将适量 Cell Lysis II Buffer 加入收集卵母细胞样品的离心管中,然后置于 PCR 仪中 75 ℃ 加热 l0 min;②去除基因组 DNA,即加入1/50 Cell Lysis II Buffer 体积的 DNase I,PCR 仪中 37 ℃ 加热 15 min,然后75 ℃加热 5 min 灭活 DNase I;③RNA 合成,即取10 μL细胞裂解产物,加入4 μL dNTP Mix 和 2 μL Oligo(dT)18 primers 后混匀,PCR仪中 70 ℃加热3 min,结束后取出立即置于冰上静置 1 min;④cDNA 合成,即向第三步的产物中加入2 μL 10×RT buffer、1 μL M-MLV 反转录酶和1 μL RNase 抑制剂,PCR 仪中 42 ℃ 孵育 30 min,95 ℃ 加热10 min,即可得到cDNA,于-20 ℃ 保存备用。
1.8.4 荧光定量PCR检测 以合成的cDNA为模板,根据SYBR®Premix Ex TaqTMⅡ说明书,在EasyCycler 96荧光定量PCR仪上进行分析,反应体系为15 μL:2×TB Green premix 7.5 μL,正反引物各0.3 μL,cDNA 1 μL,ddH2O 5.9 μL。反应条件:95 ℃预变性30 s;95 ℃变性5 s、60 ℃退火延伸30 s,共30个循环。采用 2-△△Ct法计算出各目的基因 mRNA 的相对表达量。
1.9 数据分析
采用生物统计分析软件SPSS 21.0,运用单因素方差分析或卡方检验对数据进行差异显著性检验,P<0.05为差异显著,P<0.01为差异极显著。
2 结 果
2.1 不同浓度DON对卵丘细胞扩展的影响
结果如表2所示,250 ng·mL-1组卵丘扩展指数为2.32±0.09,较对照组3.22±0.06显著下降(P<0.05);500和1 000 ng·mL-1组分别为1.57± 0.07和0.71±0.06,较对照组极显著下降(P<0.01)。

表2 不同浓度DON对牛卵丘卵母细胞卵丘扩展指数的影响
2.2 不同浓度DON对第一极体排出率的影响
如表3所示,不同浓度的DON(50、250、500、1 000 ng·mL-1)均会降低卵母细胞成熟过程中第一极体的排出率。相较于对照组,250、500 ng·mL-1的DON可显著降低第一极体排出率(P<0.05),1 000 ng·mL-1组则极显著降低第一极体排出率(P<0.01)。

表3 DON对牛卵母细胞第一极体排出的影响
2.3 DON对卵母细胞体外发育潜能的影响
根据“2.1”和“2.2”的试验结果,本试验及后续试验选择500 ng·mL-1DON 作为毒性模型即DON组,与对照组(0 ng·mL-1DON)相比较,探究DON 对卵母细胞体外发育潜能的影响。结果如表4所示,相较对照组,DON处理组的卵裂率与囊胚率均显著降低(P<0.05)。
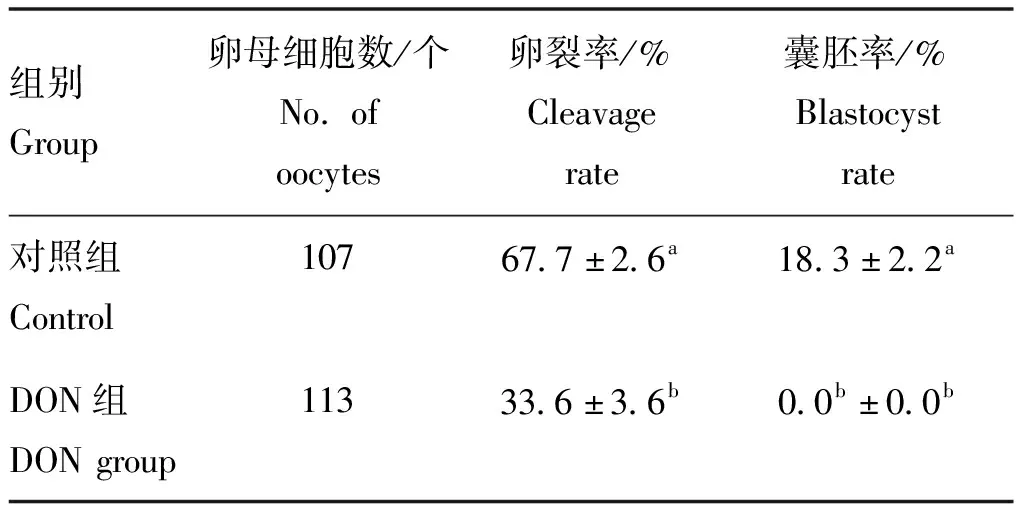
表4 DON对卵母细胞体外发育潜能的影响
2.4 DON对卵母细胞内线粒体分布的影响
牛卵母细胞体外成熟22 h,线粒体呈均匀分布和不均匀分布的显微镜下明场和荧光典型图如图1A所示,DON对牛卵母细胞内线粒体分布的影响结果如图1B所示。结果发现,DON组线粒体均匀分布的比例较对照组显著降低(P<0.05)。

A.卵母细胞线粒体染色图:a、b分别代表线粒体分布均匀与不均匀的卵母细胞的显微镜明场图;c、d分别代表线粒体分布均匀与不均匀的卵母细胞的显微镜荧光图。B.对照组与DON组间线粒体分布均匀卵母细胞的比例图,*表示组间差异显著(P<0.05),下同
2.5 DON对卵母细胞内ROS水平的影响
由图2A可知,DON组的荧光强度高于对照组;图2B为卵母细胞内ROS的相对荧光强度量化分析结果,DON组中卵母细胞内ROS水平显著高于对照组(P<0.05)。

A.卵母细胞活性氧染色图片:a、b分别为对照组卵母细胞的明场和荧光图,c、d分别为 DON组的明场与荧光图。B.对照组与DON组的卵母细胞内ROS水平比较图
2.6 DON对卵母细胞内GSH水平的影响
由图3A可知,DON 组荧光亮度低于对照组;图3B卵母细胞内GSH的相对荧光强度量化分析结果表明,DON组卵母细胞内GSH水平显著低于对照组(P<0.05)。

A.卵母细胞谷胱甘肽染色图片:a、b分别为对照组的明场和荧光图;c、d分别为DON组的明场与荧光图。B.卵母细胞内GSH相对荧光强度图
2.7 DON 对卵母细胞内抗氧化基因CAT、GPx4表达的影响
抗氧化基因CAT、GPx4在各组卵母细胞中的表达水平如图4,DON组CAT、GPx4转录水平相较于对照组均显著降低(P<0.05)。
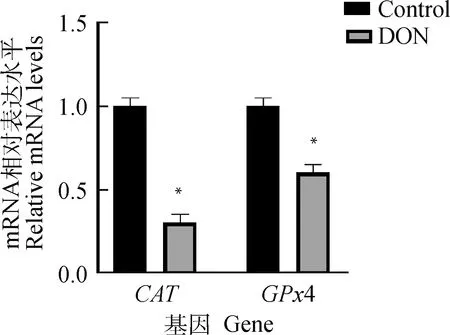
图4 DON 对卵母细胞抗氧化基因CAT与GPx4表达的影响
3 讨 论
卵母细胞成熟与包裹其外周的颗粒细胞存在复杂的联系,颗粒细胞对卵母细胞成熟起着营养支持及信号传导等作用,对卵母细胞的正常代谢及后期的受精能力都有着关键性的影响。本研究结果表明,在牛卵母细胞体外成熟液中,50 ng·mL-1的DON可显著抑制卵丘颗粒细胞的扩展,当DON浓度达到500 ng·mL-1时,则可极显著抑制卵丘颗粒细胞扩展,这与Schoevers等[6]发现DON抑制卵丘细胞扩展的结论相一致。
评价卵母细胞达到细胞核成熟的依据是排出第一极体,线粒体在细胞质中均匀分布则是判断卵母细胞达到细胞质成熟的重要标志[7]。本研究证实,牛卵母细胞体外成熟液中DON浓度为250 ng·mL-1和500 ng·mL-1时会显著降低卵母细胞体外成熟的第一极体排出率,当DON浓度达到1 000 ng·mL-1时则极显著降低第一极体排出率,表明当牛卵母细胞体外成熟液中DON浓度高于250 ng·mL-1时就会抑制卵母细胞的细胞核成熟进程;另外,本研究表明,DON浓度达到500 ng·mL-1时会显著抑制牛卵母细胞的线粒体正常分布。综上,以牛卵母细胞体外成熟培养液中含有500 ng·mL-1的DON为毒性模型,进一步开展DON对牛卵母细胞体外发育能力的影响及作用机制研究是可行的。
卵母细胞体外成熟将为其完成正常受精及后续胚胎发育奠定重要基础。Lan等[1]的体外试验结果表明,1 μmol·L-1的DON可显著降低小鼠卵母细胞的成熟率(78.69%vs.68.64%),在其开展的体内试验中,对雌性小鼠连续7 d按每公斤体重注射0.6 mg的DON后,与雄鼠进行交配,随后收集受精卵在体外条件下进行成熟培养,结果表明,饲喂DON后的小鼠卵母细胞的卵裂率及囊胚率均显著降低。Alm等[8]的研究同样显示,DON可造成GV期猪卵母细胞的退化及体外培养过程中成熟率的降低,本研究DON毒性处理会显著降低牛卵母细胞的体外受精卵裂率及囊胚率,与上述试验结果一致。Schoevers等[6]用不同浓度的DON对猪卵母细胞进行成熟培养,发现培养液中浓度0.02 μmol·L-1的DON不仅显著降低猪卵母细胞成熟率及囊胚率,同时DON还可造成体外受精过程中多精入卵的比例,此异常受精现象的发生可能是囊胚率降低的因素之一。
已有研究证实,细胞内抗氧化系统处于失衡状态会造成细胞的氧化损伤,DON毒性作用与诱导氧化应激具有很强的关联性[9-11]。Yu等[12]报道了小鼠妊娠期采食含DON的饲料后,其胚胎毒性由胎盘内ROS积累造成。Wang等[13]用含DON的饲料对鸡进行饲喂,在36 d后的血样中发现,CAT等酶类抗氧化剂的活性显著降低。Gao等[14]发现,DON对雄性动物的生殖系统具有显著的毒性作用,雄性小鼠采食含DON的饲料后会导致精子畸形率增加和精子活力的降低,同时睾丸组织中ROS等水平升高,GSH等酶类抗氧化剂的活性降低。本研究发现,DON可造成牛卵母细胞内ROS水平的显著增加、GSH水平的显著降低,进一步证实DON毒性是通过破坏牛卵母细胞细的抗氧化系统平衡途径来发挥作用的。为探究DON对牛卵母细胞的可能作用机制,本研究进一步检测DON处理组牛卵母细胞内的抗氧化基因CAT、GPx4的mRNA表达水平,发现其基因表达量均显著降低。在介导细胞抗氧化应激反应的keap1-Nrf2通路中,其下游调控基因CAT与GPx可转录翻译生成相应的酶,将自由基转化生成的过氧化氢(H2O2)进行分解,其可直接催化H2O2的氧化分解为H2O和O2,而GPx则需要在GSH的参与下将H2O2分解为对集体无害的H2O,同时GPx还能将有机过氧化物分解H2O和相应的醇类[15]。Huang等[16]用DON浓度分别为0、300、600、900、1 200、1 500 μg·kg-1的饲料对草鱼进行了为期60 d的饲养试验,发现采集的鱼鳃样品中600 μg·kg-1的DON处理组中CAT与GPx4等抗氧化基因表达量相较于对照组显著降低,300 μg·kg-1的DON可造成组织的氧化损伤与抗氧化能力的降低。Ren等[17]向猪淋巴细胞的体外培养体系中添加不同浓度的DON,发现DON可显著或极显著降低CAT、GPx与GSH的蛋白表达水平,证实DON可诱导猪淋巴细胞的氧化损伤。Hou等[18]同样发现,DON可造成小鼠血清与肝内CAT等的表达量显著下降。上述研究结果与本研究结果一致,均显示DON毒性作用的分子机制可能是通过降低CAT和GPx4基因表达。已有研究者发现,DON的羟基官能团在代谢过程中会生成脂类,此代谢产物可与核糖体相结合,破坏核糖体正常功能的发挥,抑制蛋白质合成反应。此应激反应会影响细胞内一系列炎症细胞因子的表达,造成细胞超负荷氧化应激效应[19]。这与本研究发现DON破坏牛卵母细胞内氧化系统平衡结果相一致。因此,在牛卵母细胞的体外成熟培养液中适当添加抗氧化或许有助于缓解细胞内的超负荷氧化应激反应,从而降低DON对牛卵母细胞成熟及发育能力的损伤。
4 结 论
DON对牛卵母细胞体外成熟具有毒性作用,具体表现为抑制卵丘颗粒细胞扩展、影响线粒体在细胞质中正常分布、降低第一极体排出率及卵母细胞体外受精卵裂率及囊胚率,其作用机制与破坏牛卵母细胞内抗氧化系统的平衡相关。
