牦牛StAR基因克隆及其生物信息学与组织表达特性的研究
2021-09-27邬建飞卢建远字向东
刘 宇,邬建飞,李 恒,荆 天,卢建远,字向东
(西南民族大学 动物科学国家民委重点实验室,成都 610041)
Clark等[1]1994年从小鼠MA-10间质瘤细胞中首次发现类固醇激素合成急性调节蛋白(steroidogenic acute regulatory protein, StAR),并成功地完成了其纯化、前体cDNA的克隆和测序,证明了StAR蛋白对类固醇生物合成有重要调控作用。StAR存在于线粒体中,促进胆固醇由线粒体外膜向内膜转运,胆固醇的这种转运是类固醇合成的限速步骤,胆固醇进入内膜后再被CYP11A1基因编码的细胞色素 P450 支链裂解酶(P450 scc)催化生成孕烯醇酮[2]。孕烯醇酮作为类固醇激素的合成前体,其离开线粒体后,在不同组织中经过一系列的变化能够合成孕酮、睾酮、雌激素、醛固酮等类固醇激素。StAR基因在肾上腺皮质、睾丸间质细胞、卵巢颗粒细胞和膜细胞以及胎盘合体滋养细胞均有表达[3]。StAR基因的突变会导致先天性类脂肾上腺增生,患者肾上腺增大,大量的胆固醇无法转化为孕烯醇酮[4-5]。StAR蛋白的表达水平强烈影响睾丸间质细胞的睾酮生成,而且随着间质细胞老化,StAR蛋白的表达也会减少,衰老间质细胞线粒体内膜的胆固醇供应随之减少[6-7]。卵巢合成的类固醇激素是维持雌性第二性特征和生殖能力所必需的,有研究发现,StAR基因敲除小鼠的卵巢在出生时没有受到影响,但随着小鼠进入青春期,卵巢中的脂质继续积累,导致雌激素水平低,出现乳房发育不良和阴道出血等症状[8]。StAR基因在腔前卵泡数多的胎牛卵巢中的表达量要显著高于腔前卵泡数少的卵巢[9],黔北麻羊卵巢中StAR基因在高繁殖力组的表达量显著高于低繁殖力组[10],并且StAR基因在不同繁殖力品种的山羊卵巢中表达差异极显著[11]。目前,在猪[12]、牛[13]、斑马鱼[14]、绵羊[15]和禽[16]等动物上的研究证明,StAR基因可能与性腺的发育和繁殖性状密切相关。
牦牛(Bosgrunniens)主要生活在海拔2 500~5 500 m的青藏高原,能适应高原的极端恶劣气候条件,是青藏高原不可替代的主导畜种[17]。但是,与黄牛相比,牦牛繁殖性能低,属于季节性发情动物,主要集中在每年的6~10月发情,黄牛则是四季发情动物,其繁殖力远远高于牦牛[18]。StAR基因可能与动物繁殖力密切相关,但目前未见牦牛StAR基因研究的报道。因此,本试验拟通过克隆牦牛StAR基因并进行生物信息学分析,利用实时荧光定量PCR技术对StAR基因在不同组织、不同生长阶段和不同发情周期的卵巢、颗粒细胞中的表达特性进行研究,为进一步研究StAR基因在牦牛繁殖中的调控作用提供理论依据。
1 材料与方法
1.1 试验动物及样品采集
本次试验的样品均采自四川省成都市青白江唐家寺屠宰场,牦牛是来自于阿坝州牧区的麦洼牦牛。电击放血屠宰后,立即采样。样品包括:1)5头5~6岁 健康母牦牛心、肝、脾、肺、肾、卵巢、子宫和输卵管组织;2)牦牛胎牛、1岁龄左右和2岁龄左右黄体期卵巢各3头;3)5~6岁卵泡期和黄体期牦牛的卵巢各3头;4)3头5~6岁黄体期黄牛的卵巢;5)牦 牛颗粒细胞为本实验室前期冻存的细胞。使用灭菌后的剪刀采集组织,并用0.9%的生理盐水冲洗干净,迅速放入液氮罐中,带回实验室-80 ℃保存备用。
1.2 主要试剂和仪器
TRIzol Reagent和琼脂糖购自美国Invitrogen公司;RNA提取试剂盒购自北京天漠科技开发有限公司;cDNA反转录试剂盒、2×Taq PCR Master mix和PowerUpTMSYBRTMGreen均购自Thermo Scientific公司;DNA Marker DL2000购自GenStAR公司;E.coliDH5α感受态细胞和胶回收试剂盒购自成都擎科梓熙生物技术有限公司;克隆载体pMD19-T和氨苄青霉素购自宝生生物工程(大连)有限公司。
PCR仪(ETC811)购自苏州东盛兴业科学仪器有限公司;荧光定量PCR仪(CFX96)购自美国Bio Rad公司;琼脂糖凝胶成像系统(CL1000)购自Invitrogen公司。
1.3 RNA提取和cDNA合成
按RNA提取试剂盒的步骤提取RNA。使用紫外分光光度计检测RNA的质量,1%的琼脂糖凝胶电泳检测RNA完整性。按照反转录试剂盒说明书对RNA进行反转录,合成的cDNA-20 ℃保存备用。
1.4 StAR基因引物设计合成
由于未见牦牛StAR基因序列报道,所以根据NCBI中黄牛(Bostaurus)的StAR基因序列(NM_174189.3)和GAPDH基因序列(NM_001034034.2),使用Primer Premier 5.0软件设计克隆引物以及内参基因GAPDH荧光定量引物;再根据克隆获得的序列设计StAR基因的荧光定量引物(表1)。引物均由成都擎科梓熙生物技术有限公司合成。

表1 PCR和荧光定量PCR引物序列
1.5 牦牛StAR基因克隆与测序
采用卵巢合成的cDNA为模板进行PCR扩增,克隆StAR基因。PCR扩增体系25 μL:2×Taq PCR MasterMix 12.5 μL,上、下游引物各1 μL,cDNA 1 μL,ddH2O 9.5 μL。PCR反应程序:94 ℃预变性2 min;94 ℃变性30 s,退火30 s(退火温度见表1),72 ℃延伸1 min,共37个循环;72 ℃延伸5 min;4 ℃保存。
PCR产物用1%琼脂糖凝胶电泳检测,按照胶回收试剂盒说明书将胶回收和纯化。然后将回收产物与pMD19-T Vector连接并在16 ℃过夜,后转化DH5α感受态细胞,均匀涂于LB固体培养基(AMP+)上,挑取经37 ℃培养24 h过后呈白色的单菌落,接种于LB液体培养基(AMP+)中摇床6 h。菌液进行PCR鉴定,将鉴定结果呈阳性的样品菌液装袋送至成都擎科梓熙生物技术有限公司测序。
1.6 StAR基因生物信息学分析
牦牛StAR基因生物学分析工具及功能参见表2。

表2 生物信息学分析工具及相关功能
1.7 牦牛StAR基因表达特性分析
根据克隆获得的StAR基因设计的引物(表1),使用qPCR方法检测StAR基因在各个组织(心、肝、脾、肺、肾、卵巢、输卵管、子宫)及颗粒细胞中的表达水平。颗粒细胞由实验室前期冷冻保存,将其复苏并参考洪磊等[20]的方法进行体外培养(invitroculture,IVC),分别收集不同时期(0、12、24、36、48、60 h)的颗粒细胞。每个样品重复3次,用GAPDH作为内参基因校正基因的相对表达水平。qPCR反应体系15 μL:PowerUpTMSYBRTMGreen MasterMix 7.5 μL,cDNA 1 μL,上、下游引物各0.5 μL,ddH2O 5.5 μL。反应条件:95 ℃预变性3 min;95 ℃ 变性10 s,60 ℃退火30 s,39个循环;读取熔解曲线。
1.8 统计分析
本试验用2-△△Ct法计算基因相对表达量,使用SPSS 21.0软件的独立样本t检验和单因素方差分析法进行显著性检验,当P<0.05时,表示差异有统计学意义。
2 结 果
2.1 牦牛StAR基因克隆
以卵巢cDNA为模板,PCR扩增后,产物经1%的琼脂糖凝胶电泳检测,获得了与预期目的产物大小相符的片段(图1),表明本试验成功的扩增了牦牛StAR基因。测序得到StAR基因长度为1 156 bp,其中CDS长度为858 bp,共编码285个氨基酸。序列提交至NCBI,获得登录号:MW495047。

M.DNA相对分子质量标准; 1~3.StAR引物PCR扩增产物
2.2 牦牛StAR基因生物信息学分析
2.2.1 牦牛StAR基因核苷酸序列分析 使用DNAMAN 6.0软件将测定序列的CDS与黄牛StAR基因的CDS进行比较,发现了8个碱基突变,其中有3个导致了氨基酸的改变(表3)。牦牛与黄牛的StAR基因CDS同源性为99.07%。

表3 牦牛与黄牛StAR基因编码区序列差异
2.2.2StAR基因编码氨基酸序列同源性分析 使用DNAMAN 6.0软件对不同物种StAR蛋白氨基酸序列进行比对,结果显示,牦牛与黄牛(NP_776614.2)、绵羊(NP_001009243.1)、人(NP_000340.2)、猪(NP_998920.2)、原鸡(NP_990017.1)、斑马鱼(NP_571738.1)的StAR氨基酸序列相似性分别为98.95%、96.84%、87.37%、90.18%、65.96%、58.54%,说明StAR基因在进化过程中有较高的保守性(图2)。

黑色.同源性=100%;粉色.同源性>75%;蓝色.同源性>50%;白色.同源性<50%
2.2.3 牦牛StAR蛋白理化性质分析 使用ExPASy-ProtParam在线工具对牦牛的StAR蛋白进行分析,发现其蛋白分子式为C1398H2283N409O407S16,分子质量为31 845.96 u;StAR蛋白的氨基酸组成中亮氨酸(Leu)、丙氨酸(Ala)、谷氨酸(Glu)所占比例较高,分别为11.9%、8.4%、8.1%;带正电荷的(Arg+Lys)氨基酸总数为38,带负电荷的(Asp+Glu)的氨基酸总数为32,说明牦牛StAR蛋白带正电荷;理论等电点为9,表明StAR蛋白是碱性蛋白;在哺乳动物的红细胞中半衰期为30 h;脂肪族系数为93.75;平均亲水系数为-0.288,不稳定系数为39.99,表明StAR蛋白属于亲水稳定蛋白。
根据TMHMM2.0在线工具分析发现,StAR蛋白没有跨膜结构;使用Signal P 5.0 预测,结果表明,StAR蛋白不存在信号肽;使用PSORTII在线工具分析发现,StAR蛋白主要存在于细胞质(47.8%),也存在于线粒体(30.4%)、细胞核(13%)、细胞骨架(4.3%)、内质网(4.3%)。使用Net Phos 3.1在线工具分析,发现牦牛StAR蛋白有22个磷酸化位点,其中丝氨酸(Ser)磷酸化位点12个、苏氨酸(Thr)磷酸化位点6个、酪氨酸(Tyr)磷酸化位点4个。
2.2.4 StAR蛋白二、三级结构预测 使用SOPMA在线工具预测StAR蛋白二级结构,结果显示,α-螺旋占比为39.3%、延伸链占比为17.54%、β-转角占比为4.21%、无规则卷曲占比为38.95%(图3)。

h.α-螺旋;e.延伸链;t.β-转角;c.无规卷曲
使用SWISS-MODEL在线工具预测StAR蛋白三级结构,预测结果与二级结构预测结果基本一致(图4)。

图4 牦牛StAR蛋白三级结构预测
2.2.5 蛋白相互作用分析 根据STRING11.0在线工具分析发现,StAR蛋白可能与电压依赖性阴离子通道蛋白1(voltage dependent anion channel protein 1, VDAC1)、VDAC2、VDAC3、FIGLA、NR5A1、HSD17B6、POMC等蛋白有相互作用(图5)。

图5 StAR蛋白网络互作分析图
2.2.6 牦牛StAR基因系统进化树分析 从NCBI下载黄牛(NM_174189.3)、绵羊(NM_001009243.1)、山羊(XM_013975437.2)、小鼠(NM_011485.5)、大鼠(NM_031558.3)、猪(NM_213755.2)、马(NM_001081800.3)、狗(NM_001097542.1)、人(NM_000349.3)、斑马鱼(NM_131663.1)、原鸡(NM_204686.2)和黑猩猩(XM_001170375.5)12个物种的StAR基因序列。利用Mega 6.0 构建基因进化树,发现牦牛与黄牛首先聚为一类,其次与绵羊、山羊聚为一类,与斑马鱼亲缘关系最远,进化比较保守,且符合物种进化规律(图6)。
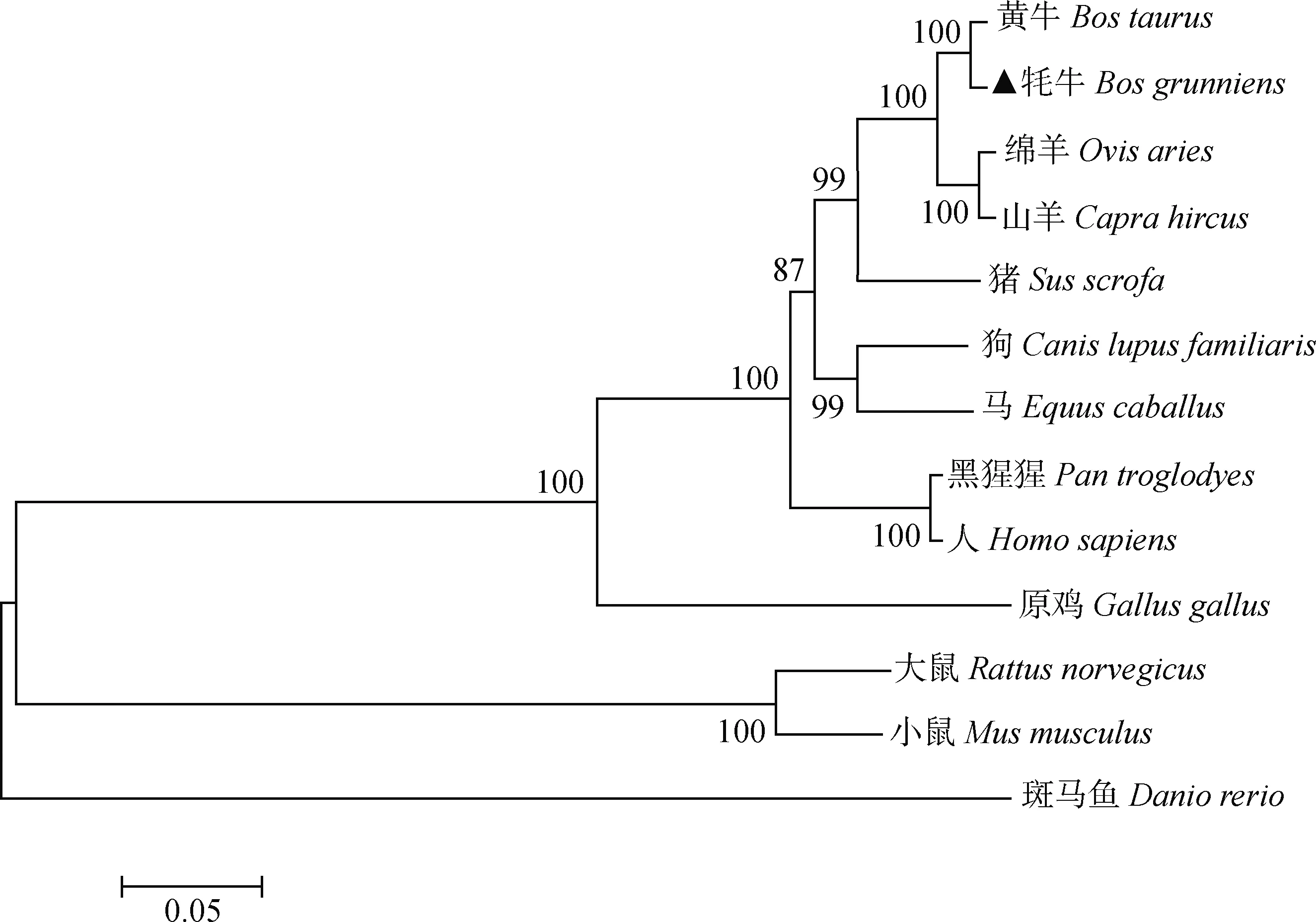
图6 StAR基因系统进化树
2.3 牦牛StAR基因表达差异分析
2.3.1 牦牛StAR基因在各个组织中的表达差异分析 使用qPCR检测StAR基因在心、肝、脾、肺、肾、卵巢、输卵管、子宫组织中的表达水平,结果显示,StAR基因在卵巢中高表达,极显著高于其他组织(P<0.01),在其他组织中表达均较低(图7)。

不同大写字母表示差异极显著(P<0.01)。下同
2.3.2StAR基因在卵巢的表达分析 使用qPCR检测StAR基因在胎牛、1岁左右、2岁左右(黄体期)牦牛卵巢的表达情况,结果显示,随着年龄的增大,StAR基因在卵巢中的相对表达量逐渐增加,各个时期之间差异极显著(P<0.01,图8A)。StAR基因在黄体期卵巢的表达要极显著高于卵泡期(P<0.01,图8B),在黄牛黄体期卵巢的表达要极显著高于在牦牛黄体期卵巢的表达(P<0.01,图8C)。

图8 卵巢StAR基因的相对表达水平
2.3.3StAR基因在颗粒细胞中的时序表达分析 利用qPCR检测StAR基因在体外培养颗粒细胞不同阶段的相对表达水平,结果发现,StAR基因的相对表达水平呈先上升后下降的趋势,在24 h达到最高,极显著高于其他时间段(P<0.01,图9)。

图9 StAR基因在颗粒细胞不同时序的相对表达水平
3 讨 论
StAR是类固醇生物合成的限速步骤,StAR蛋白在肾上腺、卵巢、睾丸、胎盘、脑的类固醇生成细胞中合成,影响一系列发育和生理过程,特别是在繁殖相关性状中具有重要的调控作用[4, 21-23]。StAR基因敲除鼠在卵巢上会出现脂质沉积聚集、基质细胞黄素化和卵泡的不完全成熟,最终导致卵巢早衰[8]。这些研究说明StAR基因在繁殖性状上有重要的作用。
为了探究牦牛StAR基因与繁殖性状的相关性及与黄牛StAR基因的差异性,本试验克隆了牦牛StAR基因,并获得了其完整的CDS,发现CDS全长858 bp,编码285个氨基酸。本研究发现,牦牛StAR蛋白共有22个磷酸化位点,早期的研究也表明,仓鼠StAR是一种磷酸化蛋白[24]。Artemenko等[25]还发现,StAR蛋白存在多种形式,StAR首先被合成为一个37 ku的前体,它被蛋白激酶A磷酸化,并在线粒体内被切割成30 ku大小的蛋白,并且磷酸化后的蛋白提供了主要的胆固醇转运机制。本研究发现,StAR蛋白主要存在于细胞质(47.8%)和线粒体(30.4%),这与Bose等[26]发现的StAR蛋白具有从线粒体外膜向内膜转运胆固醇的功能相符合。牦牛StAR蛋白氨基酸同源性比对和基因进化树分析结果显示,StAR基因与黄牛、绵羊、山羊具有较高的同源性,在进化上是比较保守的。Bauer等[27]对鱼类、两栖动物、鸟类和哺乳动物StAR的氨基酸序列进行了比较,也发现这种蛋白质在不同的脊椎动物群体中具有很强的保守性,与本研究结果一致。StAR基因的突变会导致类固醇缺乏症,影响睾丸和卵巢功能[5,8,23]。本研究发现。牦牛StAR基因的编码区与黄牛相比有8个碱基突变,其中有3个导致了氨基酸的改变,这种差异是否影响到牦牛StAR蛋白的功能,从而影响牦牛的繁殖性能需要进一步研究。另外有研究发现,在三级结构当中StAR蛋白存在一个StART结构域,在本研究结果的三级结构图中也能明显看到了该结构域,该结构是α/β类型的,含有1个九链反平行的β片层和4个α-螺旋,形成的长疏水通道可以结合1个胆固醇分子[28-29]。
根据蛋白互作网络图显示,StAR蛋白可能与VDAC1、VDAC2、VDAC3、FIGLA、NR5A1、HSD17B6、POMC等蛋白相互作用。VDAC是线粒体孔道蛋白,参与代谢物/离子的跨膜转运和许多细胞过程[30]。Bose等[31]发现,在肾上腺细胞中磷酸化的StAR与线粒体外膜上的电压依赖阴离子通道1(voltage-dependent anion channel 1, VDAC1)相互作用,从而促进了37 ku磷酸化StAR到32 ku中间体的加工。生殖细胞因子(factor in the germline alpha, FIGLA)是一种在生殖细胞中特异表达的转录因子,可以调控卵泡发育和编码透明带的相关基因,FIGLA基因的缺失明显阻碍了减数分裂的进展,并最终导致卵母细胞凋亡,另外干扰睾丸细胞中的FIGLA基因后,会上调StAR基因的表达[32-34]。核受体亚家族5组A成员1(nuclear receptor subfamily 5 group A member 1,NR5A1)基因编码的类固醇生成因子1(steroidogenic factor 1,SF-1)是一种转录激活剂,在调节正常生殖生理和内分泌功能上具有重要作用,控制肾上腺和性腺发育[35]。Sandhoff等[36]发现,大鼠StAR基因的启动子区域存在一个SF-1结合位点,对StAR基因的转录是至关重要。17β羟基类固醇脱氢酶6型(hydroxysteroid 17-beta dehydrogenase 6,HSD17B6)基因编码的蛋白质既具有氧化还原酶活性,又具有表异构酶活性,参与雄激素分解代谢,有研究发现,大鼠间质细胞在化疗药物的作用下会促进StAR基因的转录,抑制HSD17B6的转录,并伴随睾酮水平降低[37-38]。阿片黑素促皮质激素原(pro-opiomelanocortin,POMC)基因编码一种前原蛋白,可以产生多达10种的生物活性肽,促肾上腺皮质激素(ACTH)是其中一种,有研究发现,ACTH可以通过cAMP/PKA途径调控类固醇合成,促进StAR基因的表达[39]。从蛋白互作网络的分析结果可以发现,与StAR蛋白存在相互作用的蛋白主要参与类固醇激素合成和性腺发育的调控,猜测StAR基因与繁殖相关性状有很强的关联性。
对多个物种的研究表明,动物StAR基因的正常表达与繁殖性能密切相关[12-16]。本试验采用qPCR检测StAR基因的组织表达情况,发现StAR基因在牦牛的卵巢中表达量最高,有研究也发现,StAR基因主要在雌性动物的卵巢中表达,比如猪[12]、鸡[40]、斑马鱼[14]、鲈鱼[41]等。这些研究结果与StAR蛋白的功能及卵巢是类固醇激素主要来源的内分泌特性相吻合。牦牛StAR基因在脾、肺、输卵管、子宫有极其微量的表达,而在其他组织中不表达,但是刘倩等[42]在中华鳖中发现,StAR基因在脾脏和心脏中高表达,欧阳宏佳等[16]在水禽中检测到StAR基因在胸肌和腿肌中表达,说明该基因的表达具有一定的种属特异性。本研究发现,StAR基因在2岁左右牦牛卵巢表达最高,极显著高于胎牛和1岁左右的牦牛。欧阳宏佳等[16]发现,鹅睾丸中StAR基因的表达量在3岁时极显著高于52和1日龄,并且Michalovic等[43]发现,奶牛卵巢颗粒细胞中StAR基因的表达量在成年时极显著高于初情期前,说明随着年龄的增长,性腺逐渐发育完全其功能逐渐完善,睾丸与卵巢合成与分泌类固醇激素的能力也增强。StAR基因在牦牛黄体期的表达量极显著高于卵泡期,Jahromi等[44]在大鼠中也发现,StAR基因在发情间期(黄体期)的表达水平极显著高于其他时期,说明黄体期卵巢孕酮等类固醇激素的合成分泌增加与StAR基因的高表达有关。本研究发现,在黄牛卵巢黄体期StAR基因的表达量极显著高于牦牛。Prakash等[45]发现,在发情周期的8~12天(黄体期)黄牛的血浆孕酮水平显著高于牦牛,而毛宁等[46]发现,高产香猪组卵巢StAR基因表达量显著高于低产组,杨沛方等[10]报道,山羊在高繁殖力组卵巢中StAR基因的表达量显著高于低繁殖力组,推测StAR基因在牦牛和黄牛卵巢表达的差异性可能是导致两物种繁殖力差异的重要原因之一。StAR基因在牦牛颗粒细胞IVC过程中的相对表达水平呈先上升后下降的趋势,在培养24 h表达量最高(图9),这与牦牛卵母细胞体外培养18~24 h时达到成熟的结果一致[47-49],说明颗粒细胞StAR基因的表达与卵母细胞成熟有一定的相关性,对卵母细胞成熟具有重要的作用。
4 结 论
本研究克隆得到牦牛StAR基因CDS全长858 bp,编码285个氨基酸,主要在线粒体膜上发挥作用,在进化中和物种间比较保守。牦牛StAR基因主要在卵巢中表达,而且黄体期表达高于卵泡期,并且在体外颗粒细胞培养至24 h表达水平最高。提示,StAR基因可能在牦牛卵巢周期中参与繁殖调控。
