苗期及灌浆期抗Bipolaris sorokiniana叶枯病小麦品种(系)鉴定及相关性分析
2021-09-26李梦钰李巧云徐凯歌王丝雨牛吉山
李梦钰 高 闯 李巧云 徐凯歌 王丝雨 牛吉山
(河南农业大学/国家小麦工程技术研究中心,450046,河南郑州)
小麦叶枯病主要危害小麦叶片与叶鞘,是一种世界性的小麦病害[1-4]。近年来,随着全球气候变暖、栽培条件的改变以及矮秆小麦的推广,该病害在我国的危害日趋严重,发生范围已从东北和西北麦区等病害常发区域蔓延到黄淮、长江中下游和华南等小麦主产区[4],一般年份减产5%~20%,严重则减产50%以上[5]。叶枯病的病原菌种类较多,主要有麦根腐平脐蠕孢菌(Bipolaris sorokiniana)、雪霉叶枯菌(Gerlachia nivalis)、链格孢(Alternaria alternata)和壳针孢(Septoria tritici)等。不同地区其主要致病菌不尽相同,其中B.sorokiniana是较为常见的叶枯病致病菌之一,在我国南北麦区都有分布[6-8]。除引起叶枯病外,有些小麦叶枯病致病菌也是其他病害的致病菌,如B.sorokiniana还是小麦根腐病[9]和黑胚病[10-11]的致病菌,小麦被该病菌侵染后,不仅会因叶枯和根腐等引起减产[6],还会形成大量黑胚籽粒而影响小麦籽粒的外观,造成收购等级的下降[12],此外,感染B.sorokiniana黑胚病籽粒还有严重的毒素污染[13-14]。
目前,关于小麦叶枯病的发生与防控主要集中在栽培和药剂手段方面,无法从根本上解决问题,种植小麦抗病品种、实施小麦病害绿色防控和减少农药使用量是最重要的措施[15]。优异的抗病资源是小麦抗叶枯病育种的基础,而抗病性鉴定是其重要环节。受小麦生育期限制,大田灌浆期叶枯病抗性的接菌鉴定每年只能进行1次,要经过接菌、套袋和去袋等步骤,历时长且工作量大,而且容易受大田气象因子等环境因素的影响。本研究通过“孢子液喷洒和套袋(罩)保湿”方法分别在苗期(培养箱中)与灌浆期(大田环境)对130个小麦品种(系)进行接菌鉴定,筛选抗B.sorokiniana叶枯病的优异种质资源,为B.sorokiniana叶枯病抗性育种以及抗病机理的研究提供优异种质资源,并将大田灌浆期的抗性及苗期抗性进行相关性分析,以期为通过小麦苗期抗性预测大田灌浆期叶枯病抗性提供依据。
1 材料与方法
1.1 供试材料与设计
130个小麦品种(系)为本课题组(国家小麦工程技术研究中心小麦遗传育种课题组)收集的小麦品种或育种高代系。
材料于2019年10月在河南省荥阳市广武镇后王村的河南赛德种业有限公司育种站种植。每份材料种植2行,行长2m,行距20cm,株距3cm,人工开沟点播,采用随机区组设计,3次重复。浇水、施肥、虫害及草害管理同一般育种田。
1.2 致病菌与孢子液制备
致病菌为本课题组分离鉴定的B.sorokiniana强致病菌株Ta-BP33[10],分别于2019年10月(用于苗期鉴定)与2020年4月(用于灌浆期鉴定)进行孢子液的制备。
将冰箱保存的Ta-BP33在无菌条件下切下0.3cm2左右的小块,放置在直径9cm的培养皿中,皿中预先倒入马铃薯-葡萄糖-琼脂(PDA)培养基约10mL,置于培养箱中,在25℃下暗培养10~12d,待菌落变黑且布满分生孢子时取出。每皿加5mL灭菌蒸馏水,用载玻片轻轻将孢子刮下,用4层纱布过滤去除混杂的菌丝后,利用血球计数板计算孢子液浓度,最后浓度调整为5×104个/mL,于4℃冰箱保存备用。
1.3 小麦苗期B.sorokiniana叶枯病接菌鉴定
于2019年10月挑选供试小麦健康籽粒各60粒,在70%酒精中浸泡2min,进行表面灭菌,然后用无菌蒸馏水充分洗涤3~5次,放入直径9cm的培养皿中(提前加2层滤纸并灭菌),每个培养皿放置5份小麦材料,每份材料15粒种子,4次重复。
每个培养皿加4mL蒸馏水后放置在培养箱中,在25℃下暗培养3d,然后去掉培养皿盖子,加20mL蒸馏水后继续培养,条件为光照11h、25℃与黑暗13h、20℃交替进行再培养7d至幼苗一叶一心。
将制备好的孢子悬浮液用手动喷雾器均匀喷洒在幼苗叶片上,直至叶片上有液滴落下,对照(CK)使用无菌蒸馏水处理,然后罩上透明塑料罩保湿。25℃暗培养24h后,光照11h、25℃与黑暗13h、20℃交替培养9d,每天早晚2次在罩子内喷水保湿。
1.4 小麦灌浆期B.sorokiniana叶枯病接菌鉴定
用本课题组建立的“孢子液喷洒、套袋保湿”专利技术进行接菌鉴定[16]。于2020年4月中下旬选择花期一致、旗叶完好的分蘖挂牌标记,在开花后10d,16∶00后,将保存的B.sorokiniana孢子液摇匀后用喷壶均匀地喷洒在旗叶上,然后套袋保湿5d,每袋5片叶。根据河南省荥阳市的气象数据调查结果,2020年接菌鉴定期间(5月1日-15日),荥阳市最高气温在20℃~40℃之间,最低气温在14℃~22℃之间,平均相对湿度在24%~87%之间,其中有5d风力为3~5级。
1.5 小麦对B.sorokiniana叶枯病抗性评价方法
在接菌后第10天,目测幼苗第一片叶(苗期)或旗叶(灌浆期)的病斑面积占叶片总面积的百分比(病叶面积,diseased leaf area,DLA),并根据DLA进行抗性评价,分为5级:免疫无症状、高抗、中抗、中感和高感[17]。
1.6 数据分析
采用Excel 2000整理数据,利用SPSS 19.0进行相关性与回归分析。
2 结果与分析
2.1 不同小麦品种(系)B.sorokiniana叶枯病DLA变化
由表1可知,不同小麦品种(系)间叶枯病DLA变动较大,苗期DLA最小值8.9%(10M24),最大值79.2%(温麦10号),平均值38.8%;灌浆期叶枯病DLA最小值与最大值分别为11.2%(新麦13)和97.7%(天02-204),平均值54.9%。

表1 130个小麦品种(系)苗期与灌浆期B.sorokiniana叶枯病DLATable 1 DLA of 130 wheat cultivars(lines)inoculated with B.sorokiniana at seedling stage and filling stage %
2.2 不同小麦品种(系)对B.sorokiniana叶枯病抗性评价
按照叶枯病的5级抗性指标进行评价(表2),130个小麦品种(系)中,在苗期和灌浆期均无对B.sorokiniana叶枯病免疫的材料。苗期高抗品种(系)有2个(10M24和郑2062),占供试品种(系)的1.5%;中抗有40个(陕优225和品质所材料6等),占30.8%;中感有27个(豫优1号和山农737等),占20.8%;高感有61个(山农4143和温麦10号等),占46.9%。130个小麦品种(系)中,67.7%苗期感B.sorokiniana叶枯病。灌浆期无高抗品种(系),只有15个中抗品种(系),占11.5%;中感与高感品种(系)分别有19个(山农737和10M8等)和96个(豫优1号和山农4143等),感病品种(系)占88.5%。
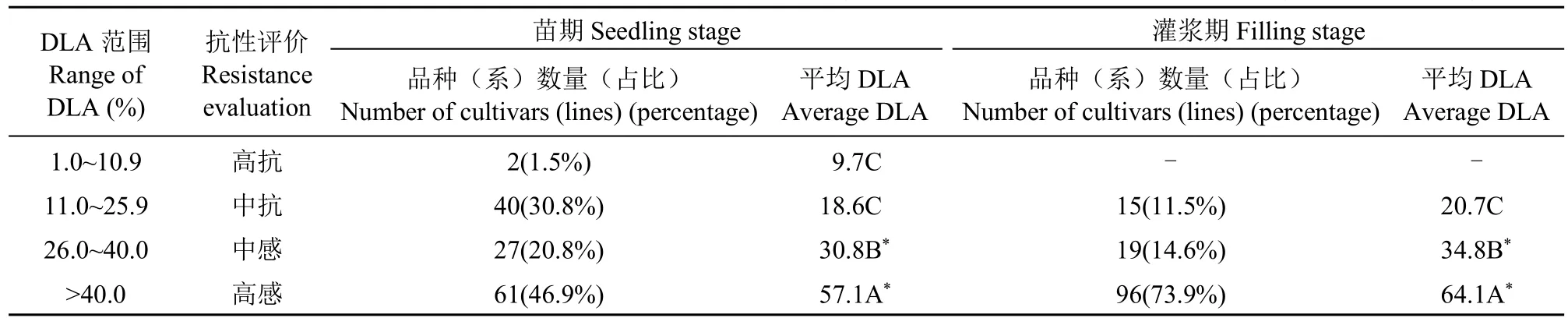
表2 130个小麦品种(系)在苗期与灌浆期对B.sorokiniana叶枯病的抗性评价Table 2 Resistance evaluation of 130 wheat cultivars(lines)to leaf blight caused by B.sorokiniana at seedling stage and filling stage
根据抗性评价结果,筛选出苗期与灌浆期均表现为抗病的小麦品种(系)12个,分别是新麦13、鄂麦170、10M24、郑麦132、中麦170、陕优225、10M23、宛原白1号、良星99、65498、济程2号与11YC173,其苗期与灌浆期平均DLA分别为17.4%与20.8%;筛选出山农4143、SP1777-6-8、PIC420、温麦10号和天02-204等高感B.sorokiniana叶枯病小麦品种(系)57个,其苗期与灌浆期平均DLA分别为58.1%与69.8%(表1)。
无论在苗期培养箱条件下,还是在灌浆期大田条件下,抗病小麦品种(系)接菌后均出现病斑,但是病斑扩展很慢,到第10天调查时还是小斑点,叶片其他部位呈现正常叶片的绿色(图1a和图1c),而感病小麦品种(系)被B.sorokiniana侵染后,病斑迅速扩大,在调查时,病斑连在一起,几乎整个叶片枯黄(图1b和图1d)。

图1 抗、感小麦品种(系)苗期与灌浆期B.sorokiniana叶枯病发病情况Fig.1 Performance of wheat cultivars(lines)resistant and susceptible to leaf blight caused by B.sorokiniana at seedling and filling stage
2.3 小麦苗期与灌浆期对B.sorokiniana叶枯病抗性的相关性分析
对小麦苗期与灌浆期B.sorokiniana叶枯病DLA进行抗性相关性分析,结果(图2)表明,苗期B.sorokiniana叶枯病抗性与灌浆期呈显著正相关关系,相关系数为0.72。回归分析的结果显示,小麦苗期B.sorokiniana叶枯病抗性与灌浆期抗性为线性回归,回归方程为y=0.76x+25.22。
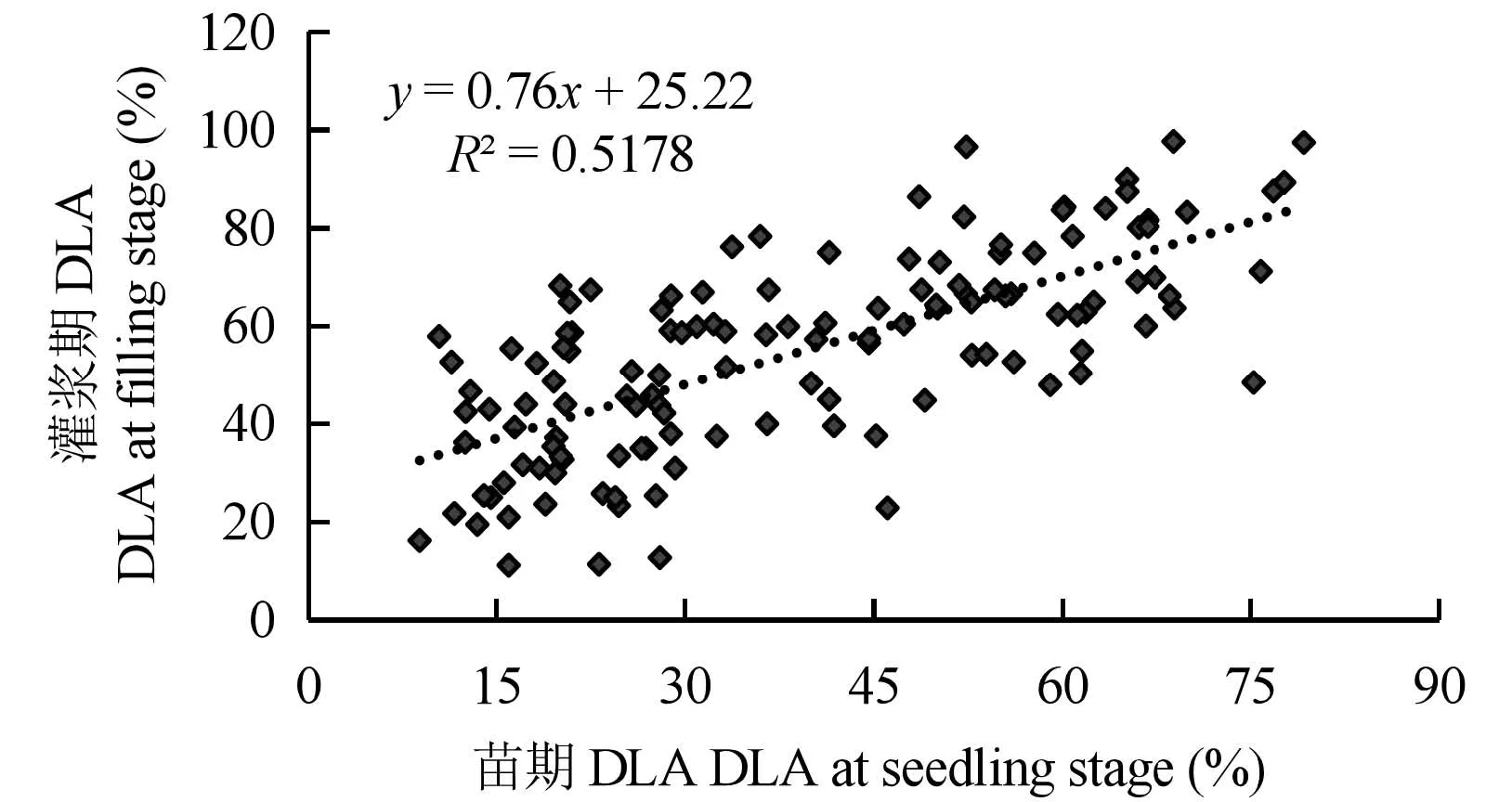
图2 小麦苗期与灌浆期DLA相关性分析Fig.2 Correlation analysis of disease leaf area(DLA)between seedling stage and filling stage
3 讨论
小麦叶枯病于20世纪70年代在河南地区有零星发生,80年代初发病面积逐年增加,到80年代中期已遍及全省大部分麦区,小麦产量受到严重影响,成为小麦生产上的重要病害[5,17]。B.sorokiniana是叶枯病主要的致病菌[6-8],而且该病菌还可引起其他的小麦病害[9-11]。培育抗病品种是从根本上解决小麦叶枯病的主要措施,而优异的抗病资源与表型鉴定是培育抗病品种的重要组成部分[18]。为给抗叶枯病小麦育种提供优异的抗源并为建立室内鉴定预测大田鉴定方法提供依据,本研究通过喷洒接菌的方法对130个小麦品种(系)进行苗期与灌浆期B.sorokiniana叶枯病抗性鉴定,苗期抗病材料(高抗、中抗)占供试品种(系)的32.3%,其中高抗材料只有2个,灌浆期无高抗材料,中抗材料仅占11.5%,在接菌鉴定的情况下,多数小麦材料感叶枯病,这与前人的研究结果[19-20]一致。如Mahto等[19]于2009-2010年在温室条件下,用B.sorokiniana对116份小麦种质资源进行苗期抗性接菌鉴定,仅有30%的供试小麦品系表现抗病。徐淑霞等[20]通过大田种植感病品种诱发的方法,对河南120份小麦品种进行成株期叶枯病抗性调查,其中抗病与感病品种分别为54%与46%。以上研究结果表明,在菌源充足且环境适宜的情况下,大部分小麦品系感叶枯病,叶枯病是危害小麦生产的重要病害。到目前为止,真正能保持稳定抗性的品种资源并不多[21]。
由于小麦叶枯病有多种致病菌,不同菌之间还可能存在互作[6-8],菌的侵染又受环境因素的影响[22-23],在自然大田条件下很难准确评价小麦品系对叶枯病的抗性,由于环境的不适宜或菌源的不充分,在大田自然条件下,通过DLA筛选的抗叶枯病品系未必真的抗病。如邢小萍等[24]于2005-2007年采用自然病圃法对河南省49份主栽小麦品种进行叶枯病抗性调查,其中80%以上的品种表现抗叶枯病,但是这些抗病品种有待于进一步接菌鉴定的验证。
大田条件下进行小麦抗叶枯病的接菌鉴定费时费力,鉴定结果还容易受环境因素的影响。本研究组对小麦苗期(第一片真叶)B.sorokiniana叶枯病抗性与灌浆期(旗叶)B.sorokiniana叶枯病抗性进行了相关性分析,发现二者呈显著正相关关系,这为通过苗期室内叶枯病抗性鉴定结果预测大田叶枯病抗性提供了依据。与大田鉴定相比,室内的苗期鉴定时间短且环境条件易于控制。如果能建立一种预测模型,通过室内快速准确的苗期鉴定预测大田的叶枯病抗性,将大大减少大田叶枯病抗性鉴定的繁重工作量,并提高结果的可靠性。
4 结论
通过接菌鉴定筛选出的12个在苗期与灌浆期都表现抗B.sorokiniana叶枯病的小麦品种(系),为开展小麦叶枯病抗性育种和抗病机理研究提供了优异的种质,苗期抗性与灌浆期抗性显著的正相关关系提供了根据苗期叶枯病叶面积预测小麦大田叶枯病抗性的思路。
