虾青素合成关键基因在烟草中瞬时表达及效应
2021-09-23王晓丹刘宝玲高宇陈莹李润植
王晓丹,刘宝玲,高宇,陈莹,李润植
(山西农业大学 农学院,山西 太谷030801)
现代农业的发展正加速传统“温饱型”农业向“健康型”功能农业的转变。利用传统的育种方法或基因工程的方式促进作物食用器官富集人类必需的营养素或高附加值天然活性物质,培育有效成分占比高且特异性好的功能型、营养型食材的生物强化研究逐渐成为广受关注的研究热点。通过生物强化培育功能型作物种质可从农产品供给侧给人类提供丰富营养以及保障人类健康[1],这是我国大健康战略实施的一个重要领域。
虾青素,3,3’-二羟基-β,β-胡萝卜素-4,4’-二酮基,属于叶黄素家族,是类胡萝卜素的含氧衍生物[2]。由于分子式两端的紫罗酮环上都存在羟基(OH)和酮基(C=O),使虾青素具有卓越而独特的抗氧化活性,对人体健康极为有益,在医药产业、化妆品、保健品以及水产养殖业中广泛应用[3]。自然界中天然存在的虾青素主要以全反式结构存在,其生物活性和可利用度大于顺式结构。雨生红球藻(Haematococcus pluvialis)是一类单细胞绿藻,可在细胞内高水平从头生物合成虾青素并进一步酯化形成虾青素单酯或双酯,储存于油体[4]。其他一些微藻、细菌和酵母也能合成一定量的虾青素,而大多数高等植物和动物不能合成虾青素。人体只能从一些海鲜(例如,鲑鱼、鳟鱼、贝类和虾等)中摄取虾青素。这些海鲜中的虾青素又是通过食物链从藻类中摄取并积累的。现今,规模化培养雨生红球藻生产虾青素的成本依然极高,其他产虾青素生物资源不足,限制着虾青素规模化生产及利用。
为扩大虾青素的绿色商业化生产,以及培育新型的功能型农作物,利用基因工程技术在高等植物食用器官组装类胡萝卜素合成通路生产天然高活性的虾青素是一个有效策略,且已初步在番茄和水稻等植物中获得了成功。研究发现,植物能在类囊体膜上积累类胡萝卜素并且在质体内的脂滴中以很高的浓度存在[5]。β-胡萝卜素是合成虾青素的前体物质,广泛存在于高等植物。虾青素是通过在β-胡萝卜素的β-紫罗酮环的4,4’和3,3’的位置添加酮基和羟基来合成。这个过程需要β-胡萝卜素酮化酶(4,4’-加氧酶;CrtW、BKT或CrtO)和β-胡萝卜素羟化酶(3,3’-羟化酶;CrtZ或BHY)的催化。植物普遍具有β-胡萝卜素羟化酶的活性,但不具备β-胡萝卜素酮化酶的活性(除了秋福寿草含有β-胡萝卜素酮化酶的活性)。所以,需要在植物中异源表达β-胡萝卜素酮化酶基因生产虾青素。例如,把雨生红球藻的BKT基因转入烟草的核基因组中,仅在蜜腺组织中发现了痕量的酮类类胡萝卜素[5]。将海洋细菌Paracoccus sp.的crtW和crtZ基因转入烟草的核基因组中,在叶片和蜜腺中都产生了酮类类胡萝卜素海胆酮而不是虾青素[6]。蓝藻的酮化酶CrtW和细菌的酮化酶CrtO,以及来自海洋细菌(Paracoccus sp.N81106和Paracoccus sp.PC1)的酮化酶CrtW都能催化玉米黄质生成虾青素,但效率差[7]。然而,将海洋细菌(Brevundimonas sp.,strain SD212)的酮化酶crtW和羟化酶crtZ基因直接导入烟草叶绿体基因组导致烟叶合成积累0.5%的虾青素(干重),并且总类胡萝卜素含量是野生型的2.1倍[8]。这预示着在叶绿体中组装合成虾青素途径可获得较好的效果[9~11]。已有研究指出,微藻的中莱茵衣藻(Chlamydomonas reinhardtii)的酮化酶BKT催化玉米黄质生成虾青素的活性高,生成的虾青素在类胡萝卜素中的占比高达85%[12]。通过叶绿体基因工程在西红柿中共同表达来自莱茵衣藻的β-胡萝卜素酮化酶BKT和来自雨生红球藻的β-胡萝卜素羟化酶BHY基因导致西红柿叶片大量积累游离虾青素(3.12 mg·g-1),在西红柿果实中则大量积累酯化虾青素(16.1 mg·g-1)[13]。
为此,本文选用控制虾青素生物合成的两个关键酶基因β-胡萝卜素酮化酶(BKT)和β-胡萝卜素羟化酶(BHY)为目的基因,在目的基因的5’端融合烟草的核酮糖-1,5-二磷酸羧化酶小亚基(rbcS)的转运肽序列,将目的基因定位到烟草的叶绿体中。在本氏烟草(Nicotiana benthamiana)叶片组织中瞬时表达鉴定这两个外源基因超表达的生物活性以及是否可促进烟叶虾青素合成积累。本研究为应用来自真核藻类的虾青素合成酶基因进行基因工程以在烟草等其他高生物量植物中组装富集虾青素合成途径,培育具有独特健康功能的新种质提供了重要科学基础。
1 材料和方法
1.1 植物材料和菌种
选用本实验室保存的本氏烟草进行瞬时表达检测。所有野生型和瞬时表达烟草植株均在人工气候箱中种植。人工气候箱控制温度(28±1)℃,光照4000 lx。利用本实验室保存的根瘤农杆菌(Agrobacterium tumefaciens,GV 3101)进 行 烟 草叶片侵染及目的基因的瞬时表达。
1.2 目的基因来源及表达载体的构建
依据参考文献[13]PBI-SlTpCr BKT表达载体为基本骨架载体,用烟草内源转运肽(NtTp)取代番茄转运肽(SlTp)分别构建来自雨生红球藻的HpBHY和来自莱茵衣藻的Cr BKT基因的表达载体,即表达载体PBI-NtTpCr BKT、PBI-NtTpHpBHY以及PBI-NtTpCr BKT+NtTpHpBHY共表达载体(图1)。

图1 目的基因表达载体构建示意图Fig.1 Diagrammatic showing the construction of expressing vectors
烟草质体转运肽(NtTp)依据公布的序列(GenBank No.MK070896.1)设计引物,PCR扩增烟叶的NtTp,测序鉴定无误后用于载体构建。依据莱茵衣藻Cr BKT基因的编码序列(GenBank No.AY860820),设计引物,高保真PCR扩增Cr BKT编码序列,测序鉴定无误后,用于表达载体构建。相似地,依据公布的雨生红球藻HpBHY编码序列(GenBank No.BD250390)设计引物,高保真PCR扩增各自的编码序列,测序鉴定无误后,分别用于各自表达载体的构建。
使用Cr BKT替代PBI121载体上原有的GUS序列,插入到载体的XbaI(5815bp)酶切位点和SacI(7715bp)酶切位点之间,并将原载体上的西红柿质体转运肽序列(SlTp)替换为相应烟草的质体转 运 肽(NtTp)功 能 序 列(GenBank No.MK070896.1)。将构建成的PBI-NtTpCr BKT载体的Cr BKT序列替换为Hp BHY编码序列(GenBank No.BD250390)即构建为HpBHY表达载体PBI-NtTpHpBHY。
双基因表达载体构建:扩增CaMV 35S::NtTpHpBHY::nos表达盒,插入PBI-NtTpCr BKT载 体 的ClaI位 点(4537bp)和Hind III位 点(4950 bp)之间,即获得共表达Cr BKT和HpBHY两个基因的表达载体PBI-NtTpHpBHY-NtTp-Cr BKT。烟草的转运肽(NtTp)、莱茵衣藻的β-胡萝卜素酮化酶(Cr BKT)和雨生红球藻的β-胡萝卜素羟化酶(HpBHY)基因编码序列均由通用生物系统(安徽)有限公司进行测序鉴定。
从美国国家生物技术中心(The National Center for Biotechnology Information,NCBI)下 载Hp BHY和Cr BKT相关的编码序列(CDS),通过使用ExPASy web服务器中的翻译工具(https://web.expasy.org/translate/)[14]翻 译 得 到HpBHY和Cr BKT的氨基酸序列。HpBHY和Cr BKT的蛋白结构域和开放阅读框的获得是利用在线分析软件,网址分别如下:http://smart.embl-heidelberg.de/;https://www.ncbi.nlm.nih.gov/orffinder/。
1.3 农杆菌GV 3101感受态细胞的制备
取-80℃保存的农杆菌菌株GV 3101,用LB液体培养基(含50μg·mL-1利福平)对菌细胞进行稀释,然后在固体培养基上划板,于28℃黑暗中倒置培养48 h。挑取单菌落培养于含50μg·mL-1利福平(Rif)的5 mL液体培养基中,培养箱设置:28℃,250 r·min-1培养16 h。取上述活化的菌液2 mL加入含50μg·mL-1Rif的50 mL液体培养基中进行扩大培养,培养条件同上,以使OD600达到0.5左右。室温下,5000 r·min-1离心5 min,收集菌体。向菌体中加入10 mL 0.15 mol·L-1NaCl(4℃),上下颠倒离心管以重悬菌体。室温下,5000 r·min-1离心5 min,再次收集菌体。向菌体中加入1 mL 20 mmol·L-1CaCl2(4℃,含15%甘油),上下颠倒离心管以重悬菌体,此时的农杆菌细胞为感受态细胞。把上述制备的感受态细胞以200μL分装在灭菌的1.5 mL离心管中,用封口膜封口后,保存于-80℃的超低温冰箱中。
1.4 农杆菌GV 3101感受态细胞的转化
1.4.1 转化前的准备
冰水浴、37℃水浴以及将抗性平板(含50μg·mL-1Rif和50μg·mL-1Kan)在28℃的培养箱中平衡至少15 min。
1.4.2 转化方法
取-80℃保存的农杆菌感受态细胞于冰水浴中融化。无菌条件下,向刚刚融化的感受态细胞悬液中加入2μg需要转化的质粒DNA,轻柔混匀。冰水浴中静置10 min。将离心管置于液氮中速冻5 min或置于-80℃放置10 min。迅速将离心管置于37℃水浴静置5 min,不要晃动水面。然后,快速转至冰水浴中静置5 min。加入800μL无抗生素的LB液体培养基,培养箱设置:28℃,175 r·min-1,黑暗中培养2~4 h,以使菌体复苏,表达抗性。室温下,5000 r·min-1离心1 min,收集菌体,保留100μL左右上清,轻轻吹打重悬菌体,均匀涂布到抗性的LB固体培养基平板上,待平板中的液体完全吸收后,倒置平板,28℃黑暗培养48~72 h。挑取单菌落培养于含1 mL LB液体培养基(含Kan)的1.5 mL无菌的离心管中,然后运用PCR技术检测农杆菌感受态细胞中是否转入目的质粒DNA。引物见表1。

表1 试验中使用的引物Table 1 Primers used in experiments
1.5 携带目的质粒DNA的农杆菌GV 3101介导的本氏烟草的瞬时表达
1.5.1 缓冲液的配置

表2 缓冲液的组成Table 2 Component content of the buffer单位:mmol·L-1
1.5.2 侵染烟草叶组织农杆菌的制备
携带目的质粒DNA的农杆菌GV 3101,28℃,黑暗条件,在含有50μg·mL-1Kan的LB液体培养基中培养,OD600达到0.5左右时,4℃,8000 r·min-1离心5 min,收集菌体。向菌体中加入灭菌的双蒸水上下颠倒混匀菌体,再次离心收集菌体。用缓冲液重悬菌体,把菌体的OD600值调整到0.2左右,室温黑暗中静置4 h。
1.5.3 农杆菌侵染烟草叶组织
选取至少有6片叶子(直径5 cm以上)的本氏烟草进行瞬时表达试验。利用无菌的注射器针头在烟草叶片背面主叶脉两侧各刺一个小孔(不能把叶片扎透),使用去掉针头的注射器把重悬于缓冲液的携带目的质粒DNA的农杆菌GV 3101通过刺的小孔缓缓注入烟草叶片中(图2)。
1.5.4 瞬时表达烟叶的检测
把试验烟草植株放回原来的人工气候箱中,在3 d时,收取试验叶片,液氮速冻后保存于-80℃的超低温冰箱,用于RT-PCR测定目的基因是否表达。引物见表1。选用烟草的核糖体蛋白(L25 ribosomal protein)(GenBank No.L 18908)为内 参基因[16]。在5 d时,收取试验叶片,剪下注射渗透范围的烟叶,使用冻干机-30℃条件下进行冷冻干燥,研磨后装入50 mL离心管,用封口膜密封,保存于4℃冰箱,用于虾青素等色素的测定。
1.6 烟草叶片RNA的提取及cDNA第一链合成
瞬时表达烟草叶片总RNA的提取,使用Ta-KaRa的RNAiso Plus(Total RNA提取试剂),按照说明书操作。把提取的RNA分成3份,分别用于超微量紫外分光光度计(核酸浓度仪)进行浓度测定及品质鉴定(OD260/OD280=1.7~2.1)、琼脂糖凝胶电泳的RNA质量鉴定(28s∶18s的条带亮度约为2∶1)和-80℃保存备用。
以提取的总RNA为模板,反转录成cDNA的第一链,按照反转录试剂盒(5×All-In-One RT Master Mix(with AccuRT Genomic DNA Removal Kit),abm)提供的说明书操作。
1.7 烟草叶片中色素的测定
取5 mg左右冻干的烟叶研磨样品,置于1.5 mL离心管中,然后加入1 mL二甲基亚砜(DMSO),离心后收集含有色素的DMSO上清至25 mL容量瓶,在黑暗中提取3次,最后用DMSO稀释至刻度。采用分光光度法测定虾青素等色素的浓度[17]。
虾青素含量的计算公式:

式中CA为虾青素的浓度,A530为530 nm处的吸光度值,m(mg)为冻干烟叶样品的重量。
叶绿素a含量的计数公式
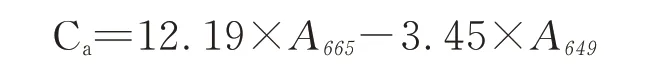
叶绿素b含量的计数公式
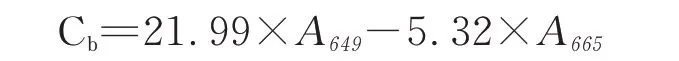
总类胡萝卜素含量的计数公式:
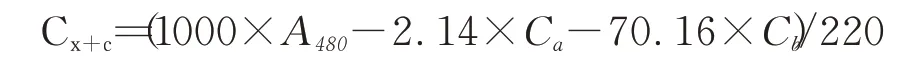
式中:Ca、Cb、Cx+c分别代表叶绿素a、叶绿素b和总类胡萝卜素的含量,单位是:μg·mL-1;
A 665、A 649、A 480分别代表使用分光光度计测定时在665、649和480 nm处的吸光度值。
1.8 统计分析
所有试验均进行3次生物学重复,表和图中的数据以平均数±标准差表示。所有数据采用SPSS 20统计软件(IBM Corp.,Armonk,NY,USA)分析。采用t检验来分析处理组和对照组的差异显著性,以*P≤0.05,**P≤0.01表示[18]。
2 结果与分析
2.1 携带有表达载体的阳性农杆菌的鉴定
提取候选阳性农杆菌的质粒DNA,分别应用目的基因的特异引物进行PCR扩增,鉴定获得携带有各目的基因表达载体的阳性农杆菌(图3)。用基因特异性引物PCR分别得到各目的基因片段,NtTpCr BKT(900 bp)、NtTpHpBHY(783 bp)和PBI121空载体序列(756 bp),表明各候选阳性菌株分别携带目的基因表达载体。这些阳性农杆菌进一步应用于后续的烟草叶片瞬时表达试验。

图3 携带有表达载体阳性农杆菌的PCR鉴定Fig.3 PCR identification of positive A.tumefaciens harboring the target gene expression vector
2.2 瞬时表达目的基因促进烟草叶片富集类胡萝卜素和虾青素
用携带重组植物双元表达载体(分别含目的基因NtTpHpBHY、NtTpCr BKT、NtTpHpBHY+NtTpCr BKT和PBI121空载体)的根瘤农杆菌GV 3101,通过注射法浸润接种本氏烟草(N.benthamiana),3 d后取材进行目的基因表达分析,5 d后取材进行色素含量分析。
提取侵染3 d的烟草叶片的RNA,反转录成cDNA,用特异性引物进行PCR扩增,结果(图4)显示,各目的基因相应条带都被准确扩增出来,说明HpBHY基因和Cr BKT基因在异源烟草叶组织中能有效表达。

图4 烟草叶片瞬时表达目的基因的半定量PCR检测Fig.4 Semi-quantitative PCR assay on the target gene expression in tobacco leaves injected by positive Agrobacterium
取侵染5 d后的本氏烟草叶片(图5),制备样品,使用分光光度计测定色素含量。结果(表4)显示,与瞬时表达空载体(对照组)相比,单表达PBINtTpHpBHY基因和单表达PBINtTpCr BKT基因的处理组,叶绿素a、叶绿素b明显增加(P≤0.05),而类胡萝卜素和虾青素的含量与对照组没有显著差异(P>0.05)。共表达PbINtTpHp B-HY+PbINtTpCr BKT基因的处理组,叶绿素a、叶绿素b、类胡萝卜素和虾青素的含量与对照组相比均显著提高(P≤0.05)。这些结果表明来自微藻的BKT和BHY基因可在异源烟草组织中有效表达且其编码的酶蛋白在异源宿主体内可行使催化类胡萝卜素和虾青素合成的功能。

表3 各处理组烟叶中色素含量Table 3 Pigment content of tobacco leaves in treated groups 单位:μg·mg-1
3 讨论与结论
本研究分别对来自莱茵衣藻的Cr BKT和来自雨生红球藻的Hp BHY酶基因利用本氏烟草叶片瞬时表达体系检测这两个基因能否异源高效表达以及催化虾青素合成的功能。研究结果显示,共表达HpBHY+Cr BKT基因的烟草组织的类胡萝卜素和虾青素含量,以及叶绿素含量均显著提高(P≤0.05)。有研究报道,在拟南芥和番茄中过量表达拟南芥的隐花色素CRY 1,均引起转基因植株的叶绿素、花青素和类胡萝卜素的增加[19]。与本研究相似的研究显示,在热应激(45℃)的条件下,共表达HpBHY+Cr BKT基因的转基因苔藓中,类胡萝卜素含量(特别是叶黄素含量)明显增加,但叶绿素含量则降低,导致植株耐热性增加,叶组织坏死减少[14]。本试验与转基因苔藓的叶绿素含量变化不一致,可能是不同物种以及不同的逆境条件造成的,也可能是本试验烟草在正常的条件下生长,没有受到高光等胁迫条件。但是,可以确定这两个目的基因在烟草中表达,尤其是同时表达HpBHY+Cr BKT基因,富集类胡萝卜素和虾青素效果显著。单转HpBHY或单转Cr BKT基因也能显著提高叶绿素积累(P≤0.05),但是,促进类胡萝卜素和虾青素积累效果未达显著水平(P>0.05)。空载体转化植株也表现出类胡萝卜素一定程度的上升,这可能是农杆菌对叶片造成的侵染损伤诱发的类胡萝卜素积累升高(图5)。显然,这些基因的异源超表达,促使宿主体内合成积累一些保护性色素物质,维持细胞正常生理活动,进而提高了植株应对逆境胁迫的能力。在苔藓的热应激试验中,已经证实HpBHY基因和Cr BKT基因参与异原宿主逆境保护反应[15]。前人通过对叶绿体遗传转化,在西红柿中共同表达这一对独特的酶(Cr BKT和HpBHY)导致西红柿的叶片和果实中分别大量积累游离和酯化的虾青素,并且使总类胡萝卜素增加16倍[13]。

图5 瞬时表达5 d的烟草植株Fig.5 Tobacco plants transiently expressing the target genes at 5 d of infection
过表达HpBHY基因的植株会导致叶黄素循环池(紫堇黄质和玉米黄质的可逆相互转化)的含量增加[15]。β-胡萝卜素的羟基化反应很可能是叶黄素生物合成的一个限速步骤[20]。因此,玉米黄质供应的增加会提高HpBHY+Cr BKT共表达植株的虾青素产量。
4 结论
本研究分别对来自莱茵衣藻的CrBKT和来自雨生红球藻的Hp BHY酶基因利用本氏烟草叶片瞬时表达体系检测这2个基因能否异源高效表达以及催化虾青素合成的功能。本氏烟草叶片瞬时表达结果显示,HpBHY和Cr BKT基因在烟草叶片组织中能高效转录表达,并且共表达HpBHY+Cr BKT基因的烟草组织的类胡萝卜素和虾青素含量,以及叶绿素含量均显著提高(P≤0.05)。与只表达CrBKT的植株相比,共表达Hp BHY+Cr BKT基因的烟草植株积累更高的虾青素含量,说明HpBHY基因有助于虾青素的积累。这些研究证明这2个来源于微藻的虾青素合成关键基因Cr BKT和Hp BHY可作为优异靶基因应用于在高等植物组装富集虾青素合成途径。
