G-四聚体和G-三聚体DNA在电化学生物传感中的应用
2021-09-11赵玲丽周颖琳张新祥
赵玲丽, 周颖琳*, 张新祥*
(北京分子科学国家研究中心,生物有机与分子工程教育部重点实验室,北京大学化学与分子工程学院,北京 100871)
1 前言
G -四聚体是由富鸟嘌呤(Guanine,G)的单链核酸通过Hoogsteen氢键折叠形成的特殊核酸高级结构,因其结构和功能的多样性,G -四聚体被作为一个多功能的信号元件,广泛应用于小分子、蛋白质,以及与疾病相关的特征核酸序列等与生命活动密切相关的生物标志物的分析检测[1 - 3]。近年来G -三聚体作为G -四聚体的折叠中间体被确认为一种新的核酸结构[4],它具有构成新型核酸分子探针的良好应用潜力[5,6]。
近30年来,电化学生物传感器因其响应速度快、易于小型化、成本低、选择性好、灵敏度高等优点受到越来越多的关注[7 - 9]。随着即时检测(Point-of-Care Testing,POCT)成为体外诊断的一大风向标[10,11],基于G -四聚体或G -三聚体的电化学传感器作为一种特殊的传感器件,受到研究人员的关注并得到了长足发展,为POCT体外诊断提供了新途径。本文主要针对G -四聚体和G -三聚体DNA在电化学传感中的应用进行简要评述,总结了此类电化学生物传感器在金属离子、有机小分子、核酸和蛋白大分子,以及酶活性等分析检测方面的最新研究成果。
2 G -四聚体和G -三聚体
2.1 G -四聚体
近年来,人们发现Watson-Crick双链结构的许多变体在一些细胞生命过程中起着关键的作用,例如发夹结构、十字形结构、平行双链结构、DNA三联体、G -四聚体和i-motif结构等。这些结构可以由分布在整个人类基因组中的核酸序列构成,它们的位置不是随机的,通常与人类疾病的发生息息相关[12]。这些特殊的核酸结构通常是在碱基堆积和氢键相互作用的稳定下,由一到四条链组成,并以各种非常规的配对方式存在。其中,G -四聚体吸引了研究人员的广泛关注。人类端粒末端富含鸟嘌呤的序列和原癌基因启动子序列都可通过折叠形成G -四聚体的拓扑结构。G -四聚体的结构由8个Hoogsteen氢键稳定的G -四分体平面堆叠组成,O原子居中定位于环中,形成一个阴离子双锥笼,可以与单价阳离子如Na+或K+配位[13 - 14],见图1。G -四聚体表现出丰富的拓扑结构多样性[15],它的结构与鸟嘌呤区的数量和长度、loop区的长度和连接方式、链的取向,以及溶液中金属离子的性质都密切相关。G -四聚体拓扑结构的多样性为小分子配体提供了变化多样的结合位点,这是G -四聚体被广泛应用于电化学生物传感器的重要基础。
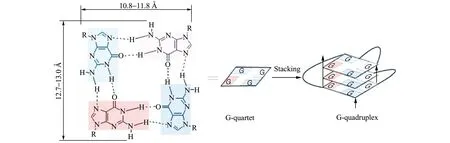
图1 G -四分体和G -四聚体的化学结构[16]Fig.1 Chemical structures of G -quartet and G -quadruplex[16]
2.2 G -三聚体
随着研究的深入,G -四聚体结构的重要性日益凸显,这促使人们进一步分析其折叠机制,并开始寻找新的涉及富鸟嘌呤序列多态性的结构。2013年,一种新的G -三聚体核酸结构,作为凝血酶适配体TBA(G -四聚体结构)的一个稳定的折叠中间体被Limongelli等[4]首次确定。该团队利用核磁共振波谱、圆二色光谱、差示扫描量热法等生物物理学研究手段,证实了该结构的存在,并表征了其结构和热力学性质。如图2所示,该新结构具有特殊的“G -三聚体”结构,是由一系列Hoogsteen氢键稳定的G∶G∶G三分体平面折叠构成的。G -三聚体一经发现就引起了人们极大的研究兴趣,其具备构成新型核酸分子探针的良好应用潜力。目前G -三聚体在电化学生物传感器中的应用方兴未艾。

图2 G -三聚体结构的示意图[4]Fig.2 Structure of G -triplex[4]
3 基于G -四聚体或G -三聚体的电化学传感器
G -四聚体和G -三聚体能被作为信号转导分子,这是由于G -四聚体和G -三聚体的折叠和去折叠对环境刺激有响应。第一类刺激物是K+、Cs+、Pb2+等金属离子,它们可以稳定G -四聚体的结构;第二类刺激物是小分子物质,如ATP和可卡因等;第三类刺激物是生物大分子,如核酸分子和蛋白质等。上述刺激物均可能是某些情况下人们感兴趣的检测目标,且不同的目标物会直接影响生物传感器中的G -四聚体或G -三聚体对目标物进行响应的机制。下面对基于G -四聚体或G -三聚体开发的电化学生物传感器进行介绍。
3.1 对金属离子的检测
多种一价和二价金属离子对G -四聚体和G -三聚体结构具有稳定作用。特别是某些富含鸟嘌呤的寡核苷酸序列对特定的金属离子具有很高的选择性。这些发现被用于开发基于G -四聚体或G -三聚体的金属离子电化学传感平台。Fu等[17]报道了一种基于DNA构象变化的电化学生物传感器,用于检测超痕量的稀土Tb3+。该团队将一段标记有巯基的富G序列固定在金电极表面,当Tb3+存在时,富G序列从柔性的单链结构转变为刚性的G -四聚体结构,G -四聚体的形成提高了Au电极表面的电荷密度,对带负电荷的铁氰化钾造成排斥,从而导致电化学响应信号的降低。该体系对Tb3+的检测范围为0.68~5.5 nmol/L,检出限为61 pmol/L。Liu等[18]受到K+对G -四聚体构象转换的诱导作用启发,建立了一个基于纳米通道的电化学平台,用于K+的快速检测。当目标分子被引入纳米通道时,固定在通道中的适配体折叠成G -四聚体结构。这种构象转换导致纳米通道中空间位阻的显著增加,从而导致纳米通道中的指示剂分子氢醌通量的降低。指示剂分子通量的变化可通过其在工作电极上的阳极电流进行监测,从而简单快速地实现对K+检测,检测范围为5~200 μmol/L,检出限为0.4 μmol/L。Li等[19]基于稳定的T-Hg2+-T相互作用,开发了一种简单、灵敏、无标记的检测Hg2+的电化学传感器。在目标分子存在下,富G序列被特异性识别并折叠成平行型G -四聚体结构,与氯化血红素(Hemin)形成具有过氧化物酶活性的DNA酶,从而触发H2O2介导的电化学氧化3,3,5,5-四甲基联苯胺。该体系对Hg2+的检测范围为100 pmol/L~100 nmol/L,检出限为33 pmol/L。Liu等[20]利用DNA四面体探针上的特异性DNA酶,开发了一种新型的Pb2+的电化学生物传感器(图3),在Pb2+的存在下,底物链被切割成两部分,释放出一段富G序列,随后形成G -四聚体/Hemin复合物,在H2O2的辅助下产生可检测的催化电流信号。三维DNA四面体调节了探针的密度和取向,改善了脱氧核酶反应,促进了电极表面界面受限空间内复杂的DNA构象变化,该生物传感器的检测范围为0.01~1 000 nmol/L,检出限为8 pmol/L。

图3 基于G -四聚体的电化学生物传感器检测Pb2+的示意图[20]Fig.3 Illustration of the Pb2+ electrochemical biosensor based on the G -quadruplex[20]
3.2 对有机小分子的检测
针对与生命活动密切相关的有机小分子等生物标志物,发展快速、廉价、灵敏和高选择性的检测方法是生物化学分析的重要课题之一,而基于G -四聚体或G -三聚体的电化学传感器为这一课题提供了新思路。
可卡因是一种从古柯植物的叶子中提取的生物碱,是一种与人类健康息息相关的小分子化合物。本课题组以可卡因为模型,发展了一系列基于G -四聚体或G -三聚体的电化学传感器。在医疗中可卡因被用作局部麻醉药或血管收缩剂,同时可作强效的天然中枢兴奋剂,但也因其对中枢神经系统的兴奋作用而导致滥用,成为世界性的主要毒品之一。2013年,Zhang等[21]报道了一种无标记、无固定化的均相电化学核酸适配体传感器。所设计的单链功能核酸序列包含了可卡因核酸适配体序列和G -四聚体序列,经过缓慢退火处理后,该功能核酸序列在溶液中形成茎环结构,其中双链互补的茎的部分包含了一部分核酸适配体序列和一部分G -四聚体序列。这一优势构象通过碱基互补阻碍了G -四聚体构象的形成。而在可卡因存在的条件下,可卡因与核酸适配体的亲和相互作用使得功能核酸的构象发生变化,茎的结构打开,释放出G -四聚体结构,与Hemin结合形成DNA酶,表现出过氧化物酶活性,催化氢醌和H2O2反应,产生可观测到的还原准稳态电流的变化。所使用的电化学装置由一次性枪头和可重复使用的碳纤维超微电极组成,可在微升水平的溶液中进行检测。该体系对可卡因的检测范围为1~500 μmol/L,最低检出浓度为1 μmol/L。亚甲基蓝(MB)是一种带有芳香结构的阳离子类吩噻嗪染料,本课题组首次发现其对G -四聚体DNA的亲和力高于对ssDNA或dsDNA的亲和力[22],是鲜有的能特异性结合G -四聚体的电活性探针。2014年,Zhang等以G -四聚体/MB复合物为基础,设计了核酸适配体/G -四聚体双功能核酸发夹结构用于可卡因的电化学传感器。在可卡因存在下,MB与被释放的G -四聚体作用,具有相比于双链DNA更强的结合力,从而引起MB的扩散电流的明显降低。该体系对可卡因的检测范围为5~1 000 μmol/L,最低检出浓度为5 μmol/L。该方法证实了G -四聚体/MB复合物作为一种有潜力的电化学探针,可用于均相免标记的电化学传感器的构建中。随后,该探针被广泛使用,发展为基于G -四聚体电化学均相分析的重要电化学指示剂用于miRNA的检测[23]、DNA逻辑门的构建[24]、甲基化转移酶活性的检测[25]等。2019年,为了探究G -四聚体与MB相互作用的关键部位,本课题组Zhao等[26]通过对前述G -四聚体核酸序列的截短,发现了一条与MB结合更加紧密的富G序列(G3)。与G -四聚体序列相比,该序列与MB结合后使得体系电流降低更为显著。我们证实了该序列可形成稳定的G -三聚体构型。进一步地,Zhao等以耦合了核酸适配体(作为目标识别元件)与G3(作为信号报告元件)的双功能核酸序列为基础,构建了可卡因的电化学传感器(图4)。与基于G -四聚体的传感器相比,该传感器不仅背景干扰更小,且信号响应更强,对可卡因的检测范围为0.1~1 000 μmol/L,最低检出浓度为0.1 μmol/L。

图4 基于G -三聚体的电化学生物传感器检测可卡因的示意图[26]Fig.4 Illustration of the cocaine electrochemical biosensor based on the G -triplex[26]
最近,Zhang等[27]利用G3/MB作为信号报告分子,结合微型一体化电极成功构建了检测三聚氰胺的均相、免标记的电化学传感平台。基于胸腺嘧啶(T)与三聚氰胺可以通过氢键形成“T-三聚氰胺-T”三联体结构这一规律,该团队设计了一种单链功能核酸传感器,起初G3序列和富T序列均被掩蔽在功能核酸形成的发夹结构中。当三聚氰胺存在时,它与T的结合会导致功能核酸发生构象变化,释放出G3,G3与MB生成复合物输出电信号。该方法对三聚氰胺的检测范围为100 μmol/L~2.5 mmol/L,检出限为100 μmol/L。
3.3 对核酸分子的检测
DNA和RNA在现代分子生物学中扮演着重要角色,因此核酸的检测意义重大[28]。灵敏、高选择性地检测核酸分子,对于基因治疗、突变分析和临床诊断均具有关键的指导作用[29 - 31]。G -四聚体和G -三聚体介导的电化学传感器具有稳定简便的优点,为核酸的检测领域提供了新的选择。
本课题组Nie等[32]发展了靶标促发的恒温指数放大反应(R-EXPAR),结合微电极小型化电化学设备的检测。R-EXPAR放大后的大量G -四聚体序列(约10-7~10-6mol/L)可以与Hemin结合形成DNA酶,通过DNA酶/氢醌/H2O2体系产生电化学信号。对信号报告基团G -四聚体进行检测发现,经R-EXPAR放大灵敏度可提高5个数量级。该策略被成功应用于对靶标DNA的灵敏检测,检测范围为5 pmol/L~1 nmol/L,最低检出浓度为1.7 pmol/L。这种无须标记、固定化的小型电化学检测具有操作简单、成本低廉、高重复性和可靠性的优势。该策略不只局限于核酸生物标志物的检测,若利用核酸适配体识别相应靶标,信号转换促发G -四聚体序列产生,亦可利用R-EXPAR急剧放大信号输出,实现对不同靶标小分子、大分子的灵敏检测。理论上讲R-EXPAR可以应用到任何以释放一条G -四聚体序列为信号报告基团的POCT检测中。本课题组Zhao等[33]以G3/MB为信号报告分子,构建了一种新型均相的无标记电化学传感平台,实现了对肿瘤标志物MicroRNA的灵敏检测。如图5所示,在该传感器中,首先通过一步核酸线性放大反应识别MicroRNA,并将痕量的MicroRNA转化为G3,进而借助恒温指数放大扩增反应在短时间内迅速扩增产生大量G3,其与MB形成G3/MB复合物作为报告分子输出电化学信号。该体系对MicroRNA的检测范围为1 fmol/L~10 nmol/L,最低检出浓度为0.45 fmol/L,并且可实现对MicroRNA单个碱基的区分。该工作成功地拓展了G -三聚体/MB作为一种高效、灵敏的核酸探针的应用范围,揭示了其作为一种生物传感探针在未来具有取代G -四聚体的应用潜力。此外这种便携、低成本、高效的电化学方法可能成为DNA-配体相互作用研究的一种强大工具。

图5 基于G -三聚体的电化学生物传感器检测MicroRNA的示意图[33]Fig.5 Illustration of the MicroRNA electrochemical biosensor based on the G -triplex[33]
3.4 对蛋白质和酶活性的检测
蛋白质在自然界中无处不在,是生命所必需的。在蛋白质组学时代,人们期望发现大量与疾病相关的蛋白质和酶的生物标志物,而蛋白质和酶的检测方法是认识、预防、诊断和治疗许多疾病不可或缺的工具。
Liu等[34]报道了一种竞争免疫分析法,检测微囊藻毒素-LR的无酶多重放大电化学传感器。微囊藻毒素-LR是指亮氨酸(L)和精氨酸(R)在两个可变位置。该团队将具有大比表面积的Au纳米树枝晶电沉积在ITO电极上,作为免疫传感器的基底来捕获抗原。随后,合成了内嵌有MB的单分散核壳结构的SiO2复合物作为免疫传感器的标记物,负载二抗用于免疫反应,同时修饰有DNA引物用于信号增强。当目标物存在时,两条辅助DNA链引发原位杂交链式反应,在SiO2复合物的表面形成双螺旋DNA,加入Hemin后,在其两侧形成大量的DNA酶。最后,将MB插入到形成的双螺旋DNA中,进一步提高检测信号。在MB的辅助下,所形成的DNA酶可以催化H2O2的还原,从而产生电流信号。该体系对微囊藻毒素-LR的检测范围为0.5 ng/L~25 μg/L,检出限为0.3 ng/L。Xiang等[35]利用Cu2+和焦磷酸(PPI)的配位作用,以及G -四聚体/Hemin纳米线对信号的放大作用,成功实现了对人体内酸性磷酸酶(ACP)的检测。Cu2+和PPI可以形成稳定的PPI-Cu-PPI化合物。PPI作为ACP的水解底物,可被水解成不能与Cu2+配位的磷酸根离子,从而抑制PPI-Cu-PPI的形成,并释放游离Cu2+激活电极上Cu2+-DNA酶的活性。进一步地,底物链发生催化裂解,释放出原本掩蔽在底物链中的富G序列,进而与溶液中游离Hemin发生结合,在电极表面生成G -四聚体/Hemin纳米线络合物。这种表面受限的Hemin有望在不涉及任何标记的情况下带来大幅放大的电流信号,从而实现对ACP的灵敏检测,检测范围为1~125 U/L,检出限为0.45 U/L。该方法还被成功应用于选择性地检测血清样品中的低水平ACP。
在对蛋白质和酶活性的检测中,G -四聚体除了作为信号报告分子,还可作为目标物的适配体参与识别过程,产生构象变化。如图6所示,Zhang等[36]基于此构建了一种结合凝血酶-适配体复合物的光驱动再生式电化学生物传感器。光致变色的偶氮苯基团能调控 G -四聚体结构的折叠和去折叠。电极上修饰了二茂铁(Fc)和偶氮苯标记的凝血酶适配体,在检测到凝血酶后,适配体序列识别目标物发生构象变化,折叠形成G -四聚体结构,3′端修饰的Fc与电极表面的距离缩短,Fc的电流信号增大。在紫外光照射下,插入适配体中的偶氮苯由反式结构转变为顺式结构,适配体结构变得松散,远距离阻断了Fc的电子传递,实现了适配体的再生。该体系对凝血酶的检测范围为5 pmol/L~5 μmol/L,检出限为3 pmol/L。
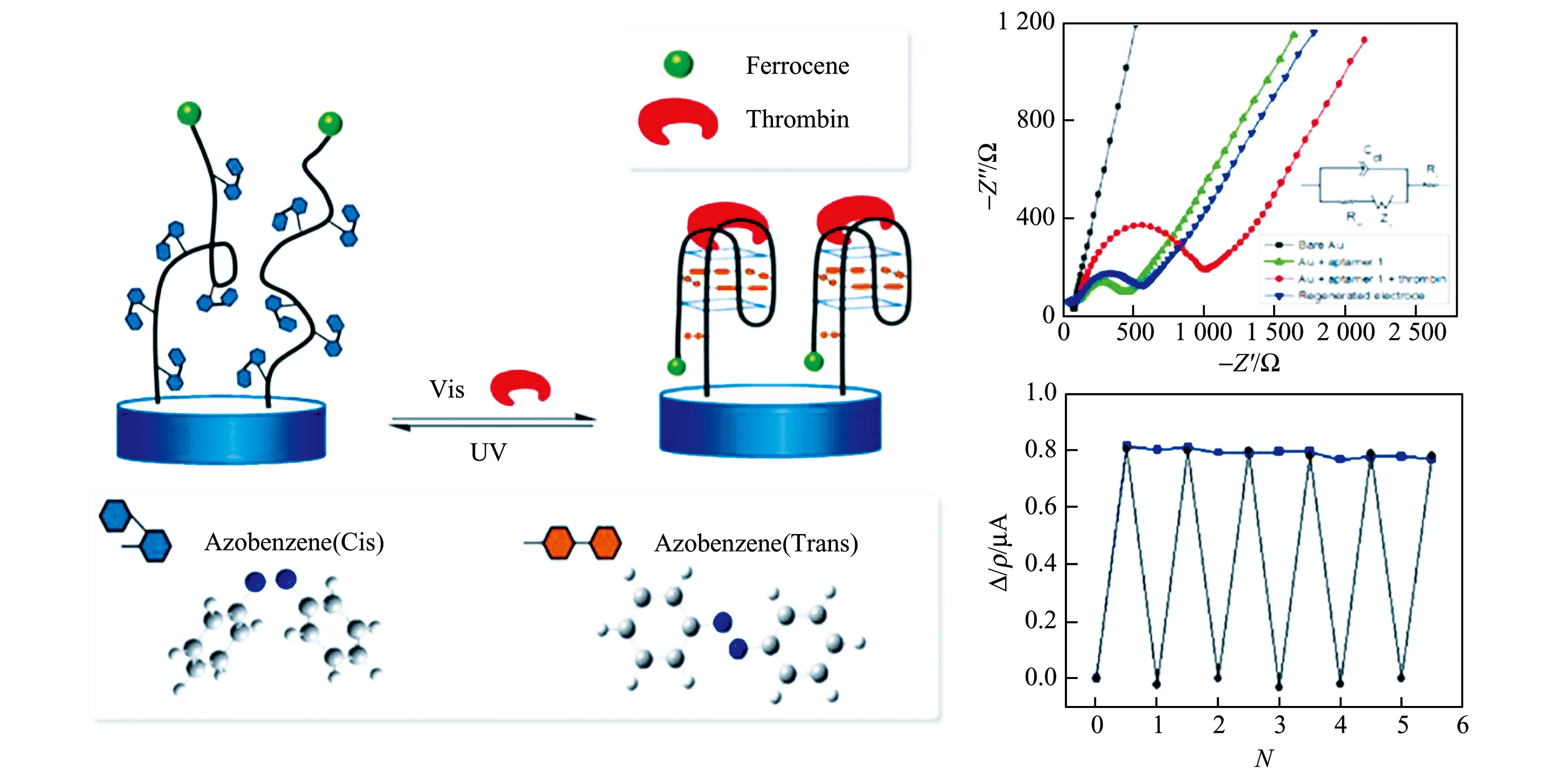
图6 基于G -四聚体的电化学方法检测凝血酶的示意图[36]Fig.6 Illustration of the thrombin electrochemical biosensor based on the G -quadruplex[36]
4 结论
本文主要综述了功能核酸分子G -四聚体和G -三聚体与电化学检测技术相结合构建的电化学生物传感器。在这些电化学生物传感器中,G -四聚体和G -三聚体能够将生物识别事件转换成各种读出信号,实现对与生命活动相关的小分子、蛋白质以及与疾病相关的特征核酸序列等生物标志物的分析检测。此类生物传感器具有快速、灵敏、低成本和能够便携检测生物或化学分子的优势,在检测中表现出巨大的应用潜力,并为POCT体外诊断提供了新途径。
同时,我们也必须认识到这些基于G -四聚体和G -三聚体的电化学传感器仍然存在一些局限性。首先,除了有限数量的金属离子和蛋白质外,并不是所有的金属离子都能被检测到。为了将基于G -四聚体和G -三聚体的技术推广到更广大的领域,必须使用其他综合生化策略对其进行优化和改进。其次,这些传感策略的信噪比仍有很大的提高空间。最后,因G -三聚体较差的结构稳定性,迄今为止已报道的基于G -三聚体的电化学传感器还非常有限。本综述介绍了部分基于G -四聚体和G -三聚体的电化学检测平台,但其应用的范围肯定远不止于此,本领域的研究仍然大有可为。
