苦丁茶中绿原酸及其异构体的提取变化分析
2021-09-10林春松黄青云张雪芹刘鸿洲徐夙侠
林春松,黄青云,张雪芹,刘鸿洲,陈 淳,徐夙侠
(福建省亚热带植物研究所/福建省亚热带植物生理生化重点实验室,福建 厦门 361006)
绿原酸(Chlorogenic acid)即 3-咖啡酰奎尼酸(3-caffeoylquinic acid,3-CQA),是由咖啡酸(Caffeic acid)的羧基与奎尼酸(Quinic acid)的 3-羟基酯化形成的羧酚酸。其异构体通常泛指由奎宁酸与数目不等的咖啡酸通过酯化反应缩合而成的有机酸类天然成分,这类物质是植物体内有氧呼吸过程中经莽草酸途径产生的一种苯丙素类次生代谢产物,广泛存在于植物界中[1—2]。
由于咖啡酸与奎尼酸结合位置和结合数量的不同,理论上咖啡酰奎尼酸具有四种异构体,而二咖啡酰奎尼酸具有六种异构体。目前,在植物中发现的绿原酸类异构体主要包括绿原酸、新绿原酸(5-caffeoylquinic acid,5-CQA)、隐绿原酸(4-caffeoylquinic acid,4-CQA)、异绿原酸 A(3,5-dicaffeoylquinic acid,3,5-diCQA)、异绿原酸B(3,4-dicaffeoylquinic acid,3,4-diCQA)、异绿原酸C(4,5-dicaffeoylquinic acid,4,5-diCQA)和分布较窄的洋蓟素(Cynarin)(1,5-dicaffeoylquinic acid,1,5-diCQA)[3]。
苦丁茶(Ilex kaushue)又名扣树,是广西民间广为习用的苦丁茶的原植物。值得注意的是,该种于1981年被误订的学名Ilex kudingcha C.J.Tseng在诸多文章中出现[4],现与扣树合并[5],在《中国植物志》和Flora of China中,Ilex kudingcha C.J.Tseng均作为Ilex kaushue S.Y.Hu的异名处理[6—7]。苦丁茶也是传统的药用植物,具有诸多保健作用,如减肥、调节肠道微生物、抗炎、抗氧化、抗癌,预防胃损伤、神经损伤和代谢紊乱等[8—13],其主要活性成分是含量较高的多酚类物质。苦丁茶中绿原酸类(CQAs)占多酚类成分的90%以上[14]。苦丁茶也因绿原酸类成分含量高被称为“绿原酸茶”[15]。如今,越来越多的证据表明,绿原酸类成分具有抗菌抗炎、抗病毒、抗氧化、肝保护、减轻糖尿病、抗组胺、抗癌、神经保护及其他生物学效应[16—21]。
然而,正由于咖啡酸对奎尼酸的结合位置和结合数量的不同,绿原酸及其异构体在功能上也有较大的差别,异绿原酸A抗胃癌作用突出[21],同时不仅能高效抑制HIV-1整合酶,还能抑制HIV-1在组织中的复制[22];异绿原酸B抗乳腺癌,能抑制人乳腺癌细胞 MCF-7的生长和增殖[21];而异绿原酸 C抗氧化能力明显强于其他异构体[3]。绿原酸类异构体以其丰富的生物活性功能,可分别应用于食品、医药、日用化工工业等。绿原酸及其异构体通常以混合形式存在于植物中,苦丁茶包含了植物中分布的6种主要绿原酸类异构体:绿原酸、新绿原酸、隐绿原酸、异绿原酸A、异绿原酸B、异绿原酸C。为了深入开发利用植物中的绿原酸类成分,需对其进行提取纯化。在报道的纯化制备工艺流程中,一些研究关注到提取的溶剂、温度、时间等因素对绿原酸类成分总量的影响[1—2,23],但对其异构体成分的变化少见报道。绿原酸类成分为不稳定的极性有机酸,在提取过程中易发生异构化,其异构化机理尚不清楚。
本研究以苦丁茶为材料,用甲醇、乙醇、丙酮和水等4种常用溶剂与超声波提取、水浴提取、回流提取等相结合,考察不同溶剂和提取方法对绿原酸类成分的提取效率及各异构体含量的影响,可为植物源绿原酸类成分提取提供参考,也为进一步研究绿原酸异构体的转变机理提供材料。
1 材料与方法
1.1 材料
1.1.1 材料与试剂
苦丁茶购自广西林业科学研究院。
新绿原酸标准品购自 Sigma-Aldrich(美国密歇根州圣路易斯),3-CQA、4-CQA、3.5-diCQA、4.5-diCQA、3.4-diCQA 和咖啡酸购自成都Mann-Stewart生物技术有限公司(中国成都)。甲醇(分析纯,吉安豪迈精细化工实业有限公司),乙醇(分析纯,西陇科学股份有限公司),丙酮(分析纯,上海化学试剂厂),甲酸(分析纯,上海麦克林生化公司),乙腈(色谱纯,Tedia公司,美国)。
1.1.2 仪器与设备
Waters Acquity UPLC仪(包括 Waters Acquity BEH C18色谱柱、自动进样器、Binary溶剂管理系统,二极管阵列检测器DAD,柱温箱和化学工作站)。Milli-Q Direct 8 水纯化系统(法国),BS124S、BS423S Sartorius电子天平(德国),SB25-12DTD超声波清洗机(宁波新芝生物科技股份有限公司),DK-80型电热恒温器(上海精宏实验设备有限公司),KDM型调温电热套(山东华鲁电热仪器有限公司)。
1.2 方法
1.2.1 苦丁茶中绿原酸类成分提取
将同一批苦丁茶粉碎过80目筛,放入4 ℃冰箱冷藏备用。
1.2.1.1 超声波提取(a)
溶剂分别为甲醇(100%、70%、50%、40%),乙醇(100%、70%、50%、40%),丙酮(70%、50%)和水,称取0.4 g过筛的苦丁茶放入10 mL离心管,加入8 mL溶剂,超声波设置400 W、30 ℃、30 min,超声过程中人工摇匀2次,放置2 h,再超声30 min。补足超声处理过程中损失的溶剂后摇匀,过滤待测。
1.2.1.2 水浴提取(b)
溶剂分别为甲醇(100%、70%、50%、40%),乙醇(100%、70%、50%、40%),丙酮(70%、50%)和水,精确称量2 g过筛的苦丁茶放入具塞三角烧杯中,分别加入40 mL溶剂。为提高提取效率,水浴温度设置为靠近提取溶剂的沸点。提取溶剂为甲醇时,水浴温度60 ℃;提取溶剂为乙醇时,水浴温度75 ℃;提取溶剂为丙酮时,水浴温度55 ℃;用水为溶剂提取时,水浴温度80 ℃。水浴提取2 h,每30 min摇匀一次。补足水浴过程中损失的溶剂后再次摇匀,过滤待测。
1.2.1.3 回流提取(c)
溶剂分别为 70%甲醇、70%乙醇、40%乙醇、70%丙酮,分别称量 100 g过筛的苦丁茶,加入1000 mL溶剂回流提取1.5 h,过滤后向滤渣中再加入1000 mL相应溶剂回流1.5 h,过滤后合并滤液,减压旋蒸浓缩,冷冻干燥,40倍液溶解后过滤待测。
1.2.2 绿原酸类成分的UPLC检测
色谱柱为 Waters Acquity BEH C18柱(2.1 mm×50 mm,1.7 µm),柱温35 ℃,流动相A为0.1%甲酸,流动相B为乙腈,流速0.3 mL·min-1。洗脱条件:0~5 min,A相由90%线性变化为80%;5~9 min,A相80%线性变化为60%;9~12 min,A相由60%线性变化为90%。DAD检测器,检测波长326 nm。
2 结果与分析
使用UPLC仪及优化的色谱条件,6个绿原酸类成分及咖啡酸在6 min内完成分离,标准品及部分提取样品的色谱图见图1。
在超声波提取中,使用甲醇溶剂时,70%、50%、40%甲醇的提取效率较接近,提取的绿原酸及其异构体相对比例变化小,其总绿原酸类成分以70%甲醇提取量稍高,达177.96 mg·g-1(表1)。而用乙醇溶剂时,各浓度乙醇提取效率均较低,其中40%乙醇提取量稍高,总绿原酸类成分为93.24 mg·g-1。这可能是在30 ℃较低温度时,各浓度乙醇对苦丁茶材料的浸润性低于其他溶剂,尽管有超声波辅助,对绿原酸类成分的提取效率仍然较低。用丙酮提取时,两种浓度的丙酮提取效率都较高,结果相近,其中70%丙酮提取时,总绿原酸成分为 197.87 mg·g-1,异绿原酸A达101.35 mg·g-1。用水提取时,总绿原酸类成分为 132.56 mg·g-1,异绿原酸 A 65.72 mg·g-1,游离咖啡酸含量在所有样品中最高,为1.30 mg·g-1,这可能是在超声波水提条件下,绿原酸类成分的水解作用最强。
在水浴提取中,使用甲醇溶剂提取时,各浓度甲醇溶剂的提取效果较为接近,70%浓度仍能获得较好的效果,总绿原酸成分达177.94 mg·g-1,其中异绿原酸A含量最高(90.39 mg·g-1);使用乙醇溶剂时,40%浓度提取效果较好,总绿原酸类含量为170.33 mg·g-1,异绿原酸 A 为 68.77 mg·g-1;70%和50%丙酮都有较好的提取效果,总绿原酸类分别可达 200.96 mg·g-1和 191.39 mg·g-1;用水作溶剂提取时,总绿原酸类成分为124.97 mg·g-1,其中异绿原酸A含量较其他提取方法低,为32.22 mg·g-1,而异绿原酸B及隐绿原酸达最高,分别为16.96 mg·g-1、7.91 mg·g-1,在图1:I中能看到明显差异。
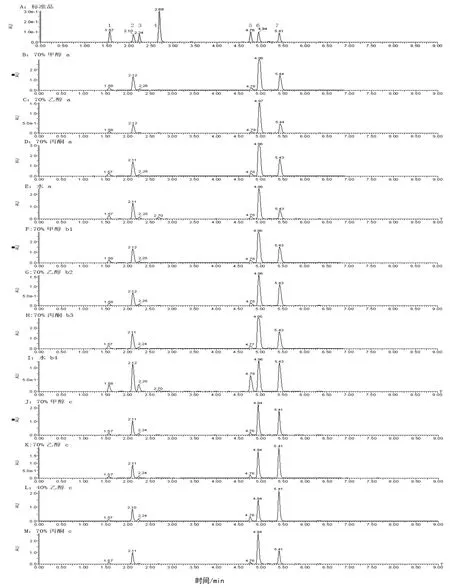
图1 部分测试样品的UPLC谱图Fig.1 Ultra Performance Liquid Chromatographys of partial samples
在回流提取中,由于苦丁茶经水沸提取后粘稠度高极难过滤,因此本实验未考察苦丁茶的水沸煎煮提取。在甲醇、乙醇和丙酮提取溶剂中,100 g苦丁茶样品经70%甲醇溶剂回流提取,冷冻干燥后得粗提物41.6 g,70%乙醇、40%乙醇、70%丙酮回流提取100 g样品干燥后分别得粗提物42.77 g、40 g、42.43 g,40倍溶剂溶解后测试计算各绿原酸类成分含量。UPLC图谱分别见图1:J~M。由表1数据可见,70%甲醇、70%乙醇、40%乙醇、70%丙酮4种溶剂回流提取的绿原酸类成分的总量较为接近,分别为 197.26 mg·g-1、190.26 mg·g-1、176.44 mg·g-1、194.65 mg·g-1,但绿原酸及其异构体相对含量差别较大。在回流提取的绿原酸类成分中,异绿原酸A和异绿原酸C是最主要的两种异构体,不同提取溶剂中两异构体的含量之和较为接近。回流使用的溶剂按所提取的异绿原酸A的含量从高到低顺序为70%丙酮(102.54 mg·g-1)、70%甲醇(82.71 mg·g-1)、70%乙醇(66.54 mg·g-1)、40%乙醇(51.75 mg·g-1)。而就异绿原酸C的量而言,这个顺序正好相反,依次为40%乙醇(72.49 mg·g-1)、70%乙醇(72.34 mg·g-1)、70%甲醇(58.32 mg·g-1)、70%丙酮(38.24 mg·g-1)。这两个异构体各自的含量在4种溶剂提取后差异很大,而其含量之和却较为接近,提示这两个异构体之间存在大比例的转换。
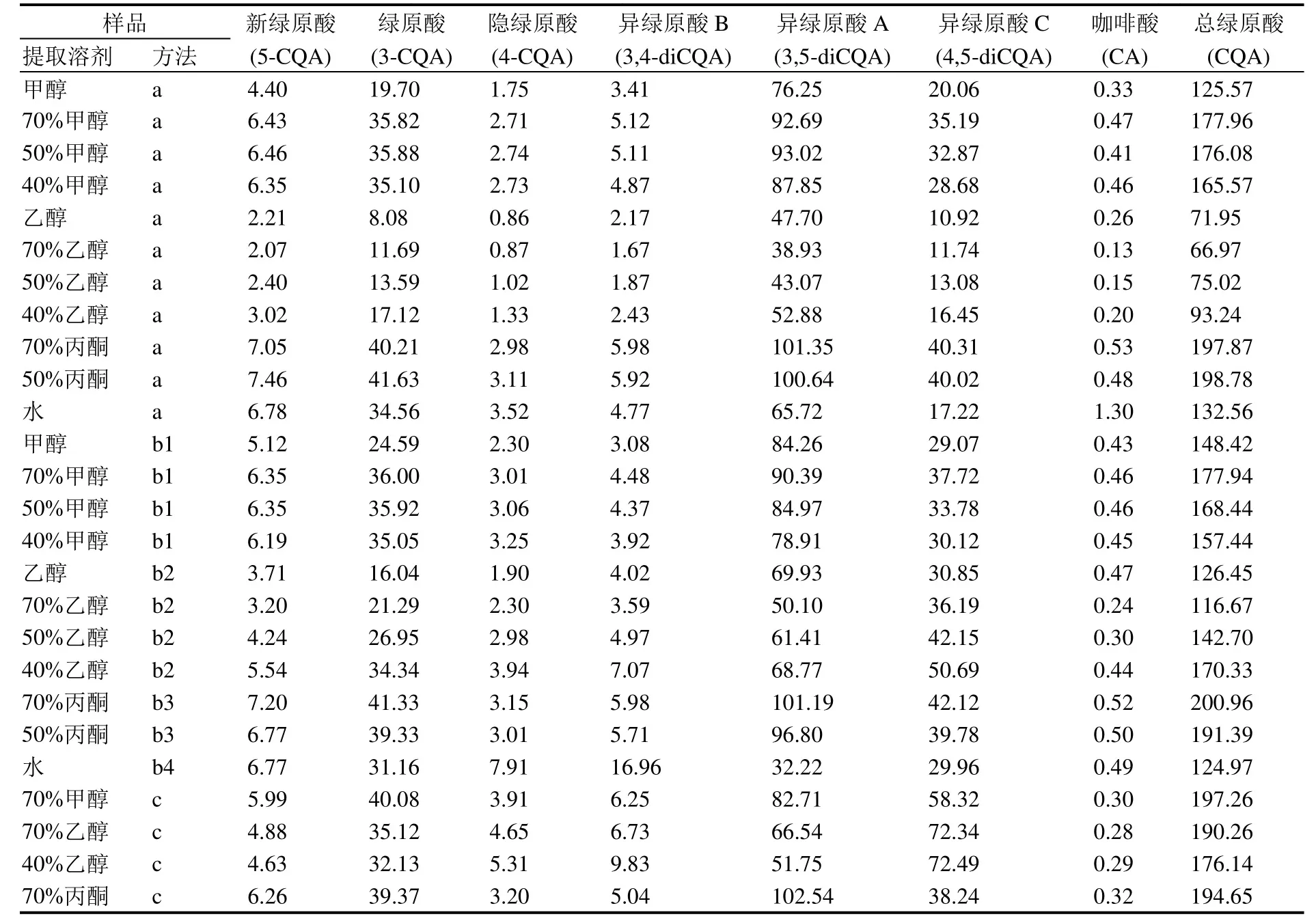
表1 不同溶剂、方法提取苦丁茶中绿原酸类成分含量(mg·g-1)Table 1 Contents of chlorogenic acids in Kudingcha extracted by different solvents and methods (mg·g-1)
从本研究的数据分析,相对于丙酮溶液提取,70%甲醇、70%乙醇、40%乙醇的回流提取过程中,异绿原酸A和异绿原酸C的量发生了明显的此消彼长变化,表明在加热的醇溶液中异绿原酸A转化成异绿原酸 C。而其他成分的变化相对总的绿原酸成分变化较少,尚不能得出明确的转化关系。
3 讨论
大量文献报道了对苦丁茶绿原酸类成分的HPLC测定,本研究采用UPLC缩短了分离时间,苦丁茶中6种绿原酸类成分及咖啡酸可在6 min内实现分离。
绿原酸及其异构体为不稳定的极性有机酸,易发生结构变化[24]。在205 ℃烘焙条件下,咖啡的7种绿原酸类成分在 7 min时约有 60%损失,而在19 min时,损失近100%。Dawidowicz等[25]研究发现,在设定的加压高温条件下(100~200 ℃),5-咖啡酰奎宁酸在水溶液加热过程中有多种产物出现,在 100℃时有单咖啡酰奎宁酸异构体出现,而在135 ℃以上时,出现极少量的异绿原酸C。在常用的回流加热过程中,反式-5-咖啡酰奎宁酸在甲醇、乙醇、丙醇及其水溶液中发生转变,产生的衍生物不仅与加热时间和pH值相关,也与醇的种类和醇/水混合物的相对浓度相关[26]。本研究26个提取处理表明,超声波、水浴和回流提取中,丙酮作为提取溶剂时都能获得较高的提取效率,易获得较多的绿原酸类成分和高含量的抗癌成分异绿原酸 A。而最常用的溶剂乙醇在本试验设定的超声波和水浴提取条件下,并未达到理想的提取效果。在不同溶剂的回流提取中,虽然提取的绿原酸类成分总量接近,但两种成分异绿原酸A和异绿原酸C的含量有较大差异。在生产中,可根据物质成分的需要选用提取方法。相对于不同条件下的丙酮溶液提取,醇溶液特别是乙醇溶液的回流提取使异绿原酸C的量大幅增加,相应的异绿原酸A的量大幅减少,表明在醇加热条件下,异绿原酸A转化为异绿原酸C。
异绿原酸C是具有多种生物活性的物质,在绿原酸类成分中,其抗氧化性是最强的,但目前只能从植物中提取,尚无合成转化的报道。而异绿原酸A已由Raheem等[27]在2011年实现了全合成。本文的数据也为获得抗氧化能力更强的异绿原酸C提供了新方法,即在一定条件下醇加热使其中的异绿原酸A转化为异绿原酸C的方法。
