RNA甲基化修饰N6-甲基腺苷调控病毒感染的研究进展
2021-09-10吉春苗黄耀伟
吉春苗,黄耀伟
(1.浙江大学动物科学学院动物预防医学研究所,杭州 310058;2.岭南现代农业科学与技术广东省实验室肇庆分中心,广东 肇庆 526238)
目前,已知的RNA 修饰方式超过150 种,其中甲基化修饰是一种较广泛的修饰方式,包括N6-甲基腺苷(N6-methyladenosine, m6A)、5-甲基胞嘧啶(5-methylcytosine, m5C)等。m6A 是真核生物信使RNA(messenger RNA, mRNA)中最常见和最丰富的一种甲基化修饰。研究发现,m6A 广泛存在于哺乳动物、植物和酵母甚至病毒的RNA 中[1]。哺乳动物m6A 修饰位点大多位于终止密码子及3′非翻译区(untranslated region, UTR)附 近[2],平 均 每 条mRNA 存在3~5 个m6A 位点[3]。研究表明,m6A 修饰位点存在相对保守的基序:[G/A/U][G>A]m6AC[U>A>C][3]。
RNA m6A 甲基化修饰在细胞内是一个动态可逆的过程,同时受甲基转移酶、去甲基化酶以及m6A结合蛋白的调控。m6A 修饰可在转录后水平调控RNA 的稳定性、定位、运输、剪切和翻译等[1]。m6A修饰参与多项机体生物进程,包括机体应激反应[4]、干细胞分化[5]、生物节律[6]、性别决定[7]、DNA 损伤[8]等。
早在20 世纪70—80 年代,就有研究发现病毒RNA 存在m6A 修饰,包括猴空泡病毒40(simian virus 40, SV40)[9]、Rous 肉 瘤 病 毒(Rous sarcoma virus, RSV)[10]、甲型流感病毒(influenza A virus,IAV)[11]等,但当时并不清楚这些修饰的作用。近几年来,随着m6A相关调控蛋白的发现以及m6A测序方法的突破,关于病毒m6A 的报道大量涌现,目前已有的研究对象涉及反转录病毒、DNA 病毒、正链RNA 病毒、负链RNA 病毒等多个病毒科的病毒。这些研究表明,m6A 根据病毒种类和细胞类型的不同发挥不同的作用。随着研究的不断深入,最新的研究发现,病毒感染导致宿主转录本m6A修饰发生改变,进而调控宿主对病毒感染的应答。本文对m6A修饰调控的分子机制、m6A检测方法、m6A及其相关蛋白调控病毒感染、m6A 修饰调控宿主对病毒感染的应答等方面进行总结,以期为今后深入研究m6A调控病毒感染的作用及机制提供参考。
1 m6A 修饰调控的分子机制
m6A作为一种RNA表观遗传修饰,在生物体内是可逆的动态过程,这个过程由m6A甲基化酶、m6A去甲基化酶和m6A结合蛋白共同参与(图1)。
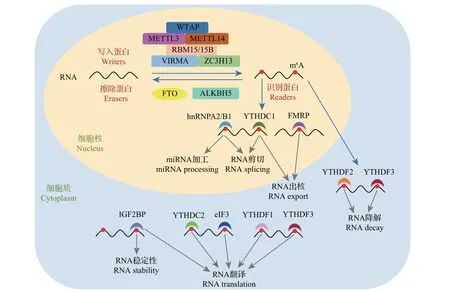
图1 m6A修饰的分子机制和功能Fig.1 Molecular mechanisms and functions of m6A modification
1.1 m6A 甲基化酶
m6A 甲基化酶即m6A 写入蛋白(writers),是一个由多种蛋白共同组成的甲基转移酶复合物,以S-腺苷甲硫氨酸(S-adenosyl methionine,SAM)为甲基供体,催化RNA m6A形成。这个复合体包含甲基转移酶样蛋白3(methyltransferase like 3,METTL3)、甲基转移酶样蛋白14(methyltransferase like 14,METTL14)、肾母细胞瘤1相关蛋白(Wilms tumor 1-associated protein,WTAP)以及新发现的RNA 结合基序蛋白15/15B(RNA binding motif protein 15/15B,RBM15/15B)、包含CCCH 锌指结构域蛋白13(zinc finger CCCH domain-containing protein 13,ZC3H13)以及KIAA1429 蛋白(又称为病毒样m6A甲基转移酶相关蛋白)等,可能还包含其他目前尚未获知的蛋白。其中,METTL3 是发挥甲基转移酶活性的主要成分,是m6A 甲基化酶复合物中第1 个被鉴定的成分,定位于细胞核。研究表明,在HeLa细胞中抑制METTL3 会导致细胞内m6A 整体表达水平下降约30%;METTL14是甲基转移酶复合物的第2个有效组成部分,与METTL3高度同源,也定位于细胞核。在HeLa 细胞和293FT 细胞中抑制METTL14 同样可以引起m6A 表达水平的下降[12]。生化特性分析表明,METTL3 和METTL14 按化学式计量比1∶1共同组成一个稳定的复合物来发挥作用[12]。WTAP 作为甲基转移酶复合物中的第3 个重要组成部分,与METTL3-METTL14 异源二聚体共同定位于细胞核[13]。在HeLa 和293FT 细胞中抑制WTAP 同样可以引起m6A 表达水平的下降,但WTAP 单独在体外不具备甲基转移酶活性,其可能通过招募甲基转移酶的催化亚基METTL3 和METTL14 到靶向mRNA,从而增强甲基转移酶的甲基化活性[13]。ZC3H13 是甲基转移酶新发现的组成部分,主要作用是维持甲基转移酶复合物的核定位[14]。 KIAA1429 和 RBM15/15B 可 以 辅 助METTL3-METTL14 导向mRNA 靶标,继而发挥甲基转移酶的甲基化活性[15]。除了METTL3 以外,真核生物中还有其他几种m6A 甲基转移酶,如:甲基转移酶样蛋白16(methyltransferase like 16,METTL16)是新发现的m6A 甲基转移酶,是METTL3的同源体,可以调控细胞SAM的水平并催化U6核小RNA及某些mRNA的甲基化[16];ZCCHC4可以催化28S核糖体RNA m6A甲基化[17]。
1.2 m6A 去甲基化酶
m6A 去甲基化酶即m6A 擦除蛋白(erasers),可以催化去除甲基化反应。脂肪与肥胖相关蛋白(fat mass and obesity-associated protein, FTO)是于2011年发现的第1个去甲基化酶[18],属于AlkB家族的成员,是一种依赖于铁离子和酮戊二酸的双加氧酶,通过氧化去甲基化,其和机体的体质量指数以及肥胖密切相关。研究显示,在HeLa和293FT细胞中沉默FTO基因可提高RNA m6A整体表达水平,过表达FTO基因则表现出抑制作用[18]。AlkB 同源蛋白5(AlkB homolog 5,ALKBH5)是AlkB 家族另一个针对m6A具有去甲基化活性的酶。在人的细胞中抑制ALKBH5,不仅可以增加mRNA的m6A水平,也会促进这些RNA 从细胞核转运到细胞质中[19]。FTO 和ALKBH5 是目前发现的最主要的2 种去甲基化酶,但是否存在其他的去甲基化酶需要进一步研究。
1.3 m6A 结合蛋白
m6A 结合蛋白即m6A 识别蛋白(readers),是指可以和m6A修饰的RNA结合的蛋白,m6A修饰的作用主要通过识别蛋白介导,目前发现的主要为具有YTH 功能结构域的蛋白,包括YTHDF1、YTHDF2、YTHDF3、YTHDC1、YTHDC2,这些蛋白都包含1个保守的m6A结合域,偏好结合包含G[G>A]m6ACU基序的经m6A甲基化修饰的RNA。其中,YTHDF家族成员彼此之间高度同源,均主要存在于细胞质中。研究发现,YTHDF1 可以促进m6A 修饰的mRNA 翻译[20],YTHDF2 具有加速m6A 修饰的RNA 降解的功能[21],YTHDF3 兼具YTHDF1 和YTHDF2 的功能[22]。与定位于细胞质中的YTH 家族蛋白的功能不同,YTHDC1定位于细胞核中,其可以调控RNA剪切和m6A修饰的RNA核转运[23-24]。YTHDC2是一种细胞质蛋白,可以提高经m6A 修饰的RNA 翻译效率,同时降低包含m6A修饰的mRNA的丰度[25]。YTHDC2是相对分子质量较大的蛋白(160 kDa),结构也比较特殊,可能拥有更多功能,值得进一步研究。
除了YTH家族蛋白外,还存在多种可以和包含m6A 的RNA 结合的蛋白,比如真核起始因子3(eukaryotic initiation factor 3, eIF3)、脆性X 智力障碍蛋白(fragile X mental retardation protein,FMRP)、胰岛素生长因子2 结合蛋白(insulin growth factor 2 binding protein, IGF2BP)、核内不均一核糖核蛋白A2/B1(heterogeneous nuclear ribonucleoprotein A2/B1,hnRNPA2/B1)等。eIF3可以和包含m6A的RNA的5′非翻译区(5′UTR)结合,从而加速翻译起始[26]。FMRP 促进m6A 修饰的mRNA 核输出[27]。IGF2BP可以通过识别m6A从而提高mRNA稳定性以及翻译效率[28]。hnRNPA2/B1 可以和被m6A 修饰的RNA 结合,从而调节RNA 剪切和小RNA 成熟过程[29]。
2 m6A 的检测方法
新技术的出现使得确定RNA 是否包含m6A 修饰的检测变得灵活多样。在开发这些检测技术之前,常见的检测RNA m6A甲基化的方法包括二维薄层色谱法、m6A斑点印记法、高效液相色谱串联质谱法等,但这些方法都不能用于鉴定m6A 的修饰位点。现在已开发出多种基于高通量测序的方法,以帮助确定m6A在基因组或转录组中的位置。
甲基化RNA 免疫沉淀测序(methylated RNA immunoprecipitation sequencing,MeRIP-seq)是目前最常用的确定m6A 位点的方法。该方法通过将总RNA 或mRNA 打断成100~200 核苷酸(nt)长的小片段,用特异性的针对m6A的抗体共沉淀。沉淀后的RNA用于高通量文库构建,和不经过m6A抗体共沉淀的对照组文库进行测序比对,最终鉴定出包含m6A 的片段[30]。MeRIP-seq 被广泛用于m6A 位点的测序,但这种方法分辨率低,只能识别富含m6A 的长100~200 nt 的片段,不能精确到单核苷酸位点,而且这种方法需要的RNA量也相对较大。
后来又相继发明了几种分辨率更高的测序方法,光交联辅助m6A 测序(photo-crosslinking-assisted m6A sequencing,PA-m6A-seq)就是其中一种[31]。这种方法的具体操作如下:RNA 经4-硫代尿苷(4-thiouridine, 4SU)标记后和特异性m6A 抗体免疫共沉淀,沉淀后的标记RNA 通过紫外线和抗体交联,然后被消化成30 nt 左右的片段。这些片段经反转录后,在生成的互补DNA上的m6A位点附近引入突变,以此来确定m6A 位置。该方法虽然比MeRIPseq 的精确度高,但是也不能达到单核苷酸级别的分辨率,而且该技术只能检测4SU 位点附近的m6A修饰。此外,有研究者发明了通过抗体/RNA 光交联实现单碱基分辨率识别m6A的方法,称为m6A单核苷酸分辨率交联与免疫沉淀(m6A individualnucleotide-resolution crosslinking and immunoprecipitation,miCLIP)[32]。该方法将RNA 片段直接和特异性m6A抗体通过紫外线交联,然后在RNA 3′端连接接头,5′端进行放射标记,如果RNA 中存在m6A 修饰,则在反转录时交联抗体的产物将在m6A位点附近直接引入有特征性的截短或突变。这种方法能够达到单碱基级别的分辨率,和PA-m6Aseq相比分辨率更高,而且RNA不需要经4SU处理。但该方法也有一定的缺陷,与MeRIP-seq方法相比工作量更大,而且因为分析主要依赖于检测cDNA文库中的突变或截短,所以对高通量测序的深度和质量要求更高。以上方法都存在一定的局限性,它们都依赖m6A 抗体,这可能会导致检测偏差,而且在很多情况下生物重复度不够也可能导致检测产生偏差。尽管如此,这些方法的出现已经为细胞或病毒RNA m6A定位提供了大量的信息。
后续又有研究人员研发出不依赖抗体的m6A检测方法,即通过特异性识别m6A 位点的RNA 酶MazF 来裂解m6ACA 基序,该方法被称为m6A 敏感的RNA 核糖核酸内切酶辅助测序(m6A-sensitive RNA-endoribonuclease-facilitated sequencing, m6AREF-seq)方法[33]或MAZTER-seq 方法[34],这种方法需要的RNA 量较少,而且能直接用于检测m6A,但缺点是只能检测m6ACA这一种类型的m6A修饰,无法覆盖所有的m6A。最近又出现2种不依赖抗体的单核苷酸分辨率的检测方法,一种方法称为m6A标记测序(m6A-label-seq)[35],即通过细胞自身代谢对全转录组RNA m6A 进行标记,通过在细胞中加入SAM 的类似物(烯丙基取代的SAM 类似物)或allyl-SeAM[这种SAM类似物能够在原本m6A处产生N6-烯丙基腺嘌呤(a6A),即将甲基换成了烯丙基],再经过碘诱导的环化反应形成腺嘌呤的衍生物,这种衍生物在进行反转录聚合酶链式反应(reverse transcription polymerase chain reaction, RTPCR)时将形成突变,最后通过高通量测序分析某些位点突变频率增加即可知道m6A 位点。另一种方法称为m6A-SEAL,是一种FTO 辅助m6A 选择性化学标记法(FTO-assisted m6A selective chemical labeling method)[36],将m6A 的去甲基酶FTO 蛋白作为催化剂,将mRNA上化学惰性的m6A转化为高反应活性的中间态产物N6-羟甲基腺嘌呤(hm6A),然后利用二硫苏糖醇的巯基与hm6A 发生反应,将不稳定的hm6A 转化为更稳定的N6-二硫醇甲基腺苷(dm6A)。dm6A上的自由巯基可以与甲烷硫代磺酸(methanethiosulfonate, MTSEA)快速反应,实现在mRNA上m6A的位置标记生物素,最终可被链霉亲和素磁珠捕获,从而富集含有m6A修饰的RNA片段供后续高通量测序使用。这2种新方法都是通过化学修饰实现m6A 位点识别,均属于间接检测m6A 的方法。在未来,人们需要的是一种简单、高效、分辨率高的m6A检测方法,并且需要更精确的算法辅助分析。
3 m6A 及其相关蛋白对病毒感染的调控
越来越多的研究表明,m6A 及其相关蛋白在病毒感染过程发挥着重要作用,根据病毒种类的不同,对其调控作用的总结如表1所示。
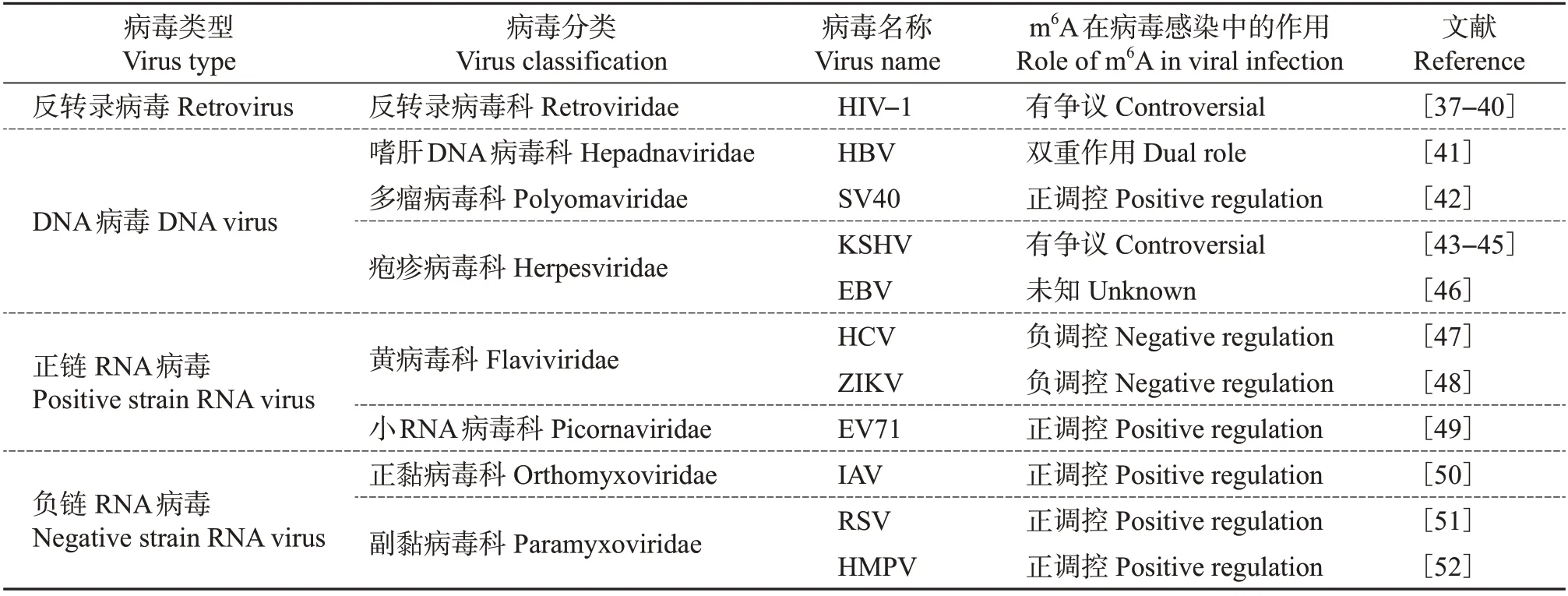
表1 m6A在不同病毒感染中的作用Table 1 Roles of m6A in different viral infections
3.1 反转录病毒
目前,关于病毒m6A修饰研究较多的是人类免疫缺陷病毒(human immunodeficiency virus, HIV),许多研究阐述了m6A 在HIV 生命周期中发挥的作用。TIRUMURU等[37]和LICHINCHI等[38]均发现,甲基转移酶METTL3/METTL14 可以促进HIV-1 的复制,而去甲基化酶ALKBH5 和FTO 起抑制作用。KENNEDY 等[39]对已鉴定到的m6A 位点进行突变,发现此举可以降低病毒RNA 载量以及病毒滴度。LICHINCHI等[38]用CD4+T细胞作为研究模型,发现抑制m6A甲基转移酶可以降低HIV-1感染,反之,抑制去甲基化酶可以提高HIV-1感染。上述3项研究结果均显示,HIV-1 RNA m6A修饰可以调节病毒基因的表达,但对于具体调控机制有不同看法。首先,对于HIV-1 RNA m6A 修饰的数量及具体位置存在争议。KENNEDY 等[39]发现,m6A 位点主要存在于RNA 基因组的3′端;而LICHINCHI 等[38]认为,整个HIV-1 RNA 基因组共存在14 个m6A 修饰,包括在Rev应答因子(Rev response element,RRE)上存在的2个,这些修饰可以调控包含RRE的RNA出核,并提高病毒Rev蛋白和RRE的结合率。造成这些差异可能是不同的研究者采用了不同的HIV毒株、不同的细胞类型和不同的试剂等,也可能是采用的研究技术有差异。LICHINCHI等[38]直接采用m6A抗体沉淀打断的RNA,KENNEDY 等[39]则先用4-硫代尿苷编辑病毒RNA,再用m6A 抗体交联全长的RNA。其次,有关YTHDF蛋白对HIV转录和复制的影响也存在争议。KENNEDY 等[39]观察到过表达YTHDF 蛋白可以提高HIV-1 复制率以及HIV-1 的p24、p55、Nef 蛋白的表达水平,而TIRUMURU 等[37]观察到过表达YTHDF 蛋白会抑制HIV-1 反转录和HIV-1 复制。LU 等[40]在之前研究的基础上继续探讨了YTHDF蛋白抑制HIV-1感染的机制,发现在HIV-1靶细胞中过表达YTHDF1、YTHDF2、YTHDF3可以降低病毒基因组RNA水平,同时抑制了HIV-1早期和晚期的反转录过程。 YTHDF1、YTHDF2、YTHDF3蛋白与病毒基因组包含m6A修饰的5′前导序列的结合能力更强,突变5′前导序列2 个m6A 修饰位点可以显著降低病毒的感染能力,说明这2 个m6A修饰位点在HIV-1感染过程中发挥着重要作用。在未来,需要更进一步的研究来系统解释HIV-1 感染过程中宿主和病毒RNA m6A调控的分子机制。
3.2 DNA 病毒
3.2.1 嗜肝DNA 病毒科
乙型肝炎病毒(hepatitis B virus, HBV)是一种双链DNA病毒,其复制受m6A的调控[41]。抑制宿主甲基化酶METTL3-METTL14 和m6A 结合蛋白YTHDF2 基因均能提高HBV 转录本的稳定性和蛋白表达水平。测序发现HBV 转录本只有一个m6A峰,位于ε茎环内。这个茎环存在于所有病毒转录物包括前基因组RNA(pregenomic RNA,pgRNA)的3′末端,也存在于pgRNA的5′末端。有趣的是,在3′茎环引入沉默m6A 的突变增加了该病毒转录物的稳定性,但突变pgRNA 5′ε茎环的m6A 位点则降低了反转录水平,表明m6A 对HBV RNA 有双重调控作用[41]。因此,阐明m6A在3′和5′茎环之间如何寻求平衡从而促进HBV的增殖是未来的研究方向。
3.2.2 多瘤病毒科
猴空泡病毒40(SV40)是一种在细胞核内复制的小的双链DNA 病毒,其RNA 也包含m6A 修饰。虽然在1979 年就已经知晓SV40 mRNA 中存在m6A[9],但m6A 在病毒mRNA 上的精确位置以及在病毒周期中发挥的作用直到最近才被研究发现。SV40 转录本中都存在m6A,其中早期SV40 转录本中包含2 个m6A 位点,而晚期转录本中有11 个m6A位点。丢失m6A的SV40早期转录本对病毒感染能力没有影响,但突变晚期转录本的m6A位点可降低病毒感染能力。晚期转录本m6A 的丢失抑制SV40核输出,从而导致结构蛋白VP1 表达减少。抑制METTL3 的表达可降低SV40 的复制,而过表达YTHDF2 提高了病毒的复制水平,这进一步表明m6A 可促进SV40 感染能力的提升[42]。未来需要研究m6A影响晚期转录本核输出的分子机制以及m6A在SV40及其他人类多瘤病毒中的功能是否相似。
3.2.3 疱疹病毒科
疱疹病毒拥有大的双链DNA基因组,在细胞核内复制。目前已有关于Kaposi 肉瘤相关疱疹病毒(Kaposi’s sarcoma-associated herpesvirus, KSHV)m6A定位及功能的研究[43-45]。一些试验结果发现,许多KSHV 转录本上都存在m6A,包括KSHV 开放阅读框50(open reading frame 50, ORF50)mRNA,其编码复制转录激活因子(replication transcription activator,RTA),是KSHV激活所需的主要反式激活因子。研究表明,m6A 可调节RTA 反式激活因子,但是在m6A 如何调控ORF50/RTA 上出现了意见分歧,这可能是因为研究者们使用的细胞类型不同。HESSER 等[44]发现,在iSLK.219 和iSLK.BAC16 细胞中,沉默METTL3和YTHDF2可抑制KSHV ORF50/RTA的表达,同时会抑制病毒裂解再激活过程以及病毒释放,表明m6A 可促进KSHV 裂解再激活。但在B 细胞中,m6A 负调控ORF50/RTA 和KSHV 的裂解再激活。相反地,TAN 等[45]发现在类似细胞KiSLK中,抑制YTHDF2可延长再激活过程中许多病毒mRNA 的半衰期,导致病毒产量升高,而过表达YTHDF2 可使病毒蛋白和病毒产量均下降,推测YTHDF2可能通过促进病毒裂解转录本的降解来抑制KSHV 裂解再激活,表明m6A 在KSHV裂解再激活中可能起抑制作用。YE等[43]研究显示,ORF50/RTA mRNA 上的m6A 由YTHDC1 读取,它与富含丝氨酸/精氨酸剪切因子(serine/arginine-rich splicing factor, SRSF)(SRSF3 和SRSF10)共同作用促进ORF50/RTA mRNA 的剪接和表达。这些结果表明,m6A在KSHV裂解再激活过程中发挥作用,但是其如何发挥作用目前还没有达成共识。不同细胞系m6A 可能对KSHV 感染发挥不同作用,反映了可能存在细胞限制性的作用结果,今后可能需要在不同的细胞系研究m6A的作用。
此外,疱疹病毒科的Epstein-Barr病毒(Epstein-Barr virus,EBV)也被证实在病毒潜伏或裂解转录物上存在m6A修饰。研究人员发现,EBV的m6A修饰可以提高潜伏基因的表达量,却抑制裂解基因的表达。另外,研究人员还发现甲基转移酶METTL14是EBV 诱导肿瘤生成的重要因素,METTL14 在EBV潜伏感染的细胞内表达量升高,在裂解感染期表达量下降,抑制甲基转移酶METTL14 活性可导致EBV潜伏转录物的表达量降低。METTL14在体外可以促进EBV 转化细胞的增殖,在体内可以增强EBV的致瘤性。最后,研究人员发现病毒编码的潜在癌蛋白EBNA3C可以激活METTL14的转录,并直接与METTL14 相互作用提高其稳定性,说明EBV可以通过劫持METTL14 驱动EBV 介导的肿瘤发生[46]。
3.3 正链RNA 病毒
3.3.1 黄病毒科
有研究报道了m6A 修饰对黄病毒科病毒的影响[47],该病毒基因的表达过程完全在细胞质中进行。已进行m6A测序的病毒包括丙型肝炎病毒(hepatitis C virus, HCV)、寨卡病毒(Zika virus, ZIKV)、登革热病毒(dengue virus, DENV)、黄热病毒(yellow fever virus, YFV)、西尼罗病毒(West Nile virus,WNV),研究发现这些病毒基因组都存在m6A修饰,每个病毒的基因组最后一个基因(NS5/NS5B)都出现了较集中的m6A修饰位点。GOKHALE等[47]研究发现,HCV RNA 基因组共有19 个富含m6A 修饰的位点,涵盖了5′UTR、Core(核心蛋白)基因以及其他基因区域。抑制甲基转移酶METTL3/METTL14可提高HCV 蛋白的表达,而抑制去甲基化酶FTO则能抑制病毒蛋白表达。此外,研究还发现m6A结合蛋白YTHDF可能调控病毒的组装。激光共聚焦实验发现,YTHDF1、YTHDF2、YTHDF3 蛋白与HCV RNA共定位于HCV病毒颗粒组装的位点——脂滴,并且能够在不影响病毒复制的情况下负调控病毒的组装。研究人员发现,将与YTHDF 蛋白结合的m6A 位点突变后,病毒RNA 与YTHDF 的结合能力下降,但与HCV核心蛋白结合能力增强。突变后的病毒滴度也得到提高,但病毒复制能力和蛋白产量没有变化。由此猜想,YTHDF 可能起到了抗病毒的作用,其通过与病毒RNA 结合阻止病毒RNA 和核心蛋白结合,从而影响病毒组装,最终导致病毒颗粒产量减少。
另一个研究得较多的黄病毒科病毒是寨卡病毒(ZIKV)。LICHINCHI等[48]研究发现:ZIKV RNA基因组大约有3%的腺苷存在m6A 修饰;经高通量测序发现ZIKV MR766 非洲毒株存在12 个m6A 富集的位点,且一半出现在非结构蛋白NS5编码区和3′UTR。和m6A 调 控HCV 感 染 类 似,METTL3/METTL14抑制ZIKV的复制,而ALKBH5和FTO可提高病毒的复制。YTHDF1、YTHDF2、YTHDF3 结合ZIKV RNA m6A 使得病毒复制降低,对其进行负调控。同时,LICHINCHI 等[48]也研究了ZIKV 感染后宿主m6A 修饰的变化,结果表明,病毒感染后宿主m6A 水平上升,其中5′UTR 的m6A 修饰水平上升,3′UTR 的m6A 修饰水平下降。而基因本体(gene ontology, GO)分析发现,一些和免疫相关的基因发生了m6A改变,包括出现新的m6A修饰位点或丢失原有的m6A,这些基因m6A 修饰的改变是否影响病毒复制值得进一步研究。
3.3.2 小RNA 病毒科
肠道病毒71型(enterovirus 71,EV71)为单股正链RNA病毒,在细胞质中复制。研究表明,EV71也存在m6A 修饰。EV71 基因组的m6A 位点位于编码衣壳蛋白VP、RNA 依赖性RNA 聚合酶3D 和非结构蛋白2C的基因上。消除VP1和2C基因的m6A修饰降低了EV71的复制,提示m6A对EV71感染有正向调节作用。研究还发现,抑制METTL3可使病毒复制减少,而抑制FTO 或3 种YTHDF 蛋白或YTHDC1均可增强病毒复制。在感染EV71的细胞中,有几个m6A 相关蛋白的定位发生了改变:METTL3和METTL14蛋白表达上调并移向细胞质,细胞质识别蛋白YTHDF1 和YTHDF2 部分重新定位于细胞核,而细胞核识别蛋白YTHDC1也部分迁移到细胞质中。与蛋白定位一致的是,检测发现METTL3蛋白直接与细胞质中的EV71 3D蛋白相互作用,表明3D 可以招募METTL3 蛋白到病毒RNA复制位点[49]。
3.4 负链RNA 病毒
3.4.1 正黏病毒科
甲型流感病毒(IAV)属于正黏病毒科,是一种单股负链、分节段的RNA 病毒,在细胞核中复制。早在20 世纪70 年代,人们就发现IAV RNA 上存在m6A 修饰,但直到现在才明确m6A 在IAV 感染中发挥的作用。在IAV感染的肺上皮细胞A549中,绘制m6A 修饰位点及YTHDF 蛋白结合位点,结果显示,在IAV负链或正链RNA中存在较多m6A修饰位点。在每个RNA 片段上发现的m6A 位点数与多年前预测的每个IAV mRNA 的m6A 数相似,包括编码血凝素(hemagglutinin,HA)的mRNA片段。与已经讨论过的黄病毒科病毒不同,m6A修饰促进了IAV感染。过表达METTL3和YTDF2基因提高了病毒蛋白的表达量和病毒滴度,而失活IAV m6A 位点降低了HA mRNA和蛋白表达水平。这些m6A突变病毒在感染小鼠后的致病性也减弱。总之,研究表明m6A提高了HA 表达从而促进IAV 复制并增强其致病性[50]。未来的研究需要进一步揭示m6A增强IAV基因表达的分子机制。
3.4.2 副黏病毒科
人类呼吸道合胞体病毒(human respiratory syncytial virus,RSV)是不分节段的负链RNA病毒,近年有研究通过m6A测序发现RSV负链、正链RNA都存在m6A 修饰。过表达m6A 结合蛋白会显著提高病毒复制和基因表达能力,抑制m6A甲基化酶时病毒复制和基因表达水平下降,而抑制m6A去甲基化酶时效果相反。由测序结果可知,病毒G基因的m6A 修饰最丰富,G基因m6A 位点发生突变的重组病毒在A549 细胞中的复制能力减弱,同时对小鼠的致病力也减弱,表明病毒m6A修饰增强了RSV的复制能力和致病性[51]。
LU 等[52]对副黏病毒科另一种病毒人偏肺病毒(human metapneumovirus, HMPV)的m6A 修饰及作用也进行了相关研究。研究发现,HMPV 负链、正链RNA 都存在m6A 修饰。过表达m6A 甲基化酶或者抑制m6A去甲基化酶都能提高HMPV感染率,反之,过表达m6A去甲基化酶或者抑制m6A甲基化酶时效果相反。此外,还发现m6A位点突变的重组病毒以依赖视黄酸诱导基因Ⅰ(retinoic acid inducible gene-Ⅰ,RIG-Ⅰ)的方式诱导更多Ⅰ型干扰素产生,原因是缺失m6A 的病毒RNA 可以诱导RIG-Ⅰ的高表达,提高病毒RNA和RIG-Ⅰ的结合能力,并促进RIG-Ⅰ构象改变,最终导致干扰素表达量上升。由此推测,病毒m6A修饰可以逃避宿主天然免疫系统的识别并提高病毒的致病力。动物实验也表明,m6A缺失重组病毒在小鼠体内能诱导高水平干扰素产生,导致病毒毒力减弱[52]。
4 m6A 修饰对宿主应答病毒感染的调控
综上所述,m6A 及其相关蛋白在病毒的生命周期中发挥重要作用。随着m6A 机制研究的不断深入,研究人员发现m6A在宿主应答病毒感染过程中同样具有调节作用。DURBIN 等[53]发现,m6A 修饰可以降低RNA和病毒重要模式识别受体RIG-Ⅰ的结合能力,表明m6A参与调控宿主抗病毒的天然免疫。KARIKÓ等[54]发现,包含m6A修饰的RNA不能激活宿主天然免疫系统中病原相关分子模式识别受体(Toll 样受体)。ZHENG 等[55]发现,病毒感染后,宿主RNA 解旋酶DDX46 通过结合去甲基化酶ALKBH5,使得一些包含m6A 修饰的抗病毒转录物(Mavs、Traf3、Traf6)去甲基化,导致这些抗病毒转录物滞留在细胞核内,从而阻止其翻译,最终抑制Ⅰ型干扰素产生。WINKLER 等[56]发现,抑制宿主METTL3 或YTHDF2 蛋白可导致病毒感染后干扰素刺激基因(interferon-stimulated gene,ISG)表达量升高,使得不同病毒的产量均以干扰素信号依赖的方式受到抑制。干扰素信号通路是宿主抵抗外界病原微生物感染的第1 道防线,最终研究表明宿主干扰素基因IFNmRNA 具有m6A 修饰,在抑制METTL3或YTHDF2表达的情况下,IFN表达更稳定,进而诱导更多ISG产生,发挥抗病毒作用。相似地,另一项研究也发现,由双链DNA 或人类巨细胞病毒(human cytomegalovirus,HCMV)诱导产生IFN这一过程受细胞m6A甲基化酶METTL14和去甲基化酶ALKBH5 的调控。沉默METTL14可降低病毒的产量,并提高HCMV诱导的IFNβ1mRNA的产量和稳定性,沉默ALKBH5的作用相反,最终研究发现IFNβ1mRNA具有m6A修饰[57]。
m6A修饰不仅可以影响宿主抗病毒先天免疫应答系统,也可以介导宿主细胞代谢应答病毒感染。LIU等[58]研究发现,病毒感染后,宿主通过减弱宿主细胞m6A去甲基化酶ALKBH5的活性,增加酮戊二酸脱氢酶(OGDH)mRNA 的m6A 修饰,从而降低其mRNA稳定性,导致病毒复制必需的代谢产物亚甲基丁二酸的产量降低,最终抑制病毒复制[58]。病毒感染可能导致宿主mRNA m6A修饰发生改变,进而影响宿主基因的表达,最终调控病毒感染。LICHINCHI等[48]在分析黄病毒科病毒ZIKV基因组m6A 修饰时,还发现病毒感染后宿主免疫通路相关基因mRNA m6A修饰变化较大,但研究者没有接着分析宿主mRNA m6A 修饰的改变是否影响病毒感染。最近的研究表明,黄病毒科成员(DENV、ZIKV、WNV、HCV)感染宿主会导致宿主特定基因mRNA m6A修饰发生改变,包括RIOK3(编码一种丝氨酸/苏氨酸蛋白激酶)、CIRBP(编码一种冷诱导RNA结合蛋白)。在病毒感染过程中,RIOK3mRNA上m6A修饰增加可以促进其翻译,而CIRBPmRNA上m6A 修饰减少可以促进其可变剪切。病毒感染分别通过激活宿主天然免疫或内质网应激通路导致RIOK3或CIRBPm6A 修饰的改变,而RIOK3和CIRBP编码的蛋白又可以调控DENV、ZIKV、HCV的感染。所以,黄病毒科病毒感染通过激活宿主信号通路改变特定基因mRNA m6A修饰,调节宿主蛋白表达,最终影响病毒感染[59]。
5 小结与展望
m6A 修饰不仅在不同病毒间发挥不同作用,例如m6A 修饰对SV40、EV71、IAV、RSV、HMPV 等病毒有正向调控作用[42,49-52],对HCV、ZIKV 等病毒有负向调控作用[47-48],而且在同一种病毒不同培养体系中也可能发挥不同的作用,例如在上皮细胞中,m6A促进KSHV裂解再激活,但在B细胞中,m6A抑制KSHV 裂解再激活[43-45]。m6A 修饰在生物体内是动态可逆的过程,广泛参与修饰宿主和病毒RNA的修饰,调控机制复杂,发挥功能多样,这就导致m6A在不同病毒、不同细胞甚至在不同时期发挥的作用不尽相同。m6A可以直接修饰病毒RNA,从而影响病毒基因表达或宿主免疫系统识别,也可以通过调节宿主基因表达来间接调控病毒感染,例如宿主先天免疫通路、细胞代谢通路等相关基因[55-58]。虽然目前已有大量研究数据表明,m6A 修饰在病毒生命周期中具有重要的调控作用,但其发挥调控的作用机制尚未明确。
目前,大部分研究采用的m6A 测序方法分辨率不高,不能确定m6A 修饰的精确位点和定量分析m6A 修饰的丰度,而且仅通过抑制或过表达m6A 相关蛋白分析对病毒复制的影响,不能区分是病毒或/和宿主RNA m6A对病毒感染发挥作用。因此,未来的研究可以结合单碱基分辨率的m6A测序方法,精确定位病毒m6A修饰的位点,结合定点突变技术确定病毒m6A 修饰的作用,还可通过定量分析宿主mRNA m6A 修饰的变化筛选调控病毒感染的靶基因并分析其具体作用机制。
总之,本文就目前m6A 修饰与病毒感染的相关研究进行了综述,发现病毒或宿主RNA m6A修饰的变化均可以调节病毒感染,但关于具体调控机制的研究尚不深入。未来的研究可能需要综合考虑各方面因素(细胞类型、病毒毒株、感染时间等),采用单碱基分辨率的测序技术系统地分析病毒或宿主m6A 在病毒复制周期中的作用和具体机制,为抗病毒研究提供全新的理论基础。
