ZBTB40基因在人类细胞系和肝癌组织及小鼠各组织中的表达研究
2021-09-08周明青彭琪瑶左珊如李学广周军华贺权源
周明青,彭琪瑶,左珊如,李学广,周军华,贺权源
(湖南师范大学医学院,中国湖南 长沙 410013)
人类基因组中有1 700~1 900个编码转录因子(transcription factor,TF)的基因[1]。其中,ZBTB(zinc finger and BTB domain)转录因子家族包含49个成员[2],其基本结构特征为N末端的BTB结构域和C末端的C2H2/Krüppel型锌指(zine finger,ZF)蛋白结构域[3]。
BTB也称为POZ(痘病毒和锌指)结构域,存在于多种痘病毒相关蛋白质中[4]。BTB/POZ结构域是一个进化上保守的介导蛋白质-蛋白质相互作用的结构域[5],其功能广泛而复杂,包括转录抑制[6]、细胞骨架调节[7~8]、蛋白质泛素化[9]以及调控基于Cul3的E3连接酶复合物的二聚化等[2]。
C2H2/Krüppel型锌指蛋白结构域最早在非洲爪蟾转录因子ⅢA中被发现[10],因含有锌指并能结合DNA而得名。其包含两个半胱氨酸和两个组氨酸(C2H2)残基,它们与Zn2+结合起来形成一种“手指”形的多肽空间构型。该多肽折叠结构能与DNA结合,是最常见的DNA结合结构域之一[11]。
BTB-ZF蛋白也称为POK(POZ和Krüppel型锌指)蛋白[12]。这个大家族的许多成员是重要的转录因子和基因组调控因子,其中一些与发育和癌症有关,最具有代表性的是B细胞淋巴瘤6(B cell lymphoma 6,BCL6)[13~15]、PLZF(promyelocytic leukaemia zinc finger)[16~18]、癌症高甲基化因子 1(hypermethylated in cancer 1,HIC-1)[19~21]和端粒相关蛋白TZAP(telomeric zinc finger-associated proxBTB domain containing 40,又名ZNF923)是该家族中相对分子质量最大的一个成员,它在进化中高度保守[3~5],但其生理功能尚不清楚。目前,仅有报道称ZBTB40的高表达可以促进成骨细胞生成并增加骨密度,降低女性骨质疏松风险[24],而基于ZBTB40可变剪切得到的lncRNA ZBTB40-IT1则通过调节 WNT4、RUNX2、OSX、ALP、COL1A1、OPG和RANKL的表达抑制成骨并促进破骨细胞的生成,和ZBTB40发挥着相反的作用,但是lncRNA ZBTB40-IT1的这种作用可被ZBTB40抑制[25]。另外,有研究证明ZBTB40在石斑鱼的各阶段生殖细胞中高表达[26]。本研究旨在初步研究ZBTB40在人类细胞系、肝癌组织和小鼠组织中的表达规律,初步探讨其正常生理功能及其与人类疾病之间的关系,同时构建稳定表达细胞株,为未来深入研究ZBTB40的生理及病理功能奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物
10~12 周龄的 SPF(specific pathogen free)级野生型实验小鼠C57BL/6J共两只,购买自湖南斯莱克景达实验动物有限公司。
1.1.2 临床样本
本研究所用临床组织样本均来源于中南大学湘雅医学院,包含肝癌/癌旁组织标本5对,均经过患者本人同意和医院负责人同意。标本简要信息见表1。

表1 病例标本简要信息Table 1 Brief information about case samples
1.1.3 质粒和感受态细胞
质粒载体pDONR-ZBTB40(Gene ID:9923;F8WAI8)和慢病毒包装载体(pLenti-EF1a-Flag-HA-attR-IRES-puro)获赠于中山大学生命科学院。部分大肠杆菌DH5α感受态细胞购买自长沙鼎国生物技术有限责任公司,部分DH5α由本实验制备。
1.1.4 测序引物
质粒载体pDONR-ZBTB40的测序引物为通用引物 M13F(5′-TGTAAAACGACGGCCAGT-3′)和 M13R(5′-CAGGAAACAGCTATGACC-3′),慢病毒载体质粒(pLenti-EF1a-Flag-HA-attR-IRES-puro)和慢病毒表达质粒(pLenti-Flag-ZBTB40-HA-attB-IRES-puro)的测序引物为 EF1A-F(5′-TCAAGCCTCAGACAGTGGTTC-3′)和 IRES-R(5′-CCTCACATTGCCAAAAGACG-3′)。
1.1.5 其他主要试剂和材料
LB肉汤琼脂和LB肉汤培养基源自生工生物工程(上海)股份有限公司;琼脂糖(regular agarose)源自BIOWEST公司(德国);DMEM培养基和胎牛血清(fetal bovine serum,FBS)源自Thermo-Fisher Scientific公司(美国);basal medium/F-12K培养基购自GENVIEW公司(美国);RPMI medium modified(1640)培养基购自HyCloneTM公司(美国);TRIzol、Tris-HCl和吐温(泸试)购自国药集团化学试剂有限公司;RevertAid First Strand cDNA Synthesis Kit(#K1622)、GatewayTMLR ClonaseTMⅡ Enzyme Mix和Lipofectamine 2000转染试剂均购买自ThermoFisher Scientific公司(美国);Genious 2X SYBR Green Fast qPCR Mix购自武汉爱博泰克生物科技有限公司;QuickBlockTMWestern Antibody Dilution Solution购自碧云天生物技术有限公司;1 kb DNA ladder(500~10 000 bp)购买自广州东盛生物科技有限公司;miRNA Kit(R6842-01)和Endo-free Plasmid Mini KitⅠ购买自OMEGA Bio-Tek公司(美国)。限制性内切酶 ApaⅠ、AgeⅠ(BshTⅠ)、NotⅠ购买自 ThermoFisher Scientific 公司(美国)。文中所用抗体的相关信息如表2所示。人骨肉瘤细胞(U2OS)、人成骨肉瘤细胞(Saos-2)、人宫颈癌细胞(HeLa)、人胚胎肾细胞(HEK 293T)获赠于中山大学生命科学院,人非小细胞肺癌细胞(A549)、人乳腺癌细胞(MCF-7)获赠于湖南师范大学邓锡云教授课题组,人前列腺癌细胞(PC-3)购买自湖南吉凯基因科技有限公司,人肝癌组织细胞(HepG2)获赠于湖南师范大学药学系。

表2 本研究所使用的抗体列表Table 2 List of antibodies used in the study
1.2 方法
1.2.1 细胞培养及蛋白质提取
用60 mm培养皿培养细胞,其中U2OS、Saos-2、HeLa、HepG2 和 HEK 293T 细胞的培养基为含10%FBS的DMEM;MCF-7细胞在培养时需额外添加0.01 mg/mL人胰岛素;PC-3细胞的培养基为含10%FBS的F-12K;A549细胞使用含10%FBS的1640培养基。待细胞生长密度为90%~100%时,弃培养基,用冰的磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗去残留培养基,加入5×SDS loading buffer(250 mmol/L Tris-HCl,pH 6.8;10%SDS;0.5%BPB;50%甘油;5%巯基乙醇),充分反应后转移至1.5 mL离心管,蛋白质煮沸变性后将样品存放于-80℃冰箱备用。
1.2.2 小鼠组织蛋白质的提取
眼科剪、眼科镊、研钵、研钵棒等器皿用DEPC水浸泡过夜,然后高温高压灭菌。随机选取10~12周龄的健康C57BL/6J雄鼠,用“断颈法”将其处死;取小鼠心、肝、脾、肺、肾、胃、膀胱、胸骨和睾丸组织,用生理盐水清洗后取绿豆大小组织放入无酶处理的研钵,加入液氮碾磨直至组织完全碎裂为粉末;取50~100 mg粉末至1.5 mL离心管并称重,加入1 mL组织裂解液(50 μL配方:40 μL RIPA裂解液+5 μL蛋白酶抑制剂+5 μL磷酸酶抑制剂+0.5 μL PMSF),于四维混合仪上4℃裂解1~2 h后最高转速离心15 min;取上清液加入100 μL 5× SDS loading buffer,变性处理后将样品存放于-80℃冰箱备用。
1.2.3 蛋白质免疫印迹(Western-blot)
配制8%的分离胶和5%的浓缩胶。上样后以恒压80 V电泳30 min,恒压120 V电泳60 min。湿转法恒流200 mA转膜[27];用5%的脱脂奶粉于室温封闭1~2 h;1×Tris-HCl+吐温缓冲盐溶液(Tris-HCl buffer salt & Tween,TBST:20 mmol/L Tris-HCl,pH 8.0;150 mmol/L NaCl;0.1%Tween)洗膜后室温孵育一抗(1︰500~1︰2000)2 h或4℃孵育过夜;1×TBST洗膜后室温孵育二抗(1︰3 000)1 h;避光滴加ECL化学发光液显影。用ImageJ软件分析条带灰度值,采用GraphPad Prism绘图,利用t检验进行差异显著性分析。
1.2.4 免疫组化
病理石蜡切片由中南大学提供。对切片进行脱蜡处理:56℃烘烤切片2~3 h;浸入二甲苯中3次,每次5 min;逐渐用水环境替代切片样本中的二甲苯。采用柠檬酸缓冲液高温高压法修复抗原。把切片置于0.1%~0.3%TritonX-100中,室温浸泡25 min,PBS冲洗3次,每次5 min,增加细胞膜对抗体的渗透性。用3%的H2O2处理切片20 min,PBS冲洗3次,每次5 min,灭活内源性酶。用2%~10%的羊血清处理切片20 min,一抗孵育切片4℃过夜,随后用PBS冲洗3次,每次5 min。在室温下,二抗孵育切片30~60 min,继而用PBS漂洗切片3次,每次5 min。用新配的DAB工作液处理切片5 min以后显色,苏木精复染细胞核。最后,切片在经过梯度乙醇脱水和二甲苯透明处理(5 min)后,用中性树脂封片。
1.2.5 RNA的提取
采用TRIzol法提取细胞和组织的总RNA[28]:收取2.5×106个细胞或50~100 mg组织,加入1 mL TRIzol,充分混匀后加入0.2 mL氯仿/1 mL TRI-zol,振荡15 s后静置2~3 min;4℃条件下最高转速离心15 min,取上清;加入0.5 mL异丙醇,轻轻混匀后室温静置10 min;4℃高速离心10 min,弃上清;加入1 mL 75%乙醇,洗涤沉淀;4℃、7 500g离心5 min,弃上清;晾干后加入50 μL DEPC水至沉淀完全溶解,立即测量RNA浓度并记录A260nm/A280nm的比值。
1.2.6 cDNA的合成
按照RevertAid First Strand cDNA Synthesis Kit试剂盒说明书配制逆转录体系(20 μL):总RNA 500 ng,oligo(dT)18primer 1 μL,无酶水加至 12 μL;5× reaction buffer 4 μL,RiboLock RNase inhibitor 1 μL,10 mmol/L dNTP mix 2 μL,RevertAid MMulV RT 1 μL。充分混匀后瞬时离心,将样本置于PCR仪中,42℃孵育60 min,随后70℃处理5 min终止反应。将获得的反应产物(cDNA)置于-20℃保存备用。
1.2.7qRT-PCR
按照Genious 2X SYBR Green Fast qPCR Mix试剂盒说明书配制荧光定量实时聚合酶链式反应(quantitative real-time polymerase chain reaction,qRT-PCR)体系(20 μL):Genious 2X SYBR Green Fast qPCR Mix 10 μL,正向引物(10 μmol/L)0.4 μL,反向引物(10 μmmol/L)0.4 μL,cDNA 2 μL,ROXⅡ 0.4 μL,ddH2O加至20 μL。每个样本3个复孔,目的基因和内参的扩增引物见表3。PCR反应程序:95℃预变性3 min;95℃5 s,60℃30 s,循环40~45次。
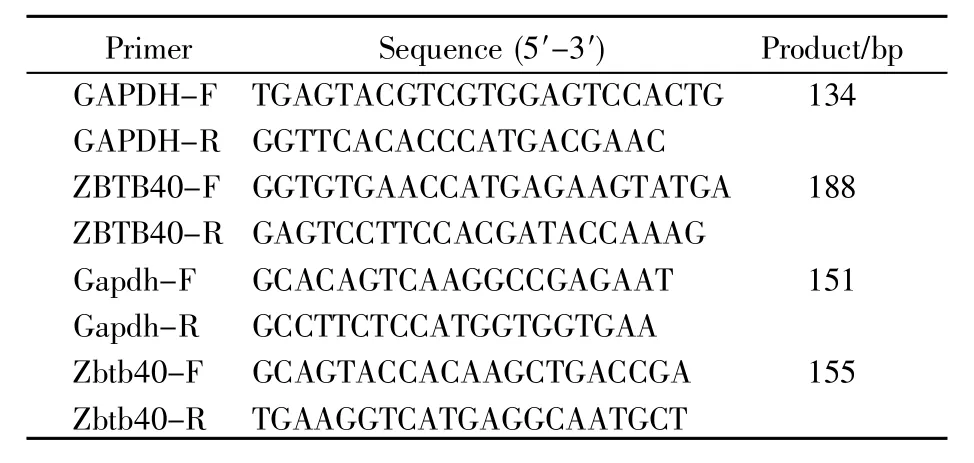
表3 qRT-PCR引物序列Table 3 Primers used for qRT-PCR analysis
1.2.8 克隆和测序
根据Gateway Clone反应原理[29]及GatewayTMLR ClonaseTMⅡEnzyme Mix试剂盒说明书配制LR反应体系(10 μL):entry clone(pDONR-ZBTB40)50~150 ng,destination vector(pLenti-EF1a-Flag-HA-attR-IRES-puro)150 ng,加 TE buffer到 8 μL,加 2 μL LR ClonaseTMⅡ enzyme mix。取 1.5 μL产物转化大肠杆菌DH5α,随后将其接种于含有氨苄抗生素的LB固体培养基,37℃培养过夜;挑选合适的单克隆接种到含有氨苄抗生素的LB液体培养基中,37℃、220 r/min摇床培养过夜;提取质粒,将经酶切鉴定正确的样本送至北京擎科生物科技有限公司进行Sanger测序。
1.2.9 pLenti-Flag-ZBTB40-HA-attB-IRES-puro慢病毒颗粒的制备
待HEK 293T细胞生长至密度为70%~80%时,利用Lipofectamine 2000转染慢病毒包装三质粒系统(pLenti-ZBTB40-attB-puro、pMD2.G和ps-PAX2)混合液,48 h后收集细胞上清液并用0.45 μm滤网过滤,滤液为包含病毒颗粒的培养基。
1.2.10 稳定表达细胞株的构建
慢病毒颗粒培养基与完全培养基(DMEM+10%FBS)以1︰1的比例加入目的细胞。48 h后加嘌呤霉素(1~10 μg/mL),药筛7 d。药筛结束后将细胞低密度接种至60 mm培养皿,正常培养至细胞形成单克隆。挑取单克隆至96孔板,进行传代培养扩增。采用Western-blot方法对各克隆进行验证,保种冻存合格单克隆细胞株。
1.2.11 数据处理及生物信息分析
使用GraphPad Prism 8.0.2软件对各组实验数据进行分析,采用t检验进行组间比较。使用https://kmplot.com/analysis/网络平台的数据和工具进行总生存率分析(分析时间为2020年12月)。采用Kaplan-Meier模型进行生存分析,采用Logrank检验比较组间差异。人肝癌患者生存时间的数据来自TCGA数据库(共364例,其中男性246例,女性118例)。基因表达水平的阈值为所有可能的阈值中,使组间统计学差异最大的值。
2 结果
2.1 ZBTB40在小鼠不同组织中的表达
采用Western-blot检测ZBTB40在小鼠不同组织中的表达水平,结果如图1A~B所示:ZBTB40在小鼠肝脏、胸骨和睾丸中表达较高,说明其在小鼠组织中的表达具有较高的组织特异性。本研究首次发现ZBTB40在小鼠肝脏中的表达甚至高于胸骨和睾丸,提示该蛋白质很可能与正常肝脏的生理功能有一定联系。另外,Western-blot检测结果显示,ZBTB40在小鼠睾丸组织和肝脏组织中的相对分子质量比在小鼠胸骨组织中的相对分子质量更大,提示其可能存在不同的转录本。在U-niProt数据库中,小鼠的ZBTB40基因有两个转录本:Q6PCS8(138.19 kD)和 Q571D3(135.64 kD)。比对两个转录版本的序列发现,两种转录本共享大部分外显子,序列基本一致,仅在N端有一些差异(46AA);本研究所用两种ZBTB40抗体均可对其进行识别,因此可用同一种抗体进行鉴定(图1E)。根据相对分子质量,我们推测肝脏、睾丸和胸骨组织中的蛋白质转录本分别为Q6PCS8和Q571D3。进一步采用qRT-PCR检测ZBTB40在小鼠各组织中的mRNA表达水平,结果显示,其mRNA表达水平在肝脏、睾丸和胸骨中较高(图1C),与蛋白质表达趋势基本一致。有趣的是,在脾脏和肺中,ZBTB40的转录本含量较高,但其蛋白质几乎检测不到。此外,小鼠肝脏的免疫组化实验证明,ZBTB40在肝脏实质细胞的细胞核和细胞质中均有表达(图1D),且主要集中于细胞核。
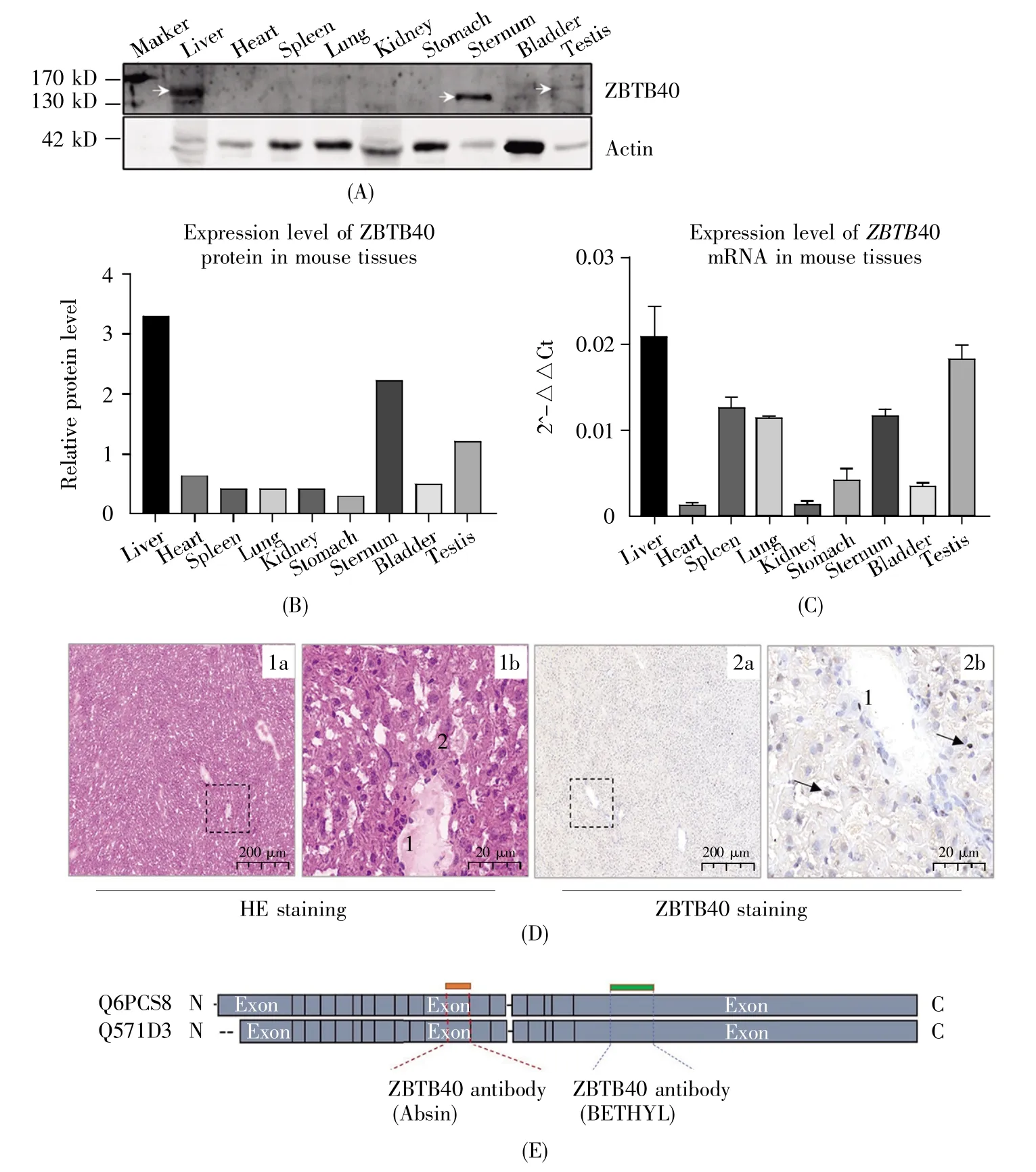
图1 ZBTB40在C57BL/6J小鼠不同组织中的表达(A)采用Western-blot实验检测ZBTB40在小鼠9种组织中的表达水平,箭头指示目标条带;(B)用ImageJ计算的图A中蛋白质的定量结果;(C)采用qRT-PCR技术检测ZBTB40在小鼠组织中的mRNA水平;(D)野生型成年小鼠肝脏HE染色和免疫组织化学染色结果。图D中,1b、2b小图中的1为中央静脉,2为肝细胞索,1b、2b分别为1a和2a中黑色虚线框的放大视野(40×),2b中黑色箭头指示ZBTB40在肝细胞核内有表达;(E)小鼠ZBTB40基因两种剪切本的外显子差异比较。两种ZBTB40抗体(abs134922-1、A301-932A)均来源于兔,UniProt ID:Q9NUA8,反应种属为human和mouse,抗体识别区域分别用橘色和绿色矩形指示。Fig.1 Expression of ZBTB40 in different tissues of C57BL/6J mice(A)The levels of ZBTB40 protein in 9 tissues of mice compared by Western-blot assay.The arrows indicate target bands;(B)The gray values of the target protein bands in(A)using ImageJ;(C)The mRNA expression levels of ZBTB40 in mouse tissues detected by qRT-PCR;(D)HE staining and immunohistochemical analysis of wild-type adult mouse liver.In Fig.1b,2b,“1”indicates central vein;“2”indicates hepatocyte cord.Figs.1b and 2b show the enlarged fields(40×)enclosed by black dotted-lines in Figs.1a and 2a,respectively.The black arrows point to the nucleus stained by ZBTB40 antibody;(E)Comparison of two isoforms of mouse ZBTB40 gene.Both ZBTB40 antibodies(abs134922-1,A301-932A)were derived from rabbits.UniProt ID:Q9NUA8.Reacted species:human,mouse.The antibody recognition areas are indicated by the orange and green rectangles.
2.2 ZBTB40在多种人类细胞系中的表达
Western-blot检测结果显示:ZBTB40在8种人类细胞系中的表达丰度由高到低依次为HeLa、A549、U2OS、PC-3、HEK 293T、HepG2、MCF-7 和Saos-2;在乳腺癌细胞(MCF-7)、成骨肉瘤细胞(Saos-2)中该蛋白质几乎检测不到,而在宫颈癌细胞(HeLa)、非小细胞肺癌细胞(A549)和肝癌细胞系(HepG2)中其表达量较高(图2A~B)。进一步采用qRT-PCR检测ZBTB40基因在以上细胞中的mRNA表达水平,结果表明其mRNA表达水平和蛋白质表达谱之间有一定差异,比如:Saos-2细胞中ZBTB40的mRNA水平与HeLa细胞相当,而蛋白质水平则远比HeLa细胞低;A549细胞中ZBTB40的mRNA水平较低且与MCF-7细胞相当,而蛋白质表达水平却远高于后者(图2C)。以上结果提示,这些细胞系中可能存在不同机制对ZBTB40的mRNA翻译效率和/或蛋白质稳定性进行调节,从而导致其mRNA和蛋白质丰度之间存在显著差异。
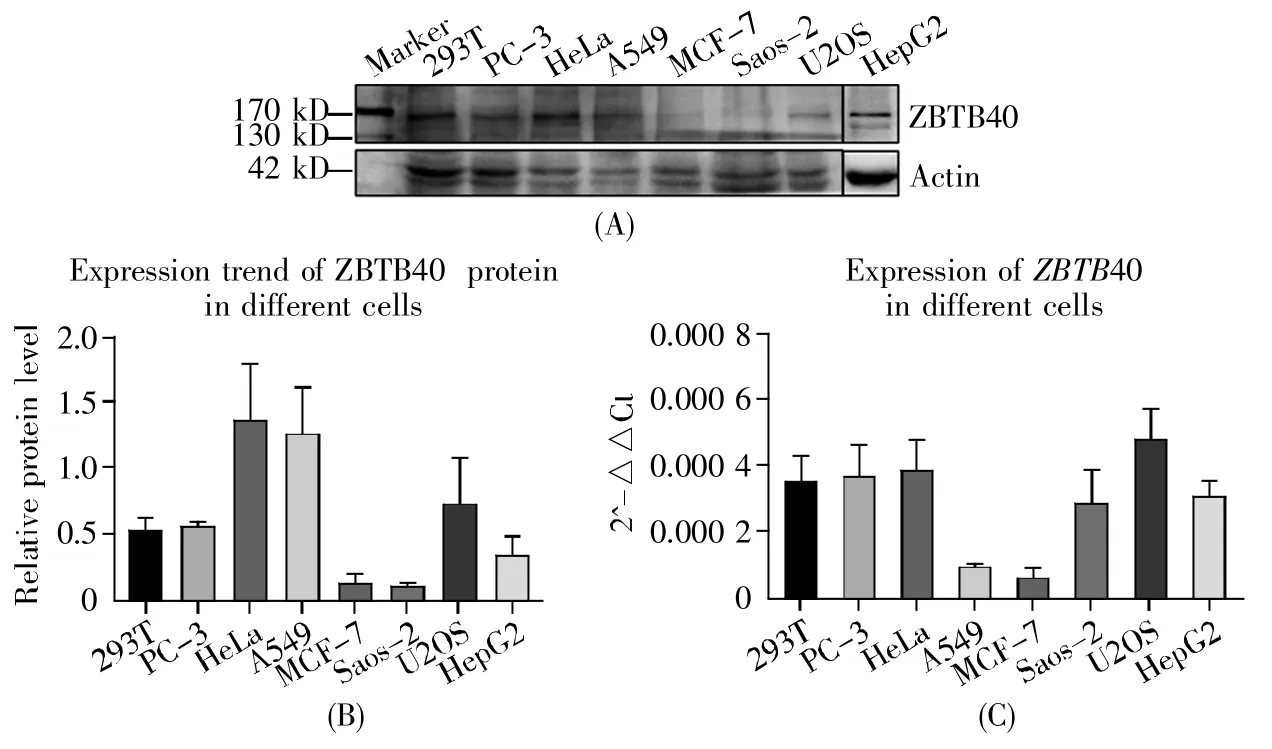
图2 ZBTB40在不同细胞系中的表达(A)采用Western-blot实验检测8种人类细胞系中ZBTB40蛋白的相对丰度;(B)采用ImageJ计算的图A中蛋白质的定量结果;(C)采用qRT-PCR方法检测ZBTB40的mRNA在8种细胞系中的表达水平。Fig.2 Expression of ZBTB40 in different cell lines(A)The relative abundance of ZBTB40 protein in eight human cell lines analyzed by Western-blot;(B)Quantification for the Western-blot results in(A)using ImageJ;(C)The mRNA levels of ZBTB40 in eight human cell lines using qRT-PCR.
2.3 ZBTB40在人肝癌/癌旁组织中的表达
由于ZBTB40在小鼠肝组织和人类肝癌细胞系(HepG2)中高表达,我们推测其可能在肝脏中发挥重要作用。肝细胞癌(hepatocellular carcinoma,HCC)是原发性肝癌中最常见的一种,在我国占肝癌总数的85%左右[30~31]。肝细胞癌旁(hepatocellular para-carcinoma,HCCP)组织通常是指距病灶2~5 cm的组织。为了初步验证上述推测,我们对5位HCC患者的癌组织/癌旁组织进行了ZBTB40表达水平的检测。Western-blot结果提示,ZBTB40在肿瘤组织中的表达水平均明显低于癌旁组织;在有癌症分级信息的3例样本中,低分级样本(HCC-1)相比较高分级的样本(HCC-2和HCC-5)具有更高的ZBTB40表达水平(图3A)。样本HCC-1/HCCP-1和HCC-2/HCCP-2的qRT-PCR结果(图3B)提示,ZBTB40的mRNA表达趋势与Westernblot结果一致。我们进一步对HCC-1和HCC-2两个样本做了HE和免疫组织化学染色,结果表明,ZBTB40的表达主要聚集于肝癌实质细胞的细胞核,在基质中表达较低(图3C)。然而,HCC-2为低分化肝癌样本,存在大量的癌基质,这可能是ZBTB40的总体相对丰度在癌组织低于癌旁组织的主要原因。
图3 ZBTB40在肝细胞癌/癌旁组织中的表达分析(A)5对癌组织/癌旁组织的蛋白质样本的Western-blot实验结果;(B)qRT-PCR检测样本HCC-1/HCCP-1、HCC-2/HCCP-2中ZBTB40的mRNA水平,***:P<0.01;(C)HCC-1和HCC-2的HE染色和免疫组织化学染色结果,黑色箭头指示组织中的肝癌细胞。Fig.3 Expression analysis of ZBTB40 in HCC/HCCP tissues(A)Western-blot results of 5 pairs of HCC/HCCP tissues;(B)The mRNA expression levels of ZBTB40 in HCC-1/HCCP-1 and HCC-2/HCCP-2 samples were detected by qRT-PCR.***:P<0.01;(C)The results of HE and IHC stainings of HCC-1 and HCC-2.The black arrows indicate the HCC cells in the tissues.
2.4 ZBTB40异常表达与肝癌患者预后生存率相关
使用Kaplan-Meier plotter网络服务,查询TCGA数据库中收集的364例人肝癌患者(男性246例,女性118例)的数据,依据ZBTB40蛋白的表达水平,把患者分为ZBTB40高表达组和低表达组,研究两组患者的预后差异。结果表明,ZBTB40高表达是肝癌患者预后的消极因素[风险比(hazard ratio,HR)=2.25,log(rank P)<0.000 1],增加了患者死亡风险,提示ZBTB40可能是潜在的肝癌预后不良分子标志(图4A)。已知肝癌在男性中的发生率远高于女性[32~33],其原因较为复杂,可能与行为及生理等因素存在差异相关。我们对男性和女性患者分别进行了同样的预后差异分析,结果表明ZBTB40高表达带来风险的比例在男性中远高于女性(2.62 vs.1.8)(图4B~C),提示ZBTB40参与了性别相关的肝癌发生过程。
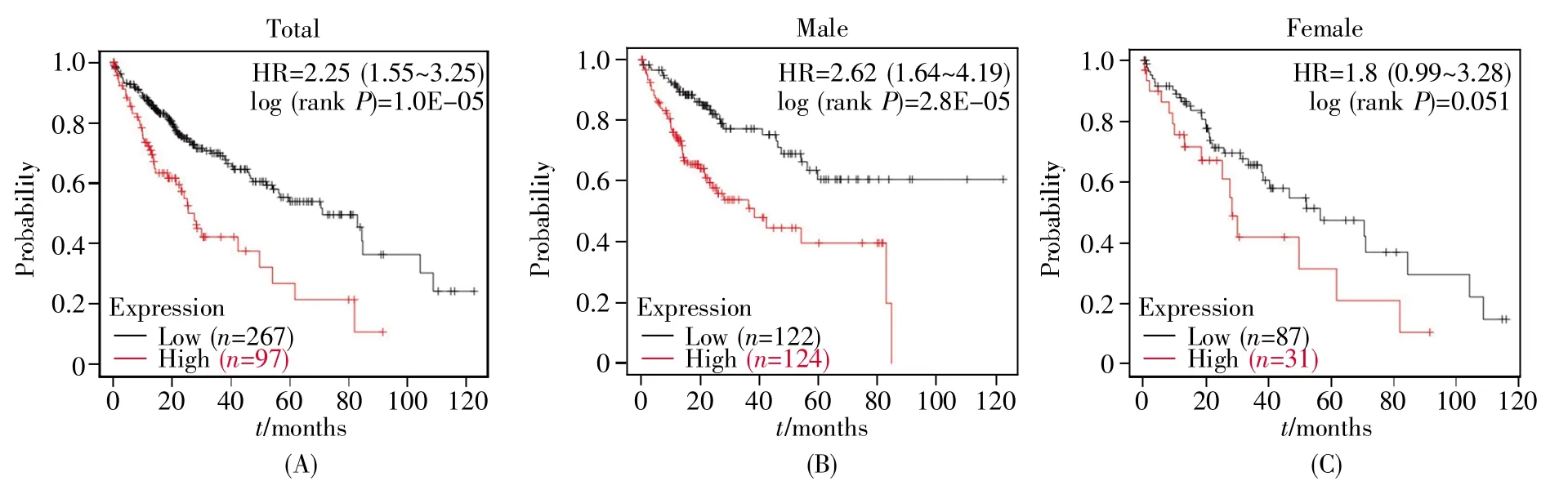
图4 ZBTB40的表达水平与肝癌患者预后生存时间的关联分析(A)ZBTB40表达水平较高和较低的肝癌患者预后生存时间的统计分析;(B~C)具有不同ZBTB40表达水平的男性和女性肝癌患者的生存率分析。Fig.4 The influence of ZBTB40 expression level on overall survival of liver cancer patients(A)Analysis of prognosis and overall survival of patients with liver cancer;(B~C)Survival analysis of male and female HCC patients with different ZBTB40 expression levels.
2.5 ZBTB40慢病毒表达质粒的构建
用Gateway Clone技术构建表达质粒pLenti-Flag-ZBTB40-HA-attB-IRES-puro,扩增后进行快速内切酶AgeⅠ和ApaⅠ双酶切以及NotⅠ单酶切,采用凝胶电泳验证片段大小。凝胶电泳结果(图5B)提示,质粒酶切片段大小正确。选取经酶切鉴定正确的样本送至北京擎科生物科技有限公司测序,测序结果表明质粒序列无碱基缺失、插入、突变。
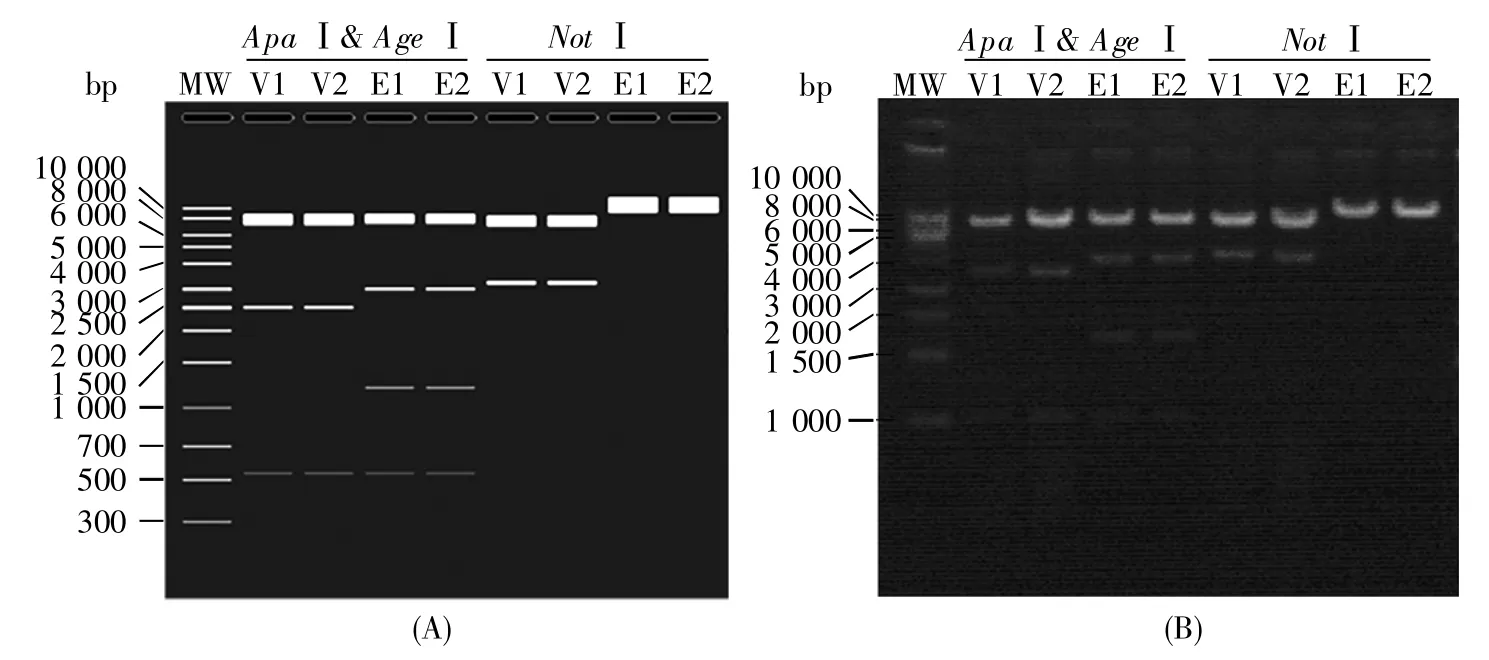
图5 载体质粒和表达质粒的酶切结果(A)SnapGene软件设计的质粒酶切模拟图;(B)质粒经AgeⅠ和ApaⅠ双酶切或NotⅠ单酶切后的凝胶电泳结果。图中E1、E2为两个构建的表达质粒单克隆样本,V1、V2为两个载体质粒单克隆样本,MW:分子量标准。Fig.5 Results of enzyme digestion of vector and expression plasmids(A)Plasmid enzyme digestion map simulated by SnapGene software;(B)The results of plasmid enzyme digestion using ApaⅠ & AgeⅠand NotⅠ.E1 and E2 represent clones of the two constructed expression plasmids.V1 and V2 are the plasmid samples.MW:Marker.
2.6 ZBTB40-FLAG稳定表达细胞株的构建
经慢病毒包装、感染U2OS细胞、嘌呤霉素药筛一周后挑取细胞单克隆并扩增,随后提取细胞蛋白质进行Western-blot验证,结果显示U2OS克隆细胞株(Clone组)中ZBTB40蛋白的表达水平与阴性对照(negative control,NC)相比明显增高(图6A~B)。进一步用qRT-PCR检测实验细胞株和对照细胞中ZBTB40的mRNA水平,结果显示实验细胞株中ZBTB40的mRNA水平同样显著增高(图6C)。以上结果证实,本研究获得了人ZBTB40的稳定表达细胞株。

图6 ZBTB40稳定表达细胞株的鉴定(A~B)Western-blot检测ZBTB40蛋白的表达水平。其中,图A的一抗为Human ZBTB40 Rabbit Polyclonal,图B的一抗为Monoclonal ANTI-FLAG®M2;(C)qRT-PCR法检测ZBTB40的mRNA表达水平,***:P<0.01。NC代表未做处理的细胞,作为阴性对照;Clone为克隆细胞株。Fig.6 Identification of cell lines stably expressing ZBTB40(A~B)Western-blot was used to detect the expression level of ZBTB40 protein.In Fig.A,Human ZBTB40 Rabbit Polyclonal as primary antibody.In Fig.B,Monoclonal ANTI-FLAG®M2 as primary antibody;(C)The expression trends of ZBTB40 in cells detected by qRT-PCR.***:P<0.01.NC indicates untreated cells,which is used as a negative control;Clone indicates the stable cell clone.
3 讨论
近年,越来越多研究表明ZBTB蛋白家族参与了一系列复杂的细胞生理过程如DNA甲基化[19~21]、端粒保护[22~23]等,与多种疾病包括癌症相关[13~18]。然而,人们对ZBTB蛋白家族的生物功能和相关分子机制还知之甚少。ZBTB40是该家族中相对分子质量最大的成员,其在人类等高等动物中的生理功能也还不清楚。已有研究表明,ZBTB40在雄性石斑鱼的各阶段生殖细胞中特异性高表达,尤其是在精原细胞和精子细胞中[26]。本研究在小鼠的睾丸组织中也检测到了ZBTB40的特异性表达(图1C),提示该基因是否与小鼠睾丸发育和精子发生相关值得深入研究。
本研究首次发现ZBTB40在小鼠肝脏中高表达(图1A~C),提示其可能与肝脏的生理功能有重要关系。而且,其在HepG2细胞系和5例人原发性肝细胞癌的癌旁组织中均有表达(图2~3),提示ZBTB40很可能也在人的正常肝组织中有表达。有意思的是,本研究发现ZBTB40基因在肝癌细胞中显著高表达,且该现象在早期和中晚期肝癌中都有发现(图3C),提示ZBTB40的异常表达可能起始于肝癌发展早期,并持续至癌症的中晚期。已知肝癌的发生、发展过程在不同性别中差异明显[32],本文的生存分析结果显示ZBTB40的表达水平与男性患者的预后更为相关(图4),其原因有待进一步研究。考虑到已有ZBTB家族成员(如HIC-1)被鉴定为重要的抑癌基因[19~21],估计进一步研究ZBTB40与肝癌发生发展之间的关系具有重要意义。
文献报道,ZBTB40高表达可以促进成骨细胞发育,增加骨密度,降低女性骨质疏松易感性[24~25]。本研究也检测到ZBTB40在小鼠的胸骨中高表达(图1A~C),但该蛋白质的相对分子质量略小于肝脏和睾丸中ZBTB40的相对分子质量。通过查找数据,我们发现在人类中也有与之相对应的两个转录本 XP_011540801.1(148 kD)和XP_024307065.1(135 kD),故推测这个较小的ZBTB40转录本也许在人类骨组织中表达。而这两个转录本之间的功能的区别和联系是什么?它们选择性表达的分子机制是什么?值得进一步深入探究。
此外,通过比较ZBTB40在不同细胞和组织中的mRNA和蛋白质水平,我们发现两个表达谱之间有相关性,同时也有比较明显的区别。这提示在不同细胞和组织中ZBTB40的mRNA和蛋白质存在着不同的调控机制。值得注意的是,有报道显示,ZBTB40基因编码的lncRNA具有与其蛋白质产物相反的功能[25],因此在该lncRNA高表达的细胞中,ZBTB40蛋白的丰度很低是完全有可能的。设计针对lncRNA的特异性引物,检测其在小鼠脾脏和肺组织中的表达水平,将有助于解释为何在这两种组织中ZBTB40的mRNA表达水平高而蛋白质却检测不到。
4 结论
ZBTB40蛋白在小鼠肝脏、胸骨和睾丸中高水平表达。在人类肝癌组织中,ZBTB40在癌细胞的细胞核中高度聚集,并与患者的生存时间显著相关。这些结果提示ZBTB40的异常表达可能与肝脏肿瘤的发展相关,值得进一步研究。此外,本研究成功构建了ZBTB40过表达质粒,为后续深入研究ZBTB40的生理功能和分子调控机制提供了重要材料。
