不同浓度和时间NaCl处理对水培冰菜生长和盐囊细胞的影响
2021-09-03李慧霞路亚南杨瑞刘明星周刚吕福虎
李慧霞 路亚南 杨瑞 刘明星 周刚 吕福虎

摘要 以水培“非洲冰菜”为试验材料,研究不同浓度NaCl处理和不同处理时间对冰菜生长、无机离子含量和盐囊细胞数量和形态的影响。试验1:分别设定0、0.05、0.15和0.25 mol/L NaCl 4个处理;试验2:设定CK(始终不添加NaCl),和分别在0、7和14 d后添加0.05 mol/L NaCl 4个处理,以日本园试营养液配方为基础培养液,栽培28 d。结果表明,随着盐处理浓度的增加,冰菜地上部和地下部干鲜重减少,无机离子除Na增加外,K、Ca、Mg和P的含量均随NaCl浓度的增加而减少,说明冰菜高产栽培最适盐浓度为0.05 mol/L,但冰菜地上部鲜重在0.25 mol/L 處理下与对照差异不显著,说明冰菜还可以忍耐更高浓度的盐胁迫。随着盐浓度的增加,盐囊细胞因积累大量的NaCl和水分而变得大而稀疏。此外,处理时间越早,冰菜干、鲜重越大,说明盐胁迫处理越早越好,但处理时间对无机离子的含量影响不显著。
关键词 冰菜;无土栽培;NaCl胁迫;盐囊细胞
中图分类号 S 649 文献标识码 A
文章编号 0517-6611(2021)14-0057-04
Abstract In this study, hydroponic “African ice plant” was used as the experimental material to study the effects of different concentrations of NaCl treatment and different treatment time on Mesembryanthemum crystallinum L. growth, inorganic content and the number and morphology of epidermal bladder cells(EBCs). Four NaCl treatments(0, 0.05, 0.15 and 0.25 mol/L)in experiment 1 and four NaCl treatment times CK,(always do not add NaCl)and adding 0.05 mol/L NaCl after 0, 7 and 14 days in experiment 2 were set for 28 days based on the nutrient solutionthe of Japanese garden formula. The results showed that with the concentration of salt treatment increase, the dry and fresh weight of the shoot and root of ice plant decreased, and the content of K, Ca, Mg and P decreased with the increase of NaCl concentration, except Na contents increased, which indicated that the optimal salt concentration for highyield cultivation of ice plant was 0.05 mol/L. There was no significant difference between 0.25 mol/L treatment and the control of shoot fresh weight, indicating that ice plant could tolerate higher concentration of salt stress. As the salt concentration increased, the EBCs became larger and sparse due to the accumulation of a large amount of NaCl and water. In addition, the earlier the salt treatment time, the greater the shoot fresh and dry weight of ice plant, indicating that the earlier the salt stress treatment the better, but the treatment time had no significant effect on the content of inorganic.
Key words Ice plant;Soilless;NaCl stress;Epidermal bladder cells
基金项目 包头市青年创新人才项目。
作者简介 李慧霞(1984—),女,山西浑源人,助理研究员,博士,从事设施无土栽培研究。*通信作者,副研究员,从事设施蔬菜栽培研究。
收稿日期 2020-12-18
近年来,由于盐害造成的土壤盐碱化问题在全世界范围内扩大,受盐害的地区超过100个国家,面积达83 100万hm2[1]。土壤盐碱化是世界范围内普遍存在的问题,严重影响植物的生长和发育。在盐胁迫栽培环境下,植物常表现为叶色深绿,植株矮化,最终产量减少,且随着盐浓度的增高和盐胁迫时间的加长,矮化越严重,一些耐盐性较弱的植物生长受阻甚至枯死[2-4]。因此,研究耐盐植物在盐碱地环境下的耐盐机制,对沿海地区和内陆盐碱地的作物生长和盐碱地改良等尤为重要。近年来,备受关注的可作为食用盐性植物的冰菜,因其具有独特的耐盐机制,能在高盐的土壤中生长繁殖,而被作为研究耐盐机制的模式植物。
冰菜 (Mesembryanthemum crystallinum L.)又名冰叶日中花,是番杏科日中花属一年生草本植物,其特点是在叶面和茎上着生有大量的泡状细胞,称作盐囊细胞(epidermal bladder cells,EBCs),在太阳光照射下像冰晶一样,因此而得名[5-6]。冰菜具有极强的抗旱性和耐盐性,是典型的泌盐植物,在受到盐胁迫后能把吸收进去多余的盐分,通过茎、叶表面密布的盐腺排到盐囊细胞中,因此,盐囊细胞对冰菜的耐盐性起着关键作用[7-9]。
盐胁迫是影响作物产量的主要逆境胁迫之一,盐胁迫能快速扰动植物初级代谢,使其生长受阻,气孔关闭,光合作用下降,渗透性和离子失衡进而导致生理干旱,酶活性受损、细胞损伤和坏死[2,10]。但植物耐盐性是一个受多基因、复杂环境控制的生理过程,且不同植物的耐盐机制也不尽相同。研究表明,冰菜可在与海水相同浓度(含盐度35‰、0.5 mol/L)的盐胁迫下正常生长[5,11],但也有研究表明冰菜在接近海水高浓度盐胁迫处理下栽培生长受抑制甚至死亡[12-13]。这可能是试验的冰菜品种和试验条件不同而有所差异,且植物受盐害程度不仅取决于盐胁迫水平,还取决于植物的抗盐能力和盐胁迫的时间[4,10]。国内外关于冰菜的耐盐机制研究,主要集中在盐胁迫处理下不同信号物质在C3-CAM转化过程中的作用[14],另外,关于耐盐机理过程中Na+/H+逆向转运系统、离子分布[15]以及盐胁迫下水通道蛋白调控和基因表达[16]和抗氧化胁迫[13]等方面取得了一定的研究成果。笔者以水培冰菜为试验材料,研究不同浓度盐胁迫和胁迫时间处理对冰菜生长和离子吸收的影响,以及对盐囊细胞的数量和形态变化的影响,旨在为揭示冰菜的耐盐机制提供理论依据。
1 材料与方法
1.1 试验材料
试验用冰菜品种为“非洲冰菜”,种子购自北京凤鸣雅世科技发展有限公司。冰菜种子播于50穴穴盘中,待长出4片真叶后移栽到装有陶粒的水培定植篮(直径8 cm),放置于铺有塑料薄膜的苗盘中,浇1/2倍日本园试营养液配方,直到8片真叶后开始试验。试验在包头市农牧业科学研究院温室内进行。
1.2 试验方法 采用日本园试配方。试验1:设定基本培养液0 mol/L(无NaCl)区为对照区,和在基本培养液中加入0.05、0.15、0.25 mol/L NaCl共4个处理区,不同处理营养液EC初始值和NaCl添加量见表1。试验2:设定基本培养液CK(始终不添加NaCl),和分别在0、7和14 d后添加0.05 mol/L NaCl 4个处理。试验①和试验②每个处理2个重复,每隔7 d调节pH至6.0,并补充水分至原始设定值,处理时间为28 d。
1.3 测定项目与方法
最大叶长、叶幅每7 d测量一次,收获后,分别测量地上和地下部分的鮮重和干重。计算植株含水量=(植株鲜重-植株干重)/植株鲜重×100%。
干样测定无机成分含量:全氮采用凯氏定氮法测定,Na、K采用火焰光度法测定,Mg、Ca采用EDTA滴定法测定,P采用钒钼黄比色-紫外分光光度计测定,参照鲍士坦[17]的试验方法测定。
盐囊细胞用实体显微镜观察试验1得到的样品,调查盐囊细胞数量和形态的差异。
1.4 数据分析 试验数据采用Excel 2007和SPSS 20.0软件进行统计分析。
2 结果与分析
2.1 不同浓度盐处理对冰菜干鲜重的影响
不同浓度的NaCl处理引起了冰菜干鲜质量的差异(表2)。在0.05 mol/L处理下,各干鲜质量指标最大,且地上部干、鲜重显著高于对照,分别为对照的1.7和2.2倍。随着NaCl浓度的增加,地上部干鲜重和地下部干鲜重逐渐减少。NaCl浓度在0.05和0.15 mol/L处理下,地上部鲜重、地上部干重和地下部干重差异不显著。当浓度达0.25 mol/L时,地上干鲜重和对照相比差异不显著。NaCl处理下冰菜地上部含水量均有不同程度的增加,且在0.25 mol/L处理达到最大,说明盐胁迫促进冰菜叶片和茎对水分的储藏。
2.2 不同浓度盐处理对冰菜叶片无机成分含量的影响 由表3可知,矿物元素中Na含量随NaCl浓度增加而增加,但大量元素中K、Ca、Mg和P的含量随NaCl浓度的增加而减少,且显著低于对照。NaCl各处理下N含量的变化不大,均显著低于对照。盐处理下,除Na含量增加外,其他大量元素均呈下降趋势。
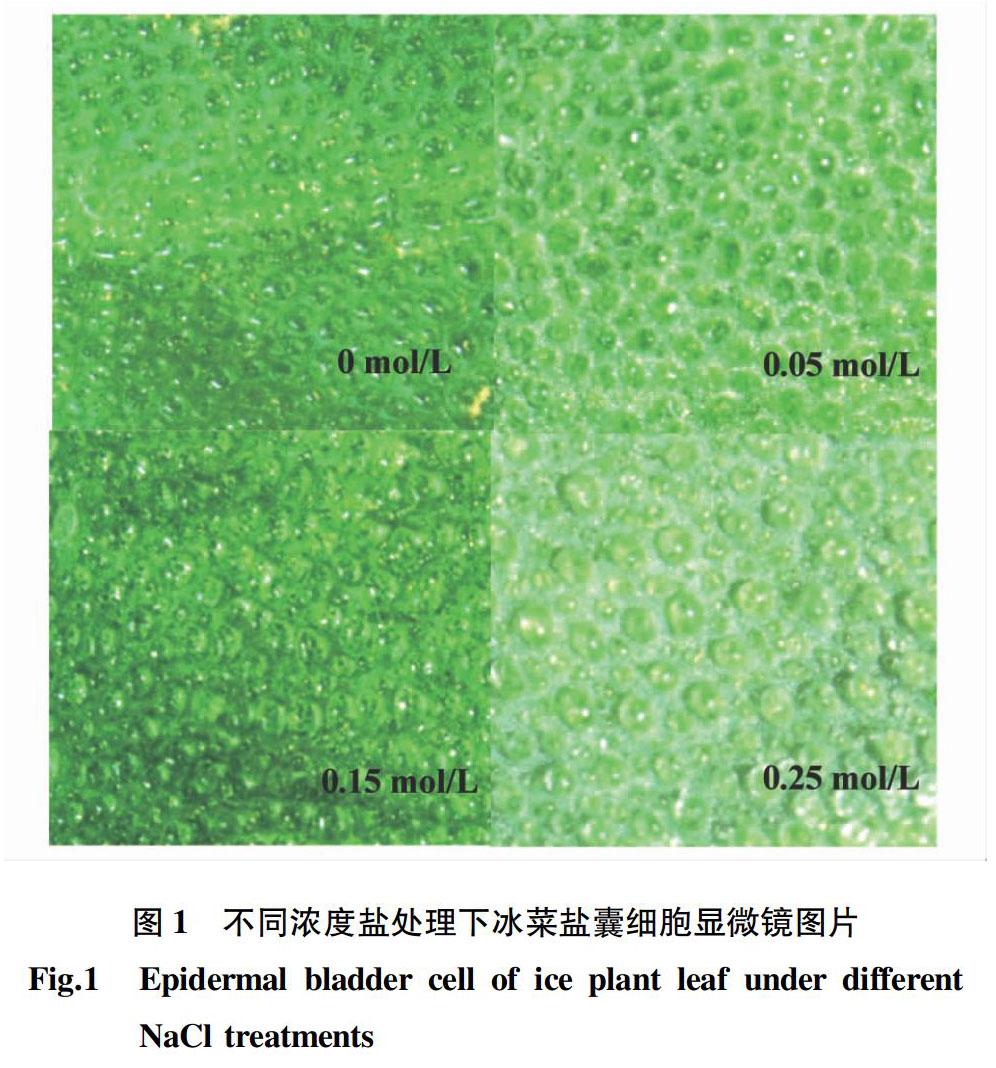
2.3 不同浓度盐处理对冰菜叶片盐囊细胞的影响 不同浓度盐处理对冰菜盐囊细胞的影响见表4和图1。冰菜表面和背面的盐囊细胞数量表现为0 mol/L>0.05 mol/L>0.15 mol/L>0.25 mol/L,对照和0.05 mol/L处理下盐囊细胞小而密集,而0.15和0.25 mol/L处理下的盐囊细胞大而稀疏,且大小分布不均。
2.4 不同浓度盐处理对冰菜叶片形态的影响
不同浓度盐处理叶片生长随处理时间变化见图2。由图2可知,随着定植时间的推移,不同浓度NaCl处理的冰菜植株叶长和叶宽逐渐增大。定植7 d后,随着处理时间的增加,对照、0.05 mol/L 和0.15 mol/L处理下叶长和叶宽增幅明显大于0.25 mol/L 处理。定植21 d后,对照处理下的叶片生长变缓慢;在定植28 d后,0.05和0.15 mol/L处理叶长和叶宽达到最大,在整个生长过程中叶长和叶宽在盐处理0.25 mol/L下最小,说明高浓度的NaCl促使叶片短缩。
2.5 不同盐处理时间对冰菜叶片形态的影响
不同盐处理时间对冰菜干鲜重和无机成分含量的影响见表5和6。由表5和表6可知,处理时间越长,冰菜干、鲜重越大,说明冰菜喜盐且盐处理时间越早越好。盐处理下N和P含量减少,但不同处理时间对N和P含量的影响差异不显著;盐处理和处理时间K含量变化不明显,但Na含量随处理时间越短,含量越少。
3 结论与讨论
生物量是植物对盐胁迫反应的综合体现,也是体现植物耐盐性的直接指标之一[18],盐胁迫下盐生植物不同器官存在最适盐度,一定盐度范围对植物生长影响较小。该试验冰菜在0.05和0.15 mol/L NaCl处理下,地上部生长量显著大于对照,说明冰菜喜盐,这与大部分试验结果一致,但2个处理下地下部鲜重差异显著,说明冰菜根系的最适盐胁迫处
理为0.05 mol/L。但徐微风等[13]和段瑞军等[19]研究表明,灌溉水中20%~40%海水浓度的环境最适合冰菜生长,株高、叶长、叶宽和分枝数均显著高于对照,且低浓度海水没有对冰菜产生氧化胁迫和胁迫损伤。0.25 mol/L NaCl(海水浓度50%)下地上部鲜重和对照差异不显著,说明冰菜还可以耐受更高浓度的盐胁迫,但该处理7 d后叶长和叶宽逐渐低于其他处理和对照,虽然0.25 mol/L处理对植株重量影响不显著,但随着盐浓度的增加和处理时间的延长明显改变叶片的形态建成。
盐囊细胞(EBCs)是冰菜的耐盐特异化细胞,存在于除根以外的所有组织表面[20]。分布在叶片和肉质茎表面的盐囊细胞在受到盐胁迫时,可以储存大量的NaCl和水,以促进植物的生长发育,提高盐胁迫条件下的繁殖能力[7,21]。研究表明盐胁迫下的盐囊细胞呈隆状的凸起,可累积多达1.2 mol/L的NaCl[22]。该试验盐处理下,EBCs随NaCl浓度的增加盐囊细胞数减少,排列稀疏,这是由于随着NaCl吸收量的增加,在盐囊细胞内积蓄的NaCl和水量增加,导致细胞膨胀,且盐浓度越高,细胞膨大越明显。但徐微风等[8]研究表明,低浓度(≤40%)冰菜表皮盐囊泡的数量和形态差异不显著,这可能与水培条件下冰菜对Na+吸收量变大,导致对盐胁迫缓冲作用变小。
此外,EBCs的另一个重要作用是渗透性调节作用。盐胁迫下,植物可通过累积各种渗透调节物质来维持一定的渗透势,使植物的生长、呼吸和光合作用等生理过程能正常进行[23]。渗透调节物质主要有两大类:一类是有机溶质,主要包括游离的氨基酸、可溶性糖、多元醇和可溶性蛋白质等物质[24-25];另一类是无机离子,如Na+、K+、Ca2+等[26-27]。焦云鹏[28]通过与几种叶菜类蔬菜(生菜、油麦菜、菠菜)进行对比分析发现,冰菜含有丰富的Na、K、Fe、Zn等矿物质,其中,Na、K和Mg的含量分别为30、18和1 mg/g,是其他叶菜类含量的3~34倍,该试验水培条件下栽培的冰菜,非盐胁迫下矿质离子除Na含量接近外,其他离子均明显大于土壤栽培。
盐胁迫下,盐离子含量在细胞内的大量积累造成植物体内离子毒害,对生物膜造成损害,进而影响植物的生长发育。Na+是盐胁迫的主要毒害离子,高盐浓度下,Na+与K+、Ca2+等其他阳离子竞争产生离子拮抗,从而引起植物体内K+、Ca2+等的亏缺[26,29]。因此,提高植物体内K+、Ca2+、Mg2+等阳离子与Na+的离子比,对提高植物耐盐性至关重要。该试验中,除Na含量随盐胁迫浓度的增加而增加外,K、Mg、Ca等均随胁迫浓度增加而减少,但胁迫时间对离子含量影响较小。
综上所述,冰菜因含有丰富的Na、K等,被认为是高营养的生食蔬菜。该试验通过盐处理后,矿物质含量有减少的倾向。在不影响产量和不损失高矿物质成分栽培条件下,冰菜最适高产栽培应控制盐浓度在0.05 mol/L NaCl浓度左右。该试验中高浓度下(海水浓度一半)盐胁迫对冰菜无机离子吸收和盐囊细胞数量和大小有所影响,但地上部鲜重与非盐处理差异不显著,说明冰菜还可以在更高盐浓度下生长。
参考文献
[1] MONTESANO F F,VAN IERSEL M W.Calcium can prevent toxic effects of Na+ on tomato leaf photosynthesis but does not restore growth[J].Journal of the American society for horticultural science,2007,132(3):310-318.
[2] BALL M C,ANDERSON J M.Sensitivity of photosystems Ⅱ to NaCl in relation to salinity tolerance.Comparative studies with thylakoids of the salt tolerant mangrove, Avicennia marina, and the saltsensitive pea, Pisum sativum [J].Functional plant biology,1986,13(5):689-698.
[3] 刘慧颖,韩玉燕,蒋润枝,等.NaCl对冰菜生长发育及重要品质的影响[J] .江苏农业科学,2019,47(15):184-188.
[4] 陈年来,马国军,张玉鑫,等.甜瓜種子萌发和幼苗生长对NaCl胁迫的响应[J].中国沙漠,2006,26(5):814-819.
[5] 张洪磊,刘孟霞.冰菜特征特性及控盐高产栽培技术[J].陕西农业科学,2015,61(3):122-124.
[6] 贾文雄.日光温室冰菜栽培技术[J].西北园艺(蔬菜),2016(5):27-28.
[7] AGARIE S,SHIMODA T,SHIMIZU Y,et al.Salt tolerance,salt accumulation,and ionic homeostasis in an epidermal bladdercellless mutant of the common ice plant Mesembryanthemum crystallinum [J].Journal of experimental botany,2007,58(8):1957-1967.
[8] 徐微风,段瑞军,吕瑞,等.不同浓度海水胁迫下冰菜表皮盐囊泡数量、形态和含盐量的变化[J].江苏农业科学,2019,47(2):115-118.
[9] 丰宇凯,李飞飞,王华森.冰叶日中花耐盐机制的研究进展[J].湖北农业科学,2018,57(23):15-18,147.
[10] MADAWALA S,HARTLEY S,GOULD K S.Comparative growth and photosynthetic responses of native and adventive iceplant taxa to salinity stress[J].New Zealand journal of botany,2014,52(3):352-364.
[11] KUZNETSOV V V,NETO D S,BORISOVA N N,et al.Stress induced CAM development and the limit of adaptation potential in Mesembryanthemum crystallinum plants under extreme conditions[J].Russian journal of plant physiology,2000,47(2):168-175.
[12] 李广鲁,胡增辉,冷平生.冰叶日中花对NaCl胁迫的生理响应[J].北京农学院学报,2015,30(1):64-70.
[13] 徐微风,覃和业,刘姣,等.冰菜在不同浓度海水胁迫下的氧化胁迫和抗氧化酶活性变化[J].江苏农业学报,2017,33(4):775-781.
[14] S′LESAK I,LIBIK M,MISZALSKI Z.The foliar concentration of hydrogen peroxide during saltinduced C3CAM transition in Mesembryanthemum crystallinum L.[J].Plant science,2008,174(2):221-226.
[15] COSENTINO C,FISCHERSCHLIEBS E,BERTL A,et al.Na+/H+ antiporters are differentially regulated in response to NaCl stress in leaves and roots of Mesembryanthemum crystallinum [J].New phytologist,2010,186(3):669-680.
[16] KIRCH H H,VERAESTRELLA R,GOLLDACK D,et al. Expression of water channel proteins in Mesembryanthemum crystallinum [J].Plant physiology,2000,123(1):111-124.
[17] 鲍士坦.土壤农化分析——土壤、农业化学、资源与环境专业用[M].北京:中国农业出版社,2005:264-274.
[18] LEVITT J.Responses of plants to environmental stresses[M].2nd ed.New York:Academic Press,1980:365-434.
[19] 段瑞军,吴朝波,王军,等.海水对冰菜生长、营养品质影响及叶片多胺物质耐盐响应[J].江西农业大学学报,2019,41(5):881-889.
[20] OH D H,BARKLA B J,VERAESTRELLA R,et al.Cell type-specific responses to salinitythe epidermal bladder cell transcriptome of Mesembryanthemum crystallinum [J].New phytologist,2015,207(3):627-644.
[21] ADAMS P,NELSON D E,YAMADA S,et al.Growth and development of Mesembryanthemum crystallinum (Aizoaceae)[J].New phytologist,1998,138(2):171-190.
[22] BARKLA B J,VERAESTRELLA R,CAMACHOEMITERIO J,et al.Na+/H+exchange in the halophyte Mesembryanthemum crystallinum is associated with cellular sites of Na+storage[J].Functional plant biology,2002,29(9):1017-1024.
[23] ADAMS P,THOMAS J C,VERNON D M,et al.Distinct cellular and organismic responses to salt stress[J].Plant and cell physiology,1992,33(8):1215-1223.
[24] AGARIE S,SHIMODA T,SHIMIZU Y,et al.Salt tolerance,salt accumulation,and ionic homeostasis in an epidermal bladdercellless mutant of the common ice plant Mesembryanthemum crystallinum [J].Journal of experimental botany,2007,58(8):1957-1967.
[25] AGARIE S,KAWAGUCHI A,KODERA A,et al.Potential of the common ice plant, Mesembryanthemum crystallinum as a new highfunctional food as evaluated by polyol accumulation[J].Plant production science,2009,12(1):37-46.
[26] 左照江,張汝民,高岩.盐胁迫下植物细胞离子流变化的研究进展[J].浙江农林大学学报,2014,31(5):805-811.
[27] 李广鲁,王文果,陈志新,等.钙对盐胁迫下冰叶日中花不同器官离子含量和根部K+、Na+吸收的影响[J].植物科学学报,2018,36(2):282-290.
[28] 焦云鹏.水晶冰菜的营养分析及评价[J].食品研究与开发,2019,40(9):181-185.
[29] MUNNS R,TESTER M.Mechanisms of salinity tolerance[J].Annual review of plant biology,2008,59:651-681.
