实时定量PCR对检测乳腺癌CK-19及CK5/6的诊断及疗效分析
2021-09-01
(南通大学附属建湖医院,南通 224700)
乳腺癌患者早期症状不明显,晚期癌细胞侵袭周围正常组织,并向远处转移,损伤多器官功能,造成病变,威胁患者生命[1]。乳腺癌的发病机制尚不明确,但已经证实多种危险因素与其发病有关;常见因素有月经初潮年龄早(<12岁)、绝经年龄晚(>55岁)、不孕及初次生育年龄晚(>30岁)、哺乳时间短、停经后进行雌激素替代疗法等均可增加或延长体内雌激素的暴露,与乳腺癌发病密切相关[2]。除此之外,与生活习惯也有一定的关系,如,肥胖,吸烟,酗酒等,也会增加其患病的概率;乳腺癌一般表现为乳头溢液等,但多数患者症状并不明显,容易被忽视。乳腺癌患者中、晚期病情恶化,常伴有厌食,消瘦、贫血等症状产生[3]。近年来,乳腺癌的易感基因CK-19(细胞角蛋白19)及CK5/6(细胞角蛋白5/6)成为研究的热点。有关研究表明CK-19、CK5/6的异常表达与乳腺癌的产生、发展和转移密切相关,另有研究证明RT-PCR技术对乳腺癌患者的蛋白因子等检测效果较好[4]。因此本文研究实时定量PCR对检测乳腺癌CK-19、CK5/6的诊断及疗效分析。
1 对象和方法
1.1 研究对象和分组
收集2018年4至2020年4月于我院就诊的70例腺癌患者的癌组织及20例乳腺良性病变患者的病变组织,均为女性,最大年龄67岁,最小年龄32岁,抽血前均未接受化学治疗和放射治疗,所有患者均经手术治疗证实,手术后均经病理诊断,术前经胸部X线、B超、CT及骨扫描等检查未发现明显的转移灶,基本资料见表1。
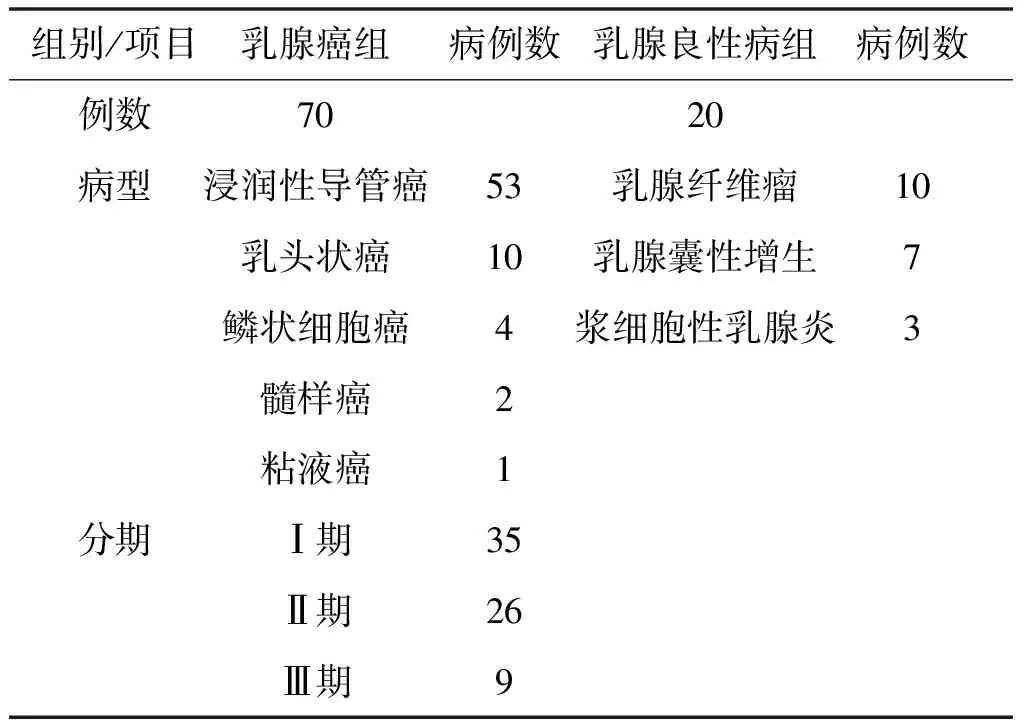
表1 乳腺癌组、乳腺良性病组临床资料对比
1.2 实验试剂与仪器
离心机;Trizol试剂;逆转录酶;PCR扩增仪;反转录缓冲液。
1.3 方法
取癌组织及良性病变组织 RNA,分别将组织放在液氮中研磨成粉末后 ,按每 50mg组织加入 1mL Trizol 进行裂解。室温静置 5min,按照 200μL氯仿71mL Trizol的比例加人氯仿 ,剧烈振荡 15s,使其充分混合 ,室温静置 5min后 ,4℃、12000×g离心 15min。 离心后混合物分为 3相,将上层水相移至另外 1个1.5mL离心管 中按0.5mL异丙醇/1mL Tfizol的比例加入异丙醇 ,充分混匀后室温静置10min,然后4℃ 、12000×g离心 10min。RNA在底部和侧面形 成白色的小团沉淀。移去上清。在 1.5mL离心管 中按 1∶1加 入 75% 乙醇 ,来回颠倒混匀后 ,4℃、 10600×g离心 5min,小心弃上清。室温静置 10min使RNA沉淀干燥加入DEPC水溶解 ,在波长 260nm处测定核酸浓度 ,波长 280nm处测定蛋白质浓度 ,二者比值在1.8~2.1时表示RNA提取成功 ,提取的总RNA置人1.5mL无菌离心管中,离心5min,1250r/min,将dNTP混合物及反转录缓冲液全部加入逆转录酶管中配置成反转录反应液,混匀,加入探针及PCR缓冲液,配置成PCR反应液,定量PCR仪上行PCR扩增(如图1 所示),PCR反应体系为:模板5.0μL、PCR反应液15.0μL、水5.0μL。其中模板为实验组样品反转录产物或对照组样品反转录产物。PCR反应条件:370C 10min,95℃15min,95℃15s,60℃1min,以β-actin为内参,共50循环,引物序列见表2。

表2 引物序列

图1 PCR扩增仪
1.4 观察指标
1.4.1检测CK-19与CK5/6在乳腺癌与乳腺癌良性病变组织中的表达
采用RT-PCR方法检测CK-19与CK5/6在乳腺癌患者中与在乳腺良性病变患者中的表达,并进行记录。
1.4.2检测CK-19与CK5/6在乳腺癌不同分期中的表达
采用RT-PCR方法检测CK-19与CK5/6在乳腺癌不同分期中的表达,并进行记录。
1.4.3检测CK-19、CK5/6ROC曲线面积及灵敏度与特异度
绘制ROC曲线,明确灵敏度与特异度,并进行记录。
1.5 统计学
SPSS 17.0统计分析软件对乳腺癌组、乳腺癌良性病变组CK-19与CK5/6水平、CK-19与CK5/6在不同乳腺癌分期中的表达等进行统计学分析,组间比较采用X2,P<0.05表示差异有意义。
2 结果
2.1 CK-19与CK5/6在乳腺癌与乳腺癌良性病变组织中的表达
乳腺良性病变中无CK-19mRNA、CK5/6mRNA表达,在乳腺癌患者中有26例CK-19mRNA表达、21例CK5/6mRNA表达(P<0.05),见表3。

表3 乳腺癌与乳腺良性病变中CK-19mRNA、CK5/6mRNA的表达
2.2 CK-19与CK5/6在乳腺癌不同分期中的表达
在乳腺癌Ⅰ期-Ⅲ期中,Ⅱ期CK-19mRNA、CK5/6mRNA的阳性表达率最高、Ⅰ期最低,组间比较差距较大(P<0.05),见表4。
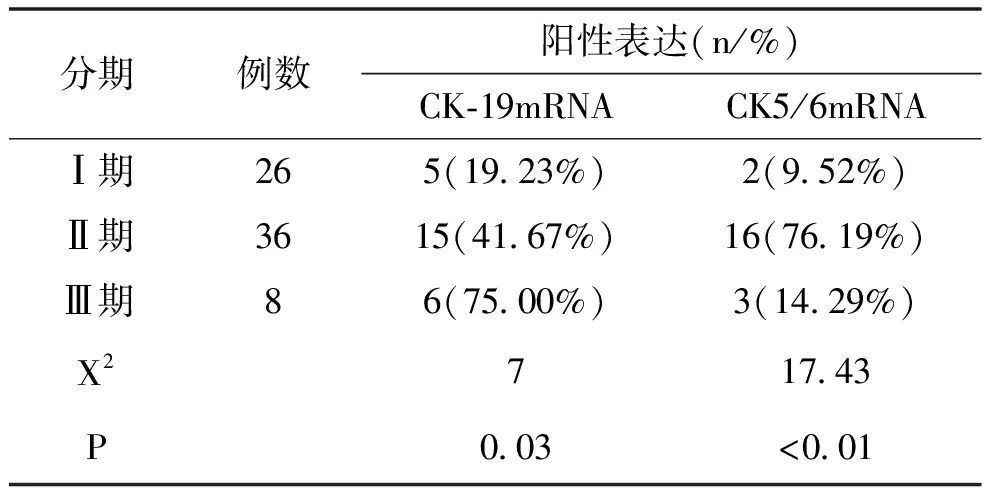
表4 乳腺癌不同分期中CK-19mRNA、CK5/6mRNA的表达
2.3 CK-19、CK5/6ROC曲线面积及灵敏度与特异度
CK-19的灵敏度、特异度与ROC曲线面积均高于CK5/6灵敏度、特异度与ROC曲线面积,见图2、表5。

表5 CK-19、CK5/6ROC曲线面积及灵敏度与特异度分析
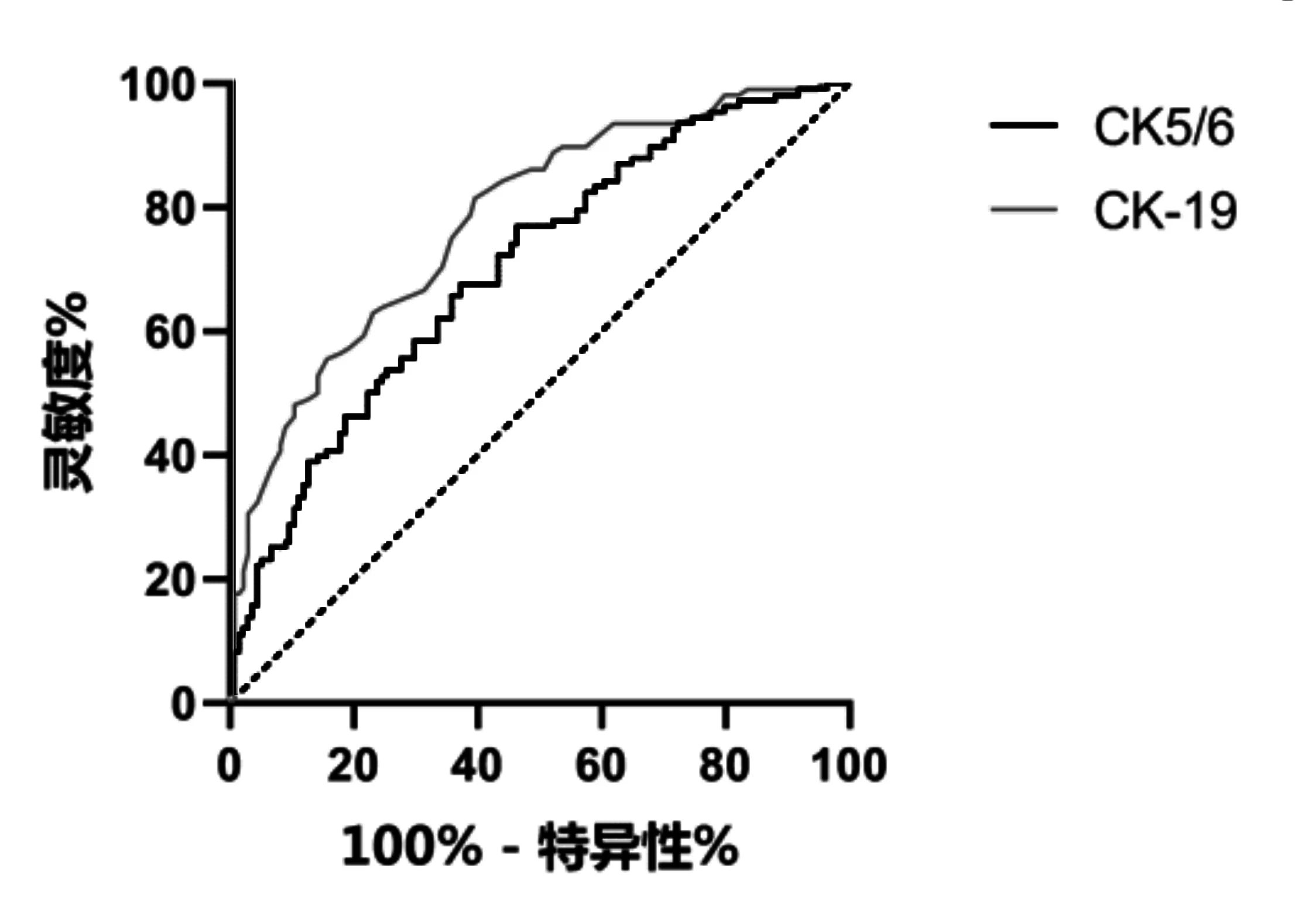
图2 CK-19、CK5/6ROC曲线面积及灵敏度与特异度分析
3 结论
据相关疾病研究机构调查显示,全球范围乳腺癌发病率逐年增长,是癌症中威胁女性生命健康的首要疾病,且有一半以上发生在发展中国家[5]。我国每年约有40万人确诊为乳腺癌,随着年龄的增长,发病率逐渐增加,乳腺癌一旦发病,判断有无转移对于治疗和判断乳腺癌预后有重要意义[6]。RT-PCR是一种较为敏感和特异的检测技术,能在107外周血单个核细胞中检出一个癌细胞,并预示肿瘤的微小转移。许多学者利用此技术检测乳腺癌患者淋巴结、骨髓及外周血的微转移。因抽取外周血比抽取骨髓方便,又易被患者所接受,且乳腺癌主要为血行转移,因此,本文研究实时定量PCR对检测乳腺癌CK-19及CK5/6的诊断及疗效分析。
由于目前在实体瘤中尚无特异、明确的肿瘤标记物,因此主要采用组织特异mRNA转录物为标记物,不同类型的正常上皮细胞显示特定CK标记。CK-19在乳腺癌、胃癌、肠癌中有较高的表达,而不表达于正常的血组织和淋巴结,所以是上皮细胞性肿瘤的较好标志物[7]。上皮特异性标志物CK5/6,是上皮源性肿瘤细胞骨架的组成成分,属于多基因家族之一,其成员超过30种,已有研究证实,CK在间叶组织(骨髓、淋巴结等 )中无表达 ,而在上皮性肿瘤组织 (乳腺癌 、宫颈癌 、肺癌等 )中有表达,而CK5/6由于其高度的上皮组织特异性以及乳腺癌细胞中的广泛表达成为检测乳腺癌患者肿瘤细胞的一个最常用的指标[8]。在本文研究中表明,在乳腺良性病变组中CK-19与CK5/6无表达,在乳腺癌中阳性表达较高。在许立生[9]等人对乳腺癌组织的表达中提出,CK5/6在乳腺癌中的阳性率高于癌旁正常组织,其表达水平的变化与乳腺癌的浸润、转移、预后联系密切。在黄建康[10]等对乳腺癌的研究中提出,CK-19的阳性率为30%高于乳腺良性病变患者,这与本文研究中其在乳腺癌组织中的阳性率37%较为接近。
癌细胞脱离原发灶,播散至血循环或淋巴系统,最后进入靶器官实质,是一个复杂过程。转移性癌细胞在循环系统及靶器官内面临几种命运:其一是发生凋亡;其二是处于休眠态;其三是持续增殖,肿瘤细胞脱落、侵袭并入血循环只是这一过程的最初阶段,检出的癌细胞并非一定形成转移灶。有关研究表明,癌细胞隐性转移会直接影响患者的预后,因此,准确的检出技术以及肿瘤微转移的特异性标志物对乳腺癌的治疗至关重要。实时RT-PCR检测是现阶段敏感度较高的技术,可检测mRNA水平的差异,其主要的检测原理是采用cDNA作为模板进行定量扩增,得到大量的目的基因,每种细胞表达的基因范围都有限,因此某些基因的mRNA不是广泛存在于每个细胞或组织中,RT-PCR在理论基础上检测肿瘤细胞特异度表达的基因,从而判断是否有完整的肿瘤细胞存在[11]。实时RT-PCR能在106~107个正常体细胞中检测出1个肿瘤细胞,此外,还能检测出1g组织、1mL体液中1个肿瘤细胞,因此实时RT-PCR能检测到早期脱落得游离细胞,达到早期预判的目的[12]。目前已有研究证实CK-19与CK5/6是乳腺癌的标志物,其水平的高低与乳腺癌预后联系密切。在本文中CK-19与CK5/6在乳腺癌Ⅰ-Ⅲ期中的阳性率逐渐增加。在任洪伟[13及李江涛[14]等运用实时RT-PCR检测技术对乳腺癌的研究中提出,CK-19与CK5/6水平的表达与乳腺癌预后、转移等密切相关,且随着乳腺癌的分期增加其阳性率逐渐增加。本文研究结果与上述医学者研究结果相似,且在本文中两指标的特异度均为100%也可证实其对乳腺癌诊断的重要性。
综上所述,实时定量RT-PCR对CK-19与CK5/6的表达进行检测可判断乳腺癌的转移,且具有一定的诊断价值,值得临床推广使用。
