大黄素及联合阿帕替尼对人甲状腺癌细胞K1抑制作用的实验研究
2021-08-31滕尧树
张 维,彭 友,滕尧树
(浙江大学医学院附属杭州市第一人民医院·浙江 杭州 310006)
甲状腺癌为常见内分泌系统恶性肿瘤,其发病率逐年增加,可出现压迫食管、气管等症状[1]。目前,临床以手术治疗为主,药物及局部放疗配合术后治疗,疗效虽佳,但仍存在较高的复发率。大黄素是大黄、虎杖等传统中药的有效成分,属蒽醌类物质。近来研究发现,大黄素对口腔癌、乳腺癌等诸多癌细胞均具有抑制作用,其通过抑制细胞迁移和诱导其凋亡等多种机制发挥抗肿瘤作用[2-4]。阿帕替尼为抗血管生成制剂,对血管内皮生长因子受体-2(VEGFR-2)结合具有高度选择性,能抑制VEGFR-2表达,阻断信号传递,抑制肿瘤血管新生,介导肿瘤细胞凋亡[5]。目前关于大黄素联合阿帕替尼对人甲状腺癌细胞K1作用的研究尚未见报道。本研究通过单一、联合给药作用于体内、外K1细胞,观察大黄素对其肿瘤生物学行为包括迁移、侵袭等的影响,同时深入分析大黄素结合阿帕替尼对甲状腺癌细胞的作用效果,进一步明确大黄素在甲状腺癌治疗中的作用。
1 材料
1.1 细胞株与实验动物 人甲状腺癌细胞K1:购自中国科学院上海细胞库。6周龄SPF级BALB/C裸鼠,体质量16~20 g,购自上海斯莱克动物实验有限公司,动物生产许可证号:SCXK(沪)2017-0015,饲养于浙江中医药大学动物实验研究中心,实验饲养室许可证号:SYXK(浙)2013-0184。
1.2 实验药物 甲磺酸阿帕替尼片:江苏恒瑞医药股份有限公司,规格:每片0.25 g。大黄素:国家食品药品监督管理总局(CFDA)。
1.3 试剂和仪器 Annexin V-FITC/PI凋亡检测试剂盒:南京凯基生物发展有限公司;基质胶:美国BD公司;BCA蛋白定量试剂盒、CCK-8试剂盒、VEGFR-2抗体:美国Abcam公司;Bax、Bcl-2、Caspase-3抗体:美国Proteintech Group公司;GAPDH一抗:成都正能生物技术有限责任公司。BD AccuriTMC6流式细胞仪:美国BD公司;450型酶标仪:美国Bio-RAD公司。
2 方法
2.1 细胞培养 人甲状腺癌细胞K1培养于含10% FBS的RPMI 1640培养基,置于37 ℃、5% CO2细胞培养箱。3 d传代1次,适时换液。
2.2 CCK-8法检测人甲状腺癌细胞K1细胞活性 96孔板接种对数生长期K1细胞培养12 h后,细胞进行分组:空白组(PBS)、大黄素组(100 μmol/L)、阿帕替尼组(10 μmol/L阿帕替尼)、联合组(100 μmol/L大黄素+10 μmol/L阿帕替尼)。设置复孔6个,给药处理24、48、72 h后,加10 μL CCK-8,再培养4 h,490 nm波长下采用酶标仪测定光密度值。
2.3 流式细胞仪检测细胞凋亡 6孔板接种对数生长期K1细胞培养12 h后,按2.2进行分组,同时设置3个复孔。给药培养48 h,400 μL细胞悬液,加5 μL Annexin-V FITC和10 μL PI染色液,轻轻混匀后4 ℃避光孵育30 min,测定K1细胞凋亡情况。
2.4 划痕实验、Transwell法检测细胞迁移、侵袭能力 6孔板接种K1细胞过夜培养,细胞密度达85%~90%后,用移液枪枪头垂直划痕,PBS弃去划下细胞。按上述分组给药,24 h后显微镜随机取样拍照,观察划痕并计算划痕面积。基质胶由无血清RPMI 1640培养液3:1稀释,30 μL稀释液均匀包被Transwell小室,4 ℃孵育过夜;置于24孔培养板,上室加细胞悬液5×104个/200 μL,下室加含FBS培养液500 μL。培养48 h,上层未迁移细胞轻擦,随机选取显微镜下视野,计算侵袭至下室中的细胞数量。
2.5 Western blot检测Bax、Bcl-2、Caspase-3及VEGFR-2蛋白表达 裂解液提取给药处理细胞后总蛋白。BCA法蛋白定量,20 μg样品上样,设平行孔3个,10%SDS-PAGE凝胶电泳分离,转NC膜,5%脱脂奶粉封闭2 h。加入一抗稀释液,4 ℃孵育过夜,TBST洗膜,加二抗,室温孵育1 h。以β-actin为内参,ECL化学发光显色。扫描成像,条带进行分析统计。
2.6 人甲状腺癌细胞K1裸鼠皮下移植瘤抑制实验 48只裸鼠分为模型组、大黄素组、阿帕替尼组、联合组,各12只。1×107个人甲状腺癌细胞K1注射于裸鼠左上肢内侧,建立甲状腺癌裸鼠模型。建模后,模型组自由饲养,大黄素组每日2次腹腔注射10 mg/kg大黄素,阿帕替尼组每日2次灌胃给药100 mg/kg阿帕替尼溶液,联合组每日2次给予100 mg/kg阿帕替尼+10 mg/kg大黄素,28 d后,处死裸鼠,收集瘤体进行称重并拍照,计算肿瘤抑制率。抑制率(%)=[(模型组平均瘤质量-实验组平均瘤质量)/模型组平均瘤质量]×100%。
2.7 统计学处理 采用SPSS17.0分析,数据用均数±标准差表示,两组间比较采用t检验,多组间比较采用单因素方差分析(ANOVA法)、两两比较法(SNK法),以P<0.05为差异有统计学意义。
3 结果
3.1 大黄素及联合阿帕替尼对K1细胞增殖能力的影响 与空白组相比,给药组细胞OD值在给药24、48、72 h后均显著降低(P<0.05或P<0.01),其中联合组OD值下降最显著。见图1。

注:与空白组比较,▲P<0.05,▲▲P<0.01图1 大黄素及联合阿帕替尼对K1细胞增殖能力的影响
3.2 大黄素及联合阿帕替尼对K1细胞迁移与侵袭能力的影响 见图2~图3。空白组给药24 h后迁移率和侵袭的细胞个数分别为(42.03±4.26)%、(41.00±4.36) 个;而大黄素组、阿帕替尼组、联合组迁移率分别为(32.93±3.33)%、(25.32±2.54)%、(17.97±1.80)%较空白组显著降低,侵袭的细胞个数分别为(31.33±3.21) 个、(28.33±3.06) 个、(14.67±1.53)个,较空白组显著减少;联合组的迁移率降低、侵袭细胞个数减少更为明显,数据均有统计学差异(P<0.05或P<0.01)。

图2 各组K1细胞迁移能力测定结果
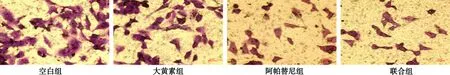
图3 各组K1细胞侵袭能力测定结果
3.3 大黄素及联合阿帕替尼对K1细胞凋亡的影响 见图4。空白组凋亡率为(8.39±2.68)%,大黄素组、阿帕替尼组、联合组凋亡率分别为(13.93±1.94)%、(16.04±1.50)%、(23.16±0.96)%,均较空白组显著升高(P<0.05,P<0.01)。
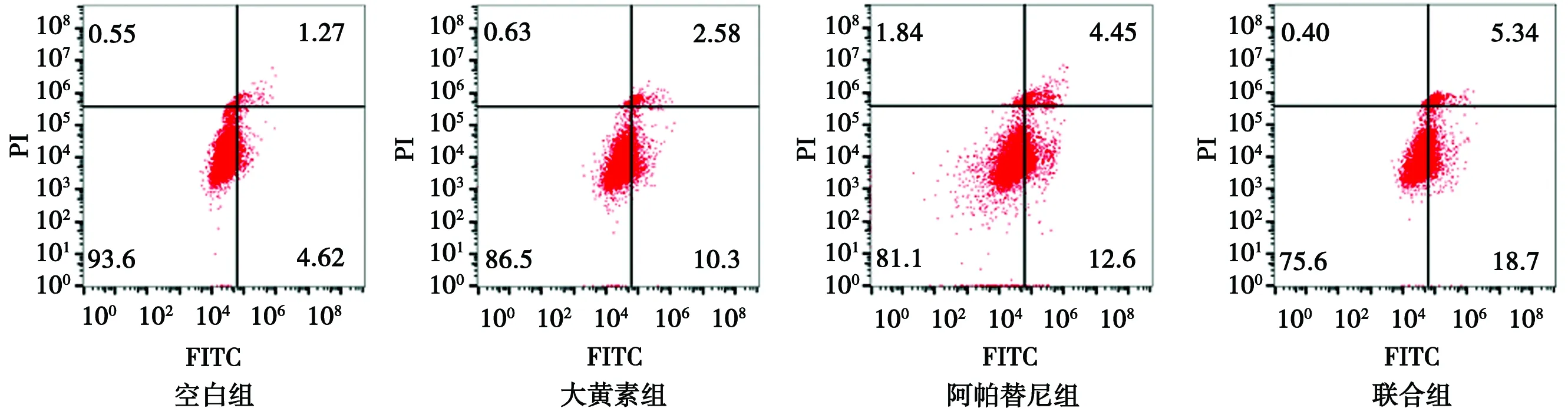
图4 各组K1细胞凋亡的测定结果
3.4 大黄素及联合阿帕替尼对K1细胞凋亡相关蛋白及VEGFR-2蛋白表达的影响 见图5。与空白组比较,大黄素组、阿帕替尼组和联合组能够显著上调Bax蛋白表达(P<0.05),阿帕替尼组、联合组可显著下调Bcl-2、VEGFR-2蛋白表达,上调Caspase-3蛋白表达(P<0.05或P<0.01)。大黄素组对Bcl-2、VEGFR-2蛋白表有一定下调作用,对Caspase-3蛋白表达有一定的上调作用,但无统计学差异。
3.5 大黄素及联合阿帕替尼对甲状腺癌K1细胞移植瘤的抑制作用 见表1。与模型组比较,大黄素组、阿帕替尼组合联合组瘤体生长均能明显受到抑制,其中联合组的对瘤体的抑制更显著。

表1 各组K1细胞移植瘤抑制作用比较

注:与空白组比较,▲P<0.05,▲▲P<0.01图5 各组K1细胞凋亡相关蛋白及VEGFR-2蛋白表达的检测结果
4 讨论
甲状腺癌较为常见,其发病机制尚未阐明,与钠碘转运体、雌激素等有关,现有治疗方法难以降低其复发率。随着分子生物学的迅速发展,靶向治疗在抗肿瘤治疗中占重要地位。阿帕替尼作为临床广谱抗肿瘤药,可通过靶向结合ATP位点,抑制血管内皮生长因子(VEGF)酪氨酸激酶活性,血管生成受到阻碍,进而对肿瘤细胞增殖、迁移、侵袭及凋亡具有抑制效果,且临床已证实其显著的抗肿瘤治疗作用[6-7]。
本文体外CCK-8法检测结果显示大黄素、阿帕替尼对K1细胞均可显著抑制其增殖活性,且联合用药后抑制作用明显增强,同时对细胞抑制率呈时间依赖性升高。本研究还显示大黄素与阿帕替尼的细胞凋亡实验结果一致,均可诱导甲状腺癌细胞K1凋亡,二者联合用药可加强作用效果。划痕实验和细胞侵袭结果发现,大黄素和阿帕替尼对细胞迁移和侵袭能力均有较好的抑制作用,联合用药后尤为明显。本研究建立的人甲状腺癌细胞K1裸鼠皮下移植瘤模型的给药分组中,大黄素组和阿帕替尼组对瘤体能有效的抑制其生长,联合组对瘤体的抑制作用尤为明显。提示大黄素对人甲状腺癌细胞K1的迁移和生长能力具有一定的抑制性;对阿帕替尼用药效果有一定促进作用。
抑制肿瘤细胞活性同时调控肿瘤细胞主动性死亡行为即凋亡对于肿瘤的治疗是一种有效方式。低分化甲状腺癌存在核扭曲和坏死临床病理特征,细胞凋亡参与甲状腺癌发生发展[8],肿瘤细胞对正常组织造成侵润,细胞凋亡也是其浸润转移的主要机制[9]。Bax是人体主要的促凋亡蛋白,属于Bcl-2蛋白家族成员,由Bax、Bcl-2结合的异二聚体,可通过传递凋亡信号实现介导细胞凋亡[10]。Bcl-2为抗凋亡蛋白,参与调控细胞凋亡。二者比值可决定调控细胞凋亡的方向[11]。本研究中大黄素和阿帕替尼均能上调人甲状腺癌细胞K1的Bax蛋白表达,且二者联合用药后效果更明显。大黄素和阿帕替尼联合用药后显著下调Bcl-2蛋白表达,表明大黄素联合阿帕替尼具有促进人甲状腺癌细胞K1凋亡并抑制其生长。Caspase-3是细胞凋亡程序的下游控制因子,Caspase-3的表达水平是细胞凋亡的决定因素[12]。本研究显示大黄素和阿帕替尼联合用药能够显著促进Caspase-3的表达,提示大黄素对阿帕替尼具有促进人甲状腺癌细胞K1凋亡作用。
VEGFR-2表达在血管内皮细胞具有重要作用,结合多种VEGF,介导血管发育、诱导肿瘤新血管生成,且研究证实,肿瘤的恶性增殖、迁移均与新生血管息息相关,是肿瘤细胞营养的重要来源[13]。VEGFR-2的表达水平也能够体现肿瘤发生与发展过程。以VEGFR-2为药物作用靶点也是抗肿瘤的研究热点[14]。本研究发现,人甲状腺癌细胞K1中存在VEGFR-2的表达。大黄素和阿帕替尼联合用药能够很好抑制VEGFR-2的表达,说明大黄素与阿帕替尼同时用药能够进一步抑制新生血管进而抑制人甲状腺癌细胞K1生长。
本研究初步探讨大黄素和阿帕替尼对人甲状腺癌细胞K1生长的抑制作用及机制,发现大黄素单独用药对人甲状腺癌细胞K1的生长有一定的抑制作用,大黄素与阿帕替尼联合用药比单独用药的抑制作用更明显,提示二者存在药物协同作用,为甲状腺癌临床治疗提供了一个潜在有效的给药方案,有一定临床参考价值。
