雄激素受体在去势抵抗性前列腺癌细胞铁死亡中的作用研究*
2021-08-31施田力江玉立
肖 鑫 李 鹏 施田力 江玉立
湖州市中心医院,湖州师范学院附属中心医院泌尿外科(浙江湖州313000)
前列腺癌(prostate cancer,PC)是男性较为常见的肿瘤,并且是全世界男性第三大癌症死亡的主要原因[1,2]。尽管雄激素受体(androgen Receptor,AR)靶向疗法在临床上取得了成功,但AR信号的重新激活仍然是去势抵抗性前列腺癌(castration-resistant prostate cancer,CRPC)进展的主要驱动力[3]。目前已经证明铁的毒性抑制癌细胞的生长,同样地,铁稳态已被证明在前列腺癌的发生和发展中起作用[4]。铁死亡(Ferroptosis)是2012年定义的一种铁依赖性和非凋亡性细胞死亡形式。Erastin作为促铁死亡的诱导剂,可以诱导铁死亡,抑制多种癌症中恶性细胞的增殖,但其在CRPC中尚缺乏深入的研究[4]。本研究中,我们假设铁死亡诱导剂Erastin诱导的铁死亡对CRPC细胞是有毒性,并探索其潜在的机制。
材料
一、实验细胞
CRPC细胞系22Rv1和VCaP来源于中国科学院(上海)模式培养库。细胞常规培养于RPMI-1640培养基+10%胎牛血清(Gibco)、100U/ml青霉素和100μg/ml链霉素,于37℃、5%CO2培养箱中培养。
二、主要药物及试剂
铁死亡诱导剂Erastin试剂、特异性铁死亡抑制剂Liproxstatin-1(Lip-1,#S7699)和Ferrostatin-1(Fer-1,#S7243)购自Selleck。caspase抑制剂Z-VAD-FMK(#V116),铁螯合剂去铁胺deferoxamine(DFO,#D9533),坏死抑制剂(Necrosulfonamide,Necro-1)、自噬抑制剂氯喹chloroquine(#C6628),二甲基亚砜(Dimethyl sulfoxide,DMSO)从Sigma获得。胎牛血清fetal bovine serum,FBS(#184590)购自Corille。一抗谷胱甘肽过氧化物酶4(Glutathione Peroxidase 4,GPX4)(ab125066)和AR是从Abcam购买的;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPD)(#5174)从Cell Signaling Technology(CST)获得。BCA(Bicinchoninic acid)蛋白测定试剂盒、放射免疫沉淀(Radioimmunoprecipitation,RIPA)裂解缓冲液以及核和细胞质蛋白提取试剂盒购自碧云天生物技术。AR表达质粒(LY400012)购自OriGene。谷胱甘肽(glutathione,GSH)(#A061-2)和脂质过氧化物丙二醛(Malondialdehyde,MDA)(#E-11325)测定试剂盒购自南京建成生物工程研究所。
方 法
一、实验细胞分组处理
CRPC细胞系22Rv1和VCaP以70~80%的融合率传代培养,所有实验都以指数生长期的细胞进行。CRPC细胞分为对照组、erastin(10μM)和erastin+Lip(1 μM)组,对照组和erastin(10μM)组分别用含有或不含有erastin(10μM)的RPMI-1640培养基培养,erastin+Lip(1μM)组在erastin(10μM)的基础上再加1μM Lip的培养基培养,加药物培养24 h后,开展后续实验。
二、甲基噻唑基四唑(methyl thiazolyl tetrazolium,MTT)
分别加入100μl不同浓度 (0、5、10、20、40μM)Erastin培养6、12、24和48 h,每孔加入20μl MTT溶液孵育4h,使用酶标仪测定490 nm处吸光度。
设置对照组、Erastin(10μM)、Erastin+DFO(100μM)、Erastin+Fer-1 (1μM)、Erastin+Lip (1μM)、Erastin+Necro-1(10μM)、Erastin+Z-VAD-FMK(10μM)和Erastin+chloroquine(25μM),培养24 h,细胞活力测定基本方法同上,分别测定吸光度。
三、流式细胞仪测定可变铁池(Labile Iron Pool,LIP)
根据制造商说明书中描述的方法测量LIP(可变铁池)[5],细胞经胰酶消化,用0.5ml磷酸盐洗涤两次,以1×106/ml的密度在37°C下与0.05μM钙黄绿素-乙酰氧甲酯(AnaSpec)孵育15 min。然后,用0.5ml的PBS洗涤细胞两次,加或不加去铁胺(100μM)在37°C孵育1h,用流式细胞仪对细胞进行分析,钙黄绿素的激发波长为488 nm,荧光强度为525 nm。有无去铁胺孵育的细胞平均荧光的差异反映了LIP值。
四、生化法检测GSH、MDA
分别使用GSH和脂质过氧化测定试剂盒根据说明书要求评估细胞裂解物中的GSH和MDA含量。
五、AR表达质粒及其转染
用MegaTran 1.0转染试剂(OriGene)将AR表达质粒或空载体瞬时转染CRPC细胞系22Rv1和VCaP 36 h。然后,收集细胞进行进一步研究。
六、Western blot检测
使用RIPA裂解缓冲液进行蛋白质印迹获得蛋白裂解物,用核质蛋白提取试剂盒提取细胞室蛋白,BCA蛋白测定试剂盒检测蛋白浓度。用10%的十二烷基硫酸钠-聚丙烯酰胺 (sodium dodecyl sulfate-polyacrylamide,SDS-PAGE)凝胶分离总共20μg的蛋白质,并转移到聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜(微孔)上。将膜与下列特异性一抗孵育:AR、GPX4和GAPDH,GAPDH用作内对照。加二抗,ECL显影。
七、实时定量PCR
用TrizolTM试剂提取总RNA,利用GoScriptcDNA反转录系统(PROMEGA)合成约1μg RNA。使用Go-TaqRqPCR Master Mix(Promega)进行qPCR。相应靶基因的引物如下:AR.5-GAC GAC CAG ATG GCT GTC ATT-3(forward).5-GGG CGA AGT AGA GCA TCC T-3(reverse).GAPDH.5-TTC TTT TGC GTC GCC AGC CGA-3(forward).5-GTG ACC AGG CGC CCA ATA CGA-3(reverse).
八、统计学分析
所有数据以三个独立实验的平均值±SD表示,并使用GraphPad Prism 5.0软件进行分析。组间差异的显著性通过单因素方差分析(analysis of variance,ANOVA)进行。P<0.05被认为具有统计学意义。
结果
一、Erastin对CRPC细胞活力的抑制作用
为了确定铁死亡诱导剂Erastin是否对CRPC细胞有影响,将不同剂量的Erastin分别加入CRPC细胞系22Rv1和VCaP中,采用不同的孵育时间来检测这种时间依赖效应。如图1所示,Erastin以剂量依赖和时间依赖的方式抑制22Rv1和VCaP的细胞活力(P<0.05)。
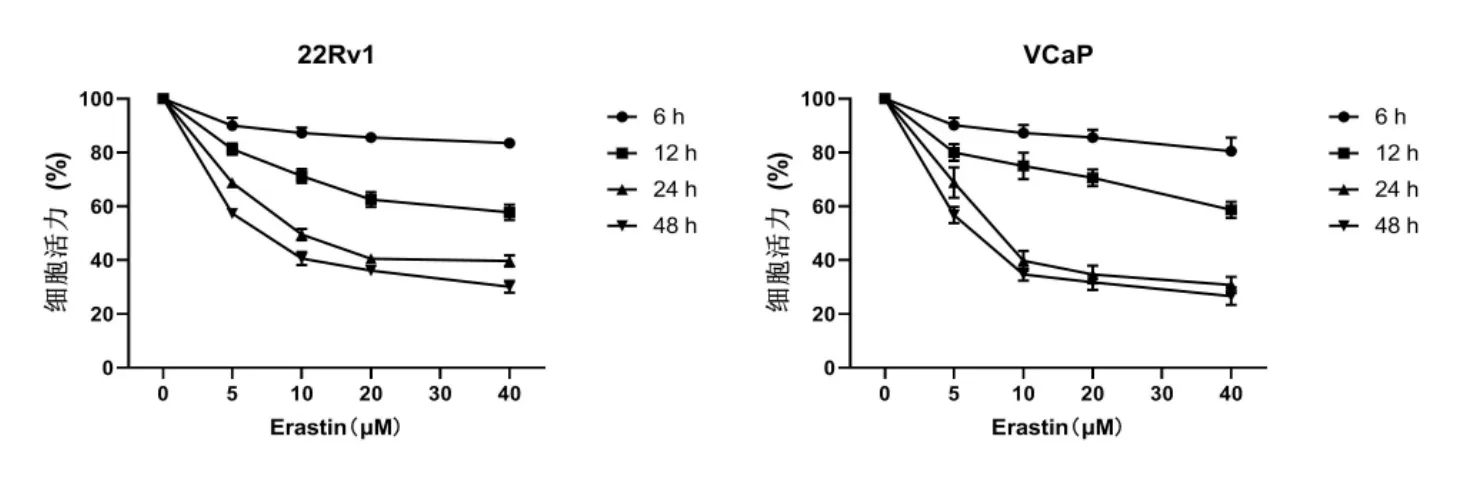
图1 Erastin对CRPC细胞活力的抑制作用
二、特异性铁死亡抑制剂阻止Erastin诱导的细胞生长抑制
为了进一步确定铁死亡在Erastin诱导的细胞活力抑制中的作用,在加或不加几种细胞死亡抑制剂的情况下,用铁死亡诱导剂Erastin处理CRPC细胞,联合使用铁螯合剂DFO、特异性铁死亡抑制剂可以阻止Erastin诱导的细胞生长抑制(P<0.001),而凋亡、坏死与自噬抑制剂没有这种作用(图2),这些数据提示铁死亡可能与铁死亡诱导剂Erastin诱导的CRPC细胞生长抑制有关。

图2 特异性铁死亡抑制剂阻止Erastin诱导的细胞生长抑制
三、Erastin对CRPC细胞铁死亡的促进作用
铁死亡诱导剂Erastin促进铁死亡相关性LIP增加(P<0.001,图3),铁死亡重要调节因子GPX4蛋白表达和细胞氧化还原稳态因子GSH水平均下调(P<0.001,图4A-B),而脂质过氧化产物MDA显著增加,而在铁死亡抑制剂Lip使用后逆转(P<0.001),这些结果提示铁死亡诱导剂Erastin对CRPC细胞铁死亡的促进作用。
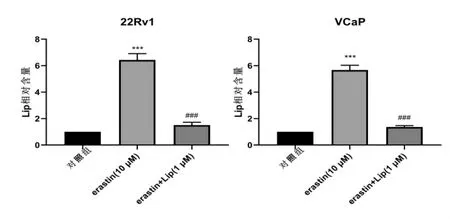
图3 Erastin促进铁死亡相关性LIP增加
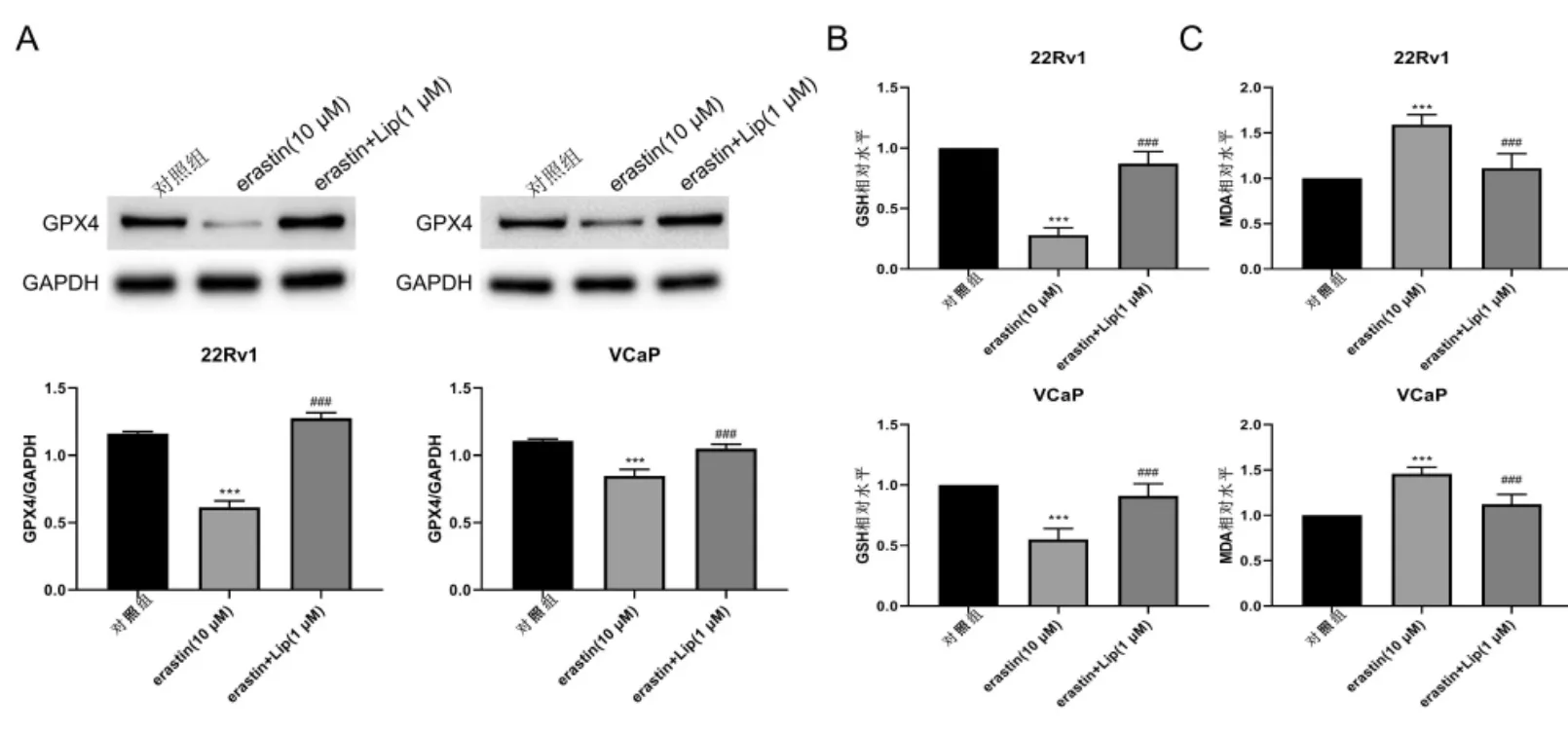
图4 Erastin促进铁死亡A:GPX4蛋白表达;B:GSH水平;C:MDA水平
四、Erastin对CRPC细胞中AR的抑制作用
铁死亡诱导剂Erastin降低了AR的表达水平,而特异性铁死亡抑制剂则增加了AR的蛋白和mRNA表达水平(P<0.01,图5A-B)。
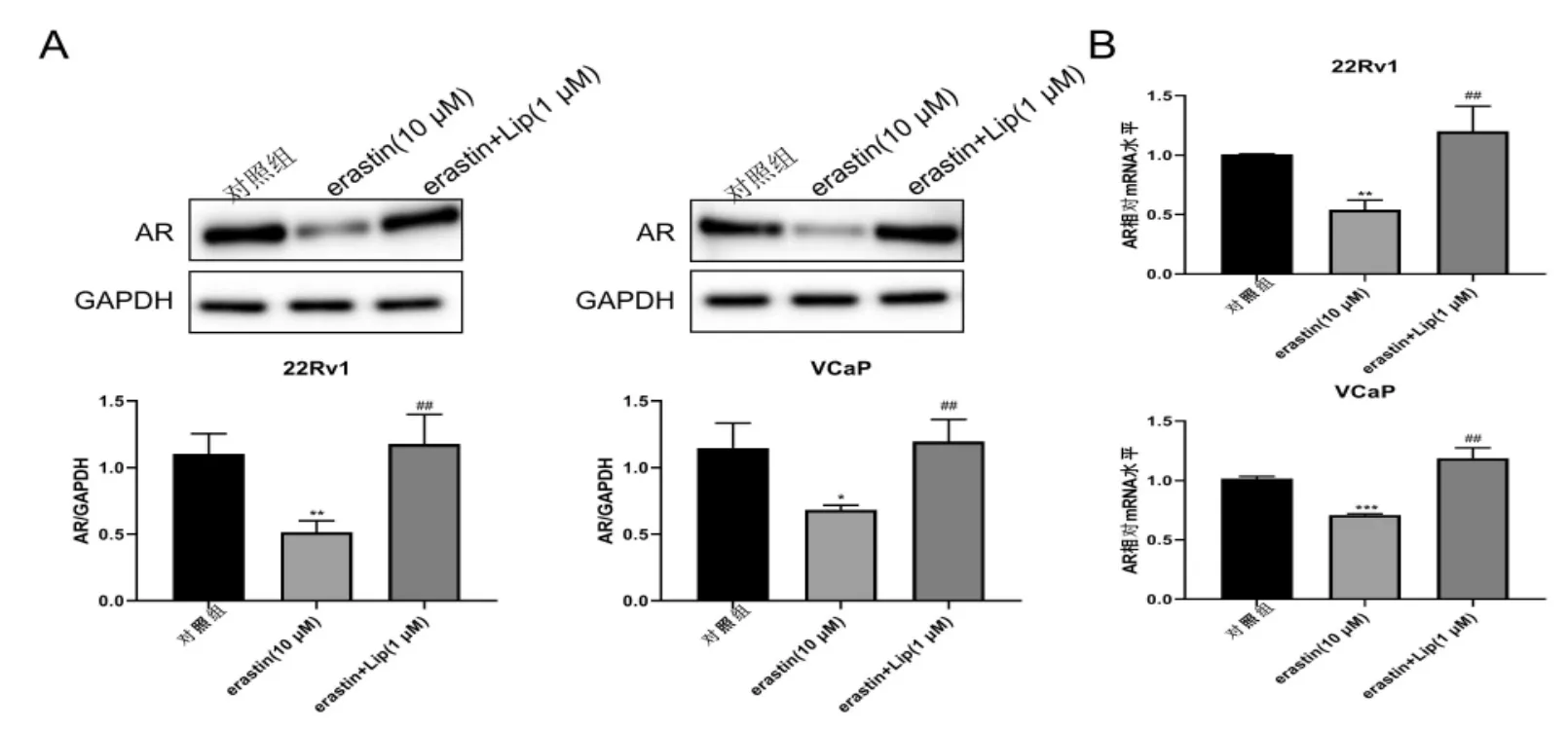
图5 Erastin对CRPC细胞中AR的抑制作用A:AR蛋白表达;B:AR mRNA表达水平
五、AR上调对Erastin生长抑制的逆转作用
为了进一步验证铁死亡与AR之间的作用,本研究调查了AR的过表达是否逆转铁死亡诱导剂Erastin的细胞生长抑制作用。Western印迹证实了AR质粒的成功转染(P<0.01,图4A),AR的过表达显着减弱了Erastin的细胞活力抑制作用(P<0.01,图4B)。
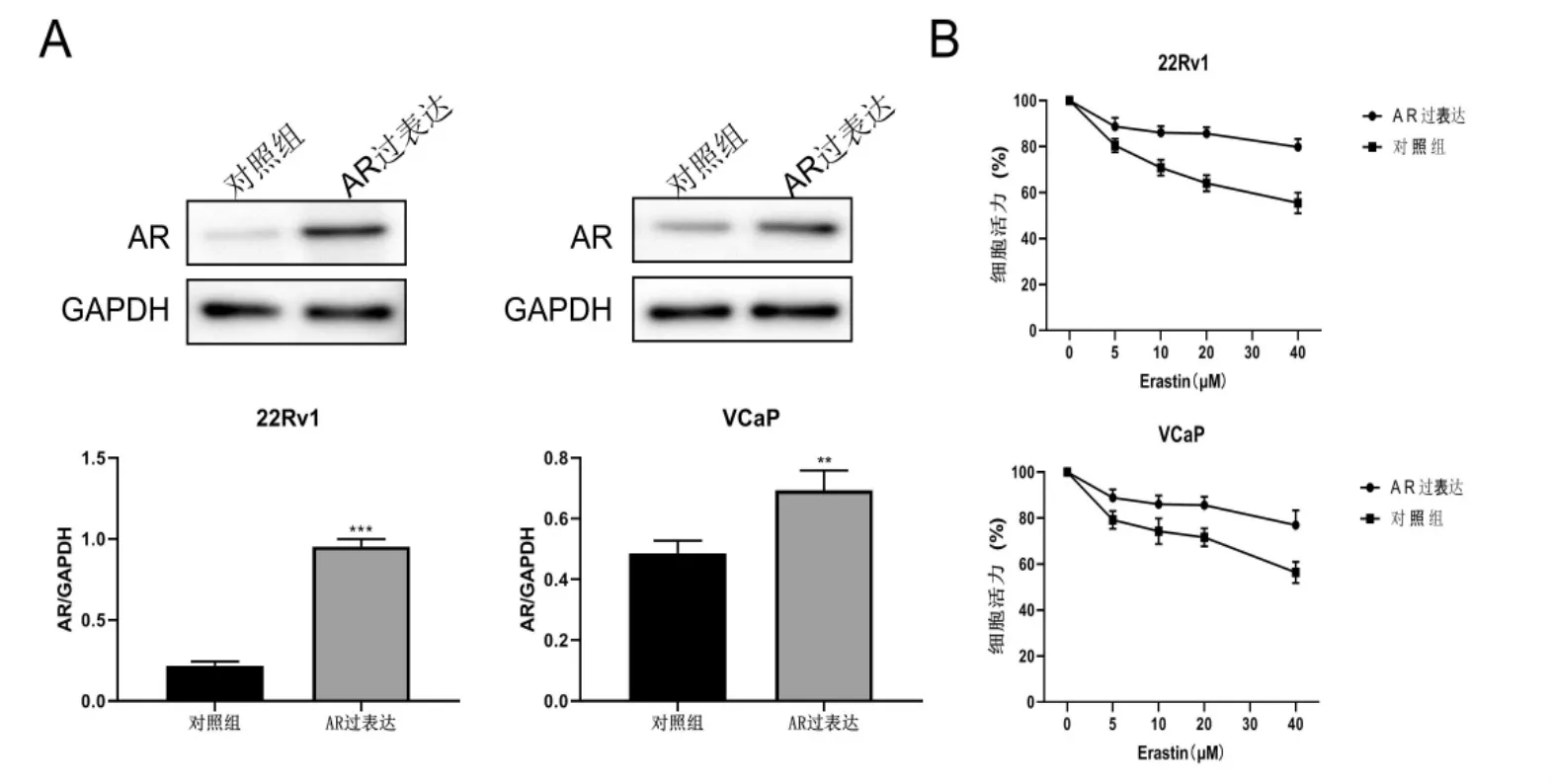
图6 AR上调对Erastin生长抑制的逆转作用A:AR蛋白表达;B:细胞活力
讨论
已经发现铁死亡可以抑制肝癌、胰腺癌、前列腺癌、乳腺癌和其他癌症中的恶性细胞的增殖[4,6,7]。特别是一些高度恶性的癌细胞被证明对铁死亡具有先天易感性,因此诱导铁死亡可能成为一种新的癌症治疗方法[8]。
铁死亡诱导剂Erastin可以触发多个分子,效果高效、快速和持久,而其他铁死亡诱导剂通常只触发一条途径[9]。由于可以诱导自然的非凋亡形式,基于Erastin的癌症治疗有望绕过由凋亡介导的传统疗法的缺点。铁死亡触发的Erastin可以克服急性髓系白血病细胞对化疗药物的耐药性[10]。然而,铁死亡在CRPC中的作用仍不清楚,本研究结果提示Erastin以剂量依赖的方式诱导CRPC细胞的生长抑制,并且能够被特异性铁死亡抑制剂逆转,而凋亡、坏死与自噬抑制剂没有这种作用,这进一步证明了Erastin作为列腺癌新治疗策略的潜力,且可能与诱导铁死亡有关[11]。
铁是包括活性氧生成反应与铁死亡等许多生物过程中必不可少的元素。据报道,LIP可以通过直接催化活性氧的产生从而促进铁死亡[12]。与此一致,我们的结果提示Erastin促进铁死亡所致的LIP增加。此外,铁死亡受到GPX4和一些铁转运调节蛋白的调节[13]。GPX4是最重要的抗氧化酶之一,也是癌细胞铁死亡的重要调节因子。目前的研究表明,GPX4的激活可以抑制铁死亡和炎症[14]。与这些报道一致的是,我们的研究表明Erastin可以抑制GPX4的表达和GSH水平,且上调了MDA水平。细胞氧化还原稳态因子GSH和脂质过氧化产物MDA在维持细胞氧化还原平衡中起重要作用[13]。铁死亡在生化代谢方面主要表现是离子的铁沉积导致膜脂质过氧化和过度的氧化应激损伤的细胞内氧化还原平衡,一起降低抗氧化能力和增加细胞内脂质活性氧,最终导致氧化细胞死亡。
研究显示一些致癌途径与铁死亡密切相关,从而使癌细胞对铁死亡极为敏感[4]。尽管多年来AR一直是激素治疗的主要靶点,但其仍然是前列腺癌进展为CRPC的关键驱动力。最近临床选择性ARI在提高CRPC患者存活率方面的成功进一步强化了雄激素受体作为治疗靶点的重要性[3]。我们的研究表明Erastin可以抑制AR的表达,这可能在Erastin诱导的铁死亡中起关键作用,过表达AR导致Erastin处理后细胞增殖增加,因此,AR可能是Erastin诱导的铁死亡的关键决定因素。
综上所述,AR的过表达逆转诱导铁死亡后细胞增殖的抑制作用,AR在去势抵抗性前列腺癌细胞铁死亡中的起着重要作用,更详细的作用机制有待进一步研究。
