抗牙龈卟啉单胞菌卵黄抗体脂质体的制备及抗菌作用研究
2021-08-31徐涵颖王腾飞沈继龙桂双英
韩 旭,徐 燕,徐涵颖,王腾飞,沈继龙,桂双英
牙龈卟啉单胞菌(Porphyromonas
gingivalis
,P.gingivalis
) 是慢性牙周炎的主要致病菌,与牙周炎的发生发展密切相关,目前临床常用辅助治疗药物如洗必泰、西吡氯铵等不仅作用时间短,而且长期使用易诱发耐药菌株和毒副作用,因此寻找一种安全有效的治疗方式具有重要的临床意义。该研究通过接种Pg
通过主动免疫产蛋母鸡的方法获得针对牙周致病菌的卵黄抗体。采用薄膜超声分散法制备抗Pg-IgY脂质体,通过物理、形态超微结构、包封率、药物释放曲线和体外抗菌活性分析评价药物,以期达到药物缓释性能,提高药效的作用。1 材料与方法
1.1 材料与设备
P.gingivalis
(JCM12257) (国际标准菌株 ATCC33277,广东省微生物菌种保藏中心);哥伦比亚血琼脂培养基(江门凯林贸易有限公司);BCA 检测试剂盒(北京原平皓生物);抗Pg-IgY溶液(合肥安科生物有限公司);卵磷脂(德国利保德公司);胆固醇、三氯甲烷、生育酚等试剂(天津博迪化工技术有限公司);细菌基因组DNA提取试剂盒(北京天根);厌氧培养箱(Don Whitley DG250 Anaerobic workstation,英国);恒温磁力搅拌仪(常州智博瑞仪器有限公司);N-1001型旋转蒸发仪(日本EYELA公司);透射电镜(JEM-ARM300F2,日本电子);紫外可见分光光度计光谱分析仪(上海美普达公司)。1.2
培养与鉴定
将P.gingivalis
(ATCC33277)冻干粉,接种于哥伦比亚血琼脂培养基中,置于厌氧培养箱中(混合气比例:80% N、10% CO、10% H),37 ℃培养48 h,见黑色菌落长出,挑取单个菌落接种于BHI液体培养基(加入维生素K1及氯化血红素)进行扩菌培养,培养24 h后用DNA提取试剂盒提取细菌的DNA利用P.gingivalis
的16s rRNA引物进行鉴定。由上海生物工程有限公司合成鉴定。1.3 实验样品制备
1
.3
.1
BCA法测定蛋白浓度 取20 μl蛋白标准品(25 mg/ml BSA溶液),加入980 μl蛋白稀释液,配置成0.5 g/L,分别在96孔板中加入0、1、2、4、8、12、16、20 μl上述溶液,分别加入标准品稀释至20 μl。向每个孔中加入200 μl BCA工作溶液,37 ℃恒温箱中反应30 min,测量562 nm处吸光度(optical density, OD)值(A)。以浓度C(g/L)对OD值进行线性回归。求出标准曲线Y=1.984X-1.137,R
=0.976。1
.3
.2
抗Pg-
IgY脂质体的制备方法 采用薄膜分散超声法制备抗Pg-IgY脂质体, 称取120 mg卵磷脂和15 mg胆固醇并加入0.1 mg亲脂性抗氧化剂,置于圆底烧瓶内加入10 ml有机溶剂氯仿。超声震荡使其充分溶解,置于旋转蒸发仪上旋转蒸发除去有机溶剂(400~700 kPa、30 ℃、60 min),在烧瓶壁内形成一层均匀薄膜。用10 ml抗Pg-IgY溶液将脂质膜水合,得到抗 Pg-IgY脂质体混悬液,将细胞破碎仪的超声探头在冰浴的条件下超声破碎6 min(超声破碎4 s,暂停6 s,功率250 W),探头浸入样品中且稍高于烧瓶1 cm,超声完成后乳白色的混悬液变为乳光状均匀悬液,对光透过样品可看清物品,即为抗 Pg-IgY脂质体。1
.3
.3
测定抗Pg-
IgY脂质体的粒径和Zeta电位 抗 Pg-IgY脂质体加适量超纯水稀释, 取4个样品使用纳米粒子粒径分析仪测定平均粒径、多分散指数(PDI)和Zeta电位,透射电子显微镜下观察其外观形态。1
.3
.4
精密度实验 取低、中、高浓度3个浓度的抗 Pg-IgY脂质体溶液,进行连续 6次HPLC 进样测定峰面积,精密度的RSD为 0.85%,小于 2%,认为仪器的精密度良好。稳定性的RSD 为 0.60%,小于2%,表明样品的稳定性良好。1
.3
.5
脂质体包封率测定将抗 Pg-IgY脂质体溶于pH 7.4的缓冲液中并定容至5 ml,量取1 ml置于20 KD 超速离心管中,4 ℃下,20 000 r/min离心 1 h,分离出脂质体和游离药物,缓冲液洗涤超速离心管3次,取上层离心的上清液作为游离药物量,记为C游(μg/ml)和以未离心前的样品计算总药物量记为C总(μg/ml),根据公式计算其包封率. 包封率(EE%)=( C总-C游)/C总×100%1
.3
.6
体外释放实验取制备所得抗Pg-IgY脂质体溶液,量取3 ml抗Pg-IgY脂质体溶液转移到透析袋中。透析介质为pH7.4的PBS缓冲液,透析袋截留分子量为8 000~15 000 kD,将透析袋的末端固定并放于含有200 ml PBS缓冲液的烧杯中。37 ℃恒温水浴条件下进行磁力搅拌,于0.5、1、2、8、12、24、36、48、72、96、120、144 h分别从烧杯中取1 ml样品并同时补充等体积透析介质,用BCA法测出每个取样时间点透析介质中的蛋白含量,以0 h时透析袋内的蛋白含量作为总含量,二者之比即为累积释放率。1.4 抑菌实验
1
.4
.1
最小抑菌浓度(minimum inhibitory concentration,MIC)和最小杀菌浓度(minimum bactericidal concentration,MBC)的测定配制成终浓度为16.00、8.00、4.00、2.00、1.00、0.50和0.25 mg/ml 7个不同浓度药液。取一块96孔板,共9个浓度组,其中1-7组为实验组,第8组阳性对照组只加200 μl菌液,第9组阴性对照组加等体积的BHI培养基和抗Pg-IgY脂质体。每组设4个复孔测量每组的OD值(A)将震荡混匀后的96孔板培养48 h,再次测量共培养后的OD值(A)。肉眼观察到无浑浊出现的为最小抑菌浓度值,选择大于MIC的各孔,分别取20 μl划线接种于固体血琼脂培养基,37 ℃厌氧条件下培养48 h,观察菌落数少于5~6个的最低浓度为杀菌浓度。1
.4
.2
抑菌动力学测试 参考1.4.1的实验结果,绘制抗Pg-IgY脂质体对P.gingivalis
的kill-time曲线。将抗 Pg-IgY脂质体溶液配置为不同浓度。在1 ml不同浓度的抗 Pg-IgY脂质体溶液中加入200 μl浓度1×10CFU/ml的菌液,厌氧培养箱内培养48 h。每小时取样100 μl,每管取2个样本,连续取样12 h后,检测所有样本的OD值(A),取平均值绘制细菌生长曲线。
2 结果
2.1 抗 Pg-IgY脂质体的粒径和Zeta电位
测得平均粒径为(175.43±3.25)nm、PDI为0.263脂质体分布较为均匀,PDI值在0.1~0.3之间,表明体系具有均匀的分散性。Zeta电位为(-37.82±0.20)mV。粒径均匀稳定如图1所示。当Zeta电位的绝对值大于30 mV时,纳米体系是稳定的。2.2 抗 Pg-IgY脂质体形态观察
使用透射电镜观察抗Pg-IgY脂质体,样品粒径分布较均一,形状大多数是卵圆形,可观察到明显的磷脂双分子层状结构,脂质体的表面光滑,药物囊泡完整,如图2A。图2B中红色箭头标识为正在释放的药物,黄色箭头标识为释放后的磷脂碎片,此时脂质体已变形。图2C为未包封在脂质体中的游离的抗Pg-IgY。图3在牙周炎局部微环境中药物释放的示意图。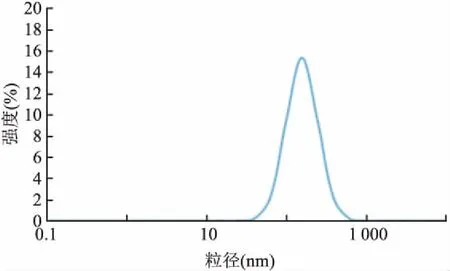
图1 抗Pg-Igy脂质体粒径分布图
2.3 抗 Pg-IgY脂质体包封率测定
包封率的测定是检测脂质体内包裹的药物含量和游离药物含量,抗 Pg-IgY为水溶性药物,脂质体与抗 Pg-IgY粒径大小有差别,无重叠,所以采用超速离心法测定包封率。见表1。
图2 抗 Pg-IgY脂质体透射电镜图

图3 抗Pg-IgY脂质体实体图及在牙周炎局部微环境中药物释放的示意图

表1 抗Pg-IgY脂质体包封率(n=4)
2.4 抗 Pg-IgY脂质体的体外释放曲线
抗Pg-IgY脂质体具有明显的药物缓释性能。药物在0.5 h时累积释放率为2.75%,0~4 h这段时间内PBS溶液中的蛋白质浓度显著增加,在4 h内药物累积释放率仅为20.8%,释放率少于30%,表明该药物不会发生突然释放。在4~72 h PBS溶液中的蛋白浓度明显升高,表明这一阶段药物释放增加,药物累积释放量达到80%左右,72~144 h这一阶段药物释放逐渐缓慢,144 h的累积释放率为83.4%.从释放曲线趋势来看,药物仍在缓慢释放,说明该药物有缓释效果。见图4。
图4 抗Pg-IgY脂质体体外释放率曲线
2.5 抗Pg-IgY脂质体对
的MIC和MBC
抗Pg-IgY脂质体对P.gingivalis
的MIC值为4 mg/ml,在抗 Pg-IgY脂质体达到细菌的MIC值时,产生明显的抑菌作用可以抑制病原微生物的生长,MBC值为8 mg/ml,当浓度要达到或超过MBC,才能杀灭病原微生物。当抗 Pg-IgY脂质体浓度越小,其病原微生物的活性越强。2.6 抑菌动力学测试
在16、8 mg/ml 2个浓度组培养前后的OD值没有下降,差异没有统计学意义,表明在该浓度下,细菌是不能生长的。而在4 mg/ml 的浓度及以下培养前后测定的OD值有明显增加,差异有统计学意义。见表2。
表2 抗Pg-Igy脂质体各浓度组培养前后OD值
2.7 抗Pg-IgY脂质体对
的时间-杀菌曲线
抗Pg-IgY脂质体对P.gingivalis
在药物浓度为4 mg/ml在10 h后产生明显的抑菌效果,可以抑制P.gingivalis
生长,在达到8 mg/ml的浓度时9 h后可以达到杀菌效果。见图5。3 讨论
牙周病是由牙菌斑生物膜引起的一种破坏牙周支持组织的细菌感染性疾病,在已发现的700多种口腔微生物中,绝大多数细菌在口腔中是正常菌群,仅极少数的细菌(约30种)与各型牙周病的发生和发展密切相关。不同类型的牙周病存在一种或几种主要的致病菌。 牙周病常见主要致病菌包括:P.g
,伴放线聚集杆菌(Actinobacillusa
ctinomycetemcomitans
,A.a
),具核梭杆菌(Fusobacterium
nucleatum
,F.n
),中间普氏菌(Prenella
intermediate
,P.i
)等。 当前牙周病去除牙菌斑生物膜的方法主要包括:机械治疗、牙周手术治疗和药物治疗等。机械治疗仅去除大部分的牙菌斑、牙石和感染的牙骨质,但不能彻底清除操作器械不易到达的牙周袋深处感染部位的细菌感染组织,炎症无法消退,附着水平和牙槽骨吸收没有减少,病情加重。还需药物治疗作为补充用以控制感染和炎症,防止细菌再次黏附定植于牙周袋内。
图5 抗Pg-Igy脂质体对牙龈卟啉单胞菌Kill-time曲线
抗Pg-IgY脂质体能杀灭牙周病原菌,既能弥补机械治疗的不足,又能有效避免抗生素的过度使用和其他药物之间的拮抗作用。本实验采用薄膜超声分散法制备抗Pg-IgY脂质体。制备出的脂质体多数为大多室脂质体,由于使用超声探头进行脂质体破碎,虽然在冰浴条件下,仍会造成一部分脂质体被破坏使得包封率进一步下降。
本实验体外药物释放在0~4 h内是未包封在脂质体中的游离药物释放,释放率少于30%,表明该药物不会发生突然释放。8~96 h为包裹在脂质体内抗Pg-IgY缓慢释放,从曲线可看出144 h仍有释放趋势,表明抗Pg-IgY脂质体具有缓释作用,提高目标部位的有效药物浓度,为卵黄抗体在牙周病的被动免疫治疗中的使用和推广提供了新的思路。 为进一步研究治疗慢性牙周炎的药物新剂型奠定了理论基础。
