基于液质联用技术的高脂血症金黄地鼠肝脏非靶标代谢组学研究
2021-08-24孙明谦尹春园刘建勋杨会珍
孙明谦,尹春园,苗 兰,张 颖,刘建勋,杨会珍,林 力
(中国中医科学院西苑医院基础医学研究所,中药药理北京市重点实验室,北京100091)
代谢组学是一种系统生物学的方法,可以快速、全面地分析生物样品中的小分子代谢物,揭示生命系统对任何环境或基因刺激的代谢反应,并可用于疾病的生物标志物发现。尤其对于代谢性疾病,如糖尿病[3-5]或动脉粥样硬化[6-7],代谢组学可以提供更多有关代谢过程和机制的进一步信息,因此近年来在高脂血症的研究中取得了广泛应用,在对疾病机制、药物疗效与作用机理的研究中取得了良好的进展。从临床的诊断分型,到动物模型的建立与评价,均可利用代谢组学对高脂血症异常的代谢途径和发病机理进行探讨,如近年来备受关注的氧化三甲胺(TAMO)就是通过代谢组学结合肠代菌研究发现的心血管疾病的重要生物标志物[8]。同时还有一些生物标志物通过代谢组学被发现(如短链脂肪酸、次级胆酸等),极大提高了人们对心血管疾病发病机理的认识[9]。
由于尿液和血浆等生物流体不能提供有关代谢变化的空间信息,近年来对组织代谢组学的研究越来越受到重视[10-11],它能为损伤组织提供直接而丰富的信息,在机理探索和生物标志物发现中具有重要作用。本文采用反相色谱(RPLC)和亲水作用色谱(HILIC)分离法对早期高脂血症金黄地鼠肝脏进行了代谢组学研究。HILIC可作为RPLC分析极性组分的补充分离方法,而极性组分在组织匀浆中所占比例较高。本研究旨在通过两种分离模式寻找更多潜在的生物标志物,为了解肝脏高脂血症的病理学提供更多有用的信息。
1 实验部分
1.1 仪器与试剂
Agilent 1290 series超高效液相色谱仪(美国Agilent公司),配备二元泵、在线脱气机、自动进样器、柱温箱、PDA检测器以及在线分析软件等;Agilent 6520 series Q-TOF质谱仪(美国Agilent公司);22 R高速离心机(德国Mikro公司),LAbOSPEC T003日立全自动生化仪(日本Hitachi公司)。
乙腈、甲醇(HPLC级,美国Fisher Scientific公司);甲酸(99%,荷兰J.T.Baker公司)。实验用水为蒸馏水(中国娃哈哈公司)。次黄嘌呤、黄嘌呤、哌啶酸、尼克酰胺标准品(美国Sigma公司)。神经鞘氨醇、二氢神经鞘氨醇(加拿大Toronto Research Chemicals Inc.)。甘油磷酸胆碱、精氨酸(北京J&K Scientific公司)。总胆固醇(TG)、总甘油三酯(TC)、低密度脂蛋白(LDL-C)及高密度脂蛋白(HDLC)测定试剂盒(日本日立高新技术公司)。
1.2 动物实验与样品采集
SPF级7周龄叙利亚雄性金黄地鼠,由北京维通利华实验动物技术有限公司提供,许可证号为SCXK(京)2016-0011。金黄地鼠在标准实验室条件下(温度:22℃;12 h光-暗循环)自由饮用无菌食物和自来水。一周后,随机分为正常对照组(n=9)和高脂血症模型组(n=9)。高脂血症模型组饲喂高脂饲料6周,对照组饲喂正常饲料。实验结束时,所有金黄地鼠均禁食12 h,取肝脏用生理盐水冲洗,立即注入液氮,并储存于-80℃下进行后续研究。
1.3 样本处理
冷冻肝脏标本于室温下解冻,在50%甲醇中以1∶10(w/v)的组织/溶液比均匀化。在使用均质器(德国IKA)的冰浴中,每均质10 s后,均化暂停10 s,重复均化2次直至获得均匀的匀浆[12-13]。每个样品均化后,均化器探针依次用水、甲醇和水清洗。然后在40 μL匀浆中加入200 μL的冷有机溶液(乙腈∶甲醇=1∶1),剧烈摇动20 s,室温下保存10 min,在4℃下以12 000 r/min离心15 min,取上清液待分析[12-13]。
1.4 色谱条件
色谱分离在RP柱(BEH,C18,1.7 μm×2.1 mm×100 mm,Waters,Ireland)和HILIC柱(BEH,Amide,1.7 μm×2.1 mm×100 mm,Waters,Ireland)上进行。RP分析的流动相:A相为含0.1%甲酸的乙腈-水(1∶9)溶液,B相为含0.1%甲酸的乙腈溶液。梯度程序如下:0~10 min,30%~80%B;10~12 min,80%B;12~14min,80%~30%B;14min,结束。两针样品之间的平衡时间为2min,流速为0.3mL/min,柱温为35℃,进样量为5μL。
HILIC分析的流动相:A相为含0.1%甲酸的水溶液,B相为含0.1%甲酸的乙腈溶液。梯度程序如下:0~10 min,95%~80%B;10~13 min,80%~70%B;13~14 min,70%B;14~16 min,70%~95%B;16 min,结束。两针样品之间的平衡时间为2 min,流速为0.3 mL/min,柱温为35℃,进样量为5 μL。
1.5 质谱条件
Agilent 6250四极杆飞行时间质谱仪,离子源为双ESI喷雾。雾化气和干燥气均为氮气,碰撞气为氦气。采集模式为正离子模式,毛细管电压为3 500 V,雾化温度为350℃,干燥气为10.0 L/min,雾化气为206.85 kPa。质谱扫描范围为m/z80~1 000,数据储存模式为centroid。质谱采集数据通过2个已知的标准品[六(1H,1H,3H-全氟丙氧基)磷氮和7H-嘌呤,对应m/z分别为922.009 80和121.050 9]进行实时校正。参比液通过Agilent isocratic泵以0.01 mL/min的速度喷入质谱。Auto MS/MS实验采用碰撞诱导解离(CID)碰撞的方式。
现行海岛垃圾外运处理成本高,海路运至珠海费用高达2 000元/t,镇政府每年支付压缩类垃圾的运费就要花费约190万元。就地焚烧,焚烧尾气排放不达标,污染海岛环境;生活垃圾经简单分类投入焚烧炉中,未经干燥的垃圾含水率高,燃烧过程不稳定,燃烧温度低;当燃烧温度低于800℃,烟气在氧气、烯烃、氯条件下易于产生二恶英等剧毒物质[12]。焚烧站刺鼻的烟气随海风传播,扩散半径可达500 m,常年在垃圾站的工作人员和附近居民的健康都会受到影响。
1.6 数据处理
通过Agilent Mass Hunter(version 2.0)和Mass Professor profiler(MPP)B2.0软件进行数据分析。在分子特征提取分析中,m/z的丰度数值大于500的数据被采集纳入分子特征的计算中。丰度的计算由Mass Hunter 2.0软件对每个分子相应的同位素和加合离子峰丰度加合后产生。最后,在采集的分子特征中,丰度大于3 000的分子特征被纳入和整理成数据以待进一步分析。
通过Mass Hunter 2.0软件产生的数据,进一步输入到MPP B2.0软件中进行分析。MPP B2.0分别采用排列、归一化、数据集分割和数据缩放等方法对数据集进行预处理[14]。质量聚类窗口为10 ppm,保留时间聚类窗口为0.1 min。上述数据按照80%规则进行处理,仅保留任何组中至少80%的变量用于分析。丰度值经中位数归一化及对数基二次变换后作为多变量分析的输入数据分析。所得数据最后应用SIMICAP+12.0统计软件进行偏最小二乘法判别分析(PLS-DA)。
2 结果与讨论
2.1 高脂血症金黄地鼠的血脂水平
造模6周后,不同组金黄地鼠血清的TG、TC、LDL-C、HDL-C浓度见表1。与正常对照组相比,模型组的TG、TC、LDL-C、HDL-C浓度明显升高,差异有统计学意义(P<0.000 1),说明高脂血症模型造模成功。

表1 金黄地鼠血清中TG、TC、LDL-C和HDL-C的浓度(xˉ±s,n=9)Table 1 Concentrations of TG,TC,LDL-C and HDL-C in serum of two groups hamsters(xˉ±s,n=9)
2.2 RPLC-MS与HILIC-MS分析
采用RPLC和HILIC结合飞行时间质谱(TOF MS)对高脂血症和正常金黄地鼠的肝匀浆液进行代谢组学研究。HIILC对极性化合物的分离优势已成为常规RPLC分离方法的重要补充。本研究采用HILIC模式测定872个特征变量,采用RPLC模式测定713个特征变量。在HPLC-TOF MS分析过程中,每进样分析6个样品后进1个质控(QC)样品,所有样品均取20 μL,混合成为均一的QC样品。在每种电离模式下选择6种代表性的离子评价分析方法的偏差,保留时间的相对标准偏差(RSD)小于1.0%,离子强度的RSD小于15%。结果表明,该方法是合理稳定的,数据可用于进一步的统计分析。
2.3 模式识别分析
采用PLS-DA对正常对照组和模型组肝匀浆中的代谢物谱进行分析,得到相应的散点分布图(如图1)。在RPLC模式下,PLS-DA结果(图1A)显示两组间有明显的分离,建模所用的主成分对原始数据的解释度R2Y=0.999,模型的可预测度Q2=0.966。在HILIC模式下,PLS-DA结果(图1B)显示模型组与对照组呈现明显的区别,PLS-DA参数如下:R2Y=0.988,Q2=0.940。HILIC和RPLC两种模式的数据均表明,高脂血症组的肝脏内源性代谢产物与对照组有显著差异。
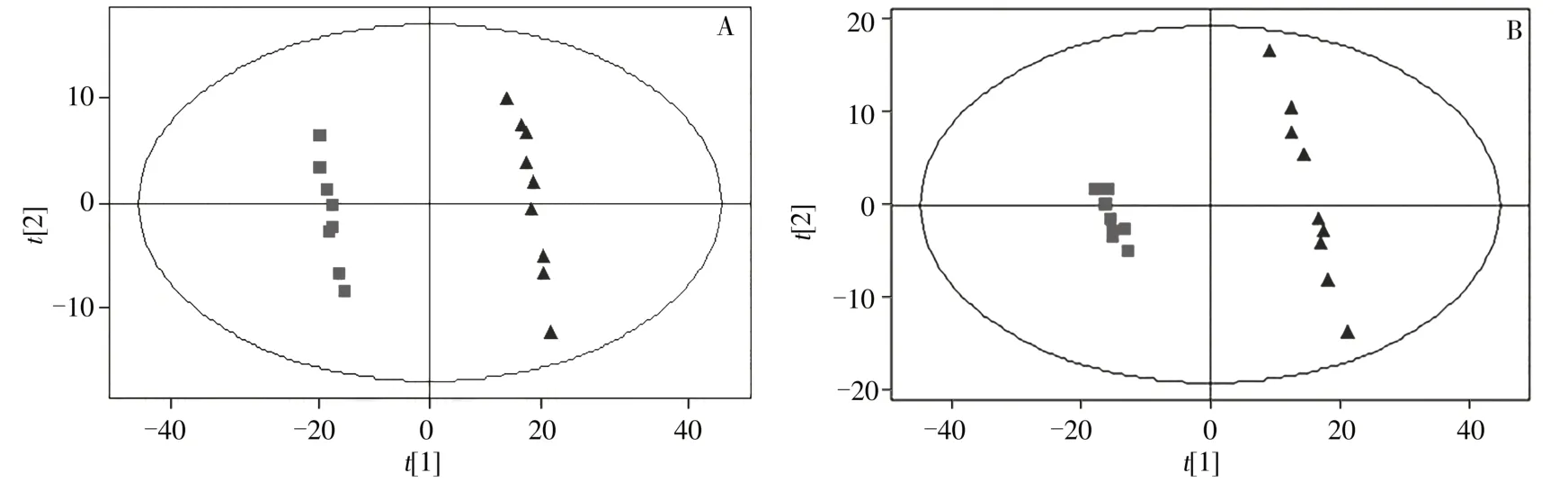
图1 基于RPLC-MS(A)和HILIC-MS(B)数据的PLS-DA模式识别图Fig.1 PLS-DA score plots based on data from RPLC-MS(A)and HILIC-MS(B)modes blue:control group;red:hyperlipidemic group
2.4 潜在生物标志物鉴定
VIP值(Variable importance for the projection)反映了每个变量(代谢物)对分类的影响,在PLS-DA处理后生成。从student′s t-test检验中筛选出VIP>1、P<0.05的潜在生物标志物进行进一步研究。首先利用这些特征的准确质谱和质谱同位素图谱搜索数据库METLIN(MPP中的辅助软件包)。然后在MS/MS实验的基础上,对这些候选生物标志物的碎片离子进行分析或与数据库进行比较[14]。其中,7种代谢物通过与标准化合物的比较得到了明确归属,但有些化合物特别是磷脂酰胆碱(PCs)仍需结合裂解途径分析。如图2,以PC(16∶0/18∶2)和PC(O-16∶0/2∶0)为例,阐明潜在生物标志物的鉴定。PC(16∶0/18∶2)的主要碎片离子m/z184代表磷胆碱离子,m/z86代表乙基三甲胺离子。PC(O-16∶0/2∶0)也具有m/z86离子的特征,但另一个离子m/z341是由磷胆碱离子的丢失形成。这些特征离子能区分PC和PE,而PE是一种主要的异构体,在裂解过程中性损失为m/z141。另一种碎片离子来自磷酸乙烯基。由于环氧树脂的结构,很容易与钠离子或钾离子结合形成加合离子m/z147和m/z163。最后,对16个潜在的生物标志物进行不同置信度的鉴定。潜在生物标志物见表2。

表2 金黄地鼠肝脏代谢差异代谢物Table 2 Differential metabolites in hamsters liver

图2 PC(16∶0/18∶2)(A)与PC(O-16∶0/2∶0)(B)的裂解分析Fig.2 MS/MS spectra and fragmentation analysis of PC(16∶0/18∶2)(A)and PC(O-16∶0/2∶0)(B)
2.5 生物功能分析
本研究表明,基于RPLC-MS和HILIC-MS技术的肝脏代谢组学可用于区分高脂血症金黄地鼠和对照组。在高脂血症金黄地鼠体内发现了16个具有显著变化的潜在生物标志物(见表2)。在这些内源性代谢产物中,模型组的次黄嘌呤和黄嘌呤呈明显下降趋势。在嘌呤代谢中,次黄嘌呤可被黄嘌呤氧化酶(XO)氧化为黄嘌呤,再进一步被氧化为尿酸,导致高脂血症金黄地鼠嘌呤代谢紊乱[15-16]。次黄嘌呤和黄嘌呤的降低可能表明黄嘌呤氧化酶活性上调,高活性XO可增加肝脏活性氧(ROS)自由基。ROS可能与多种生物分子发生反应,包括脂质、碳水化合物、蛋白质、核酸和结缔组织大分子,从而干扰细胞功能[17]。一项关于金黄地鼠肝脏蛋白质组学的研究也报道了XO在高脂肪饮食下的表达上调[18]。
5种PCs在高脂血症金黄地鼠体内呈上升趋势,提示金黄地鼠脂质代谢紊乱。PCs在脂质吸收和转运、细胞信号转导和脂蛋白合成等方面发挥着重要作用。肝脏是PCs合成和血浆脂蛋白生成的主要场所[19]。PCs对极低密度脂蛋白的合成至关重要,高水平的肝PCs可促进极低密度脂蛋白向血浆输出[20]。因此,PCs的增加最终导致金黄地鼠血浆中总甘油三酯和胆固醇的含量升高[17]。此外,模型组的甘油磷酸胆碱呈下降趋势,它是PCs分解代谢的代谢物[21]。这也是磷脂代谢异常的另一个证据,表明PCs的下游代谢产物也受到影响。
鞘脂是生物膜中的主要类脂,也是细胞信号传递中的生物活性脂质介质[22]。高脂血症组的神经鞘氨醇和二氢神经鞘氨醇呈升高趋势,提示鞘脂代谢紊乱。鞘脂的增加可能减少胆固醇逆向转运途径,这可能是高脂血症相关疾病中脂质紊乱的原因之一[23]。鞘脂还可通过鞘磷脂酶(Smase)代谢为神经酰胺,在高脂血症的炎症反应中起重要作用[24]。
高脂血症组金黄地鼠的赖氨酸分解代谢产物酵母氨酸和哌啶酸的含量均发生显著变化,说明高脂血症组金黄地鼠的赖氨酸代谢紊乱。赖氨酸经赖氨酸-酮戊二酸还原酶代谢产生酵母氨酸,酵母氨酸的增加可能预示着赖氨酸的减少。据报道,高脂血症组的游离赖氨酸水平较低可能提示高脂血症发病机制中氧化应激的发生,从而加重脂肪肝和脂肪堆积[25]。高脂血症组的精氨酸含量高。精氨酸是一种必需氨基酸,在心血管生理和病理生理中起着重要作用。它是一氧化氮合成的底物,在维持正常血管功能、降低血小板活性和白细胞粘附方面发挥重要作用[26-27]。在高脂血症状态下,对合成NO的需求增加,导致肝脏精氨酸含量增加。然而,精氨酸参与了许多代谢途径,其作用机制有待进一步研究。高脂血症组金黄地鼠体内异常的代谢途径(包括嘌呤代谢、赖氨酸代谢、鞘脂代谢和磷脂酰胆碱代谢)归纳见图3。
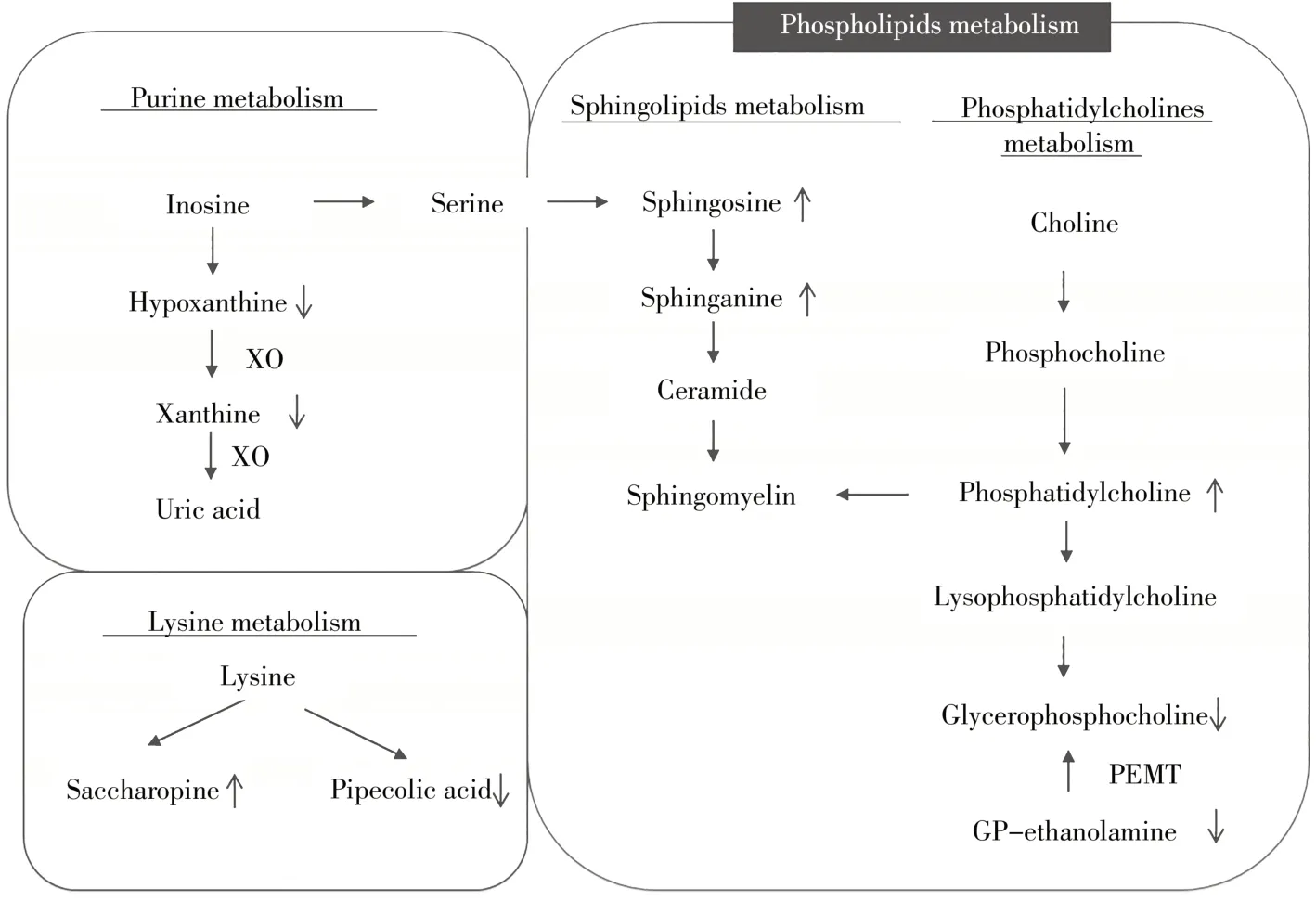
图3 高脂血症相关的生物代谢通路Fig.3 The disrupted metabolic pathway in hyperlipidemic hamsters
3 结论
本研究采用HILIC和RPLC色谱法结合TOF MS对高脂血症金黄地鼠肝脏代谢进行了分析。在MS/MS实验的基础上,通过与相应标准的比较,确定了16个潜在的生物标志物。结果显示,高脂血症金黄地鼠肝脏的嘌呤代谢、赖氨酸代谢、鞘脂代谢和磷脂酰胆碱代谢紊乱。研究结果表明,基于RPLCMS和HILIC-MS的代谢组学策略是寻找肝组织潜在生物标记物的有价值的工具。
