实验室数据可靠性常见问题汇总及解析
2021-08-10柴世英张月圆
柴世英 张月圆

摘 要:随着各企业数据完整性意识的提高及实验室计算机系统化的更新,近年来,制药行业实验室数据可靠性问题有所减少,但仍是监管机构检查的重中之重。在现在的法规要求和监管环境下,实验室如何持续动态地提升管理水平来满足法规要求依然是企业关注的重点。本文结合监管机构在实验室检查中发现的典型数据可靠性缺陷,梳理日常工作中容易发生的数据可靠性问题,对这些问题进行分析,并提出相应的解决方案和措施。
关键词:实验室 数据可靠性 常见问题 管理
中图分类号:TP311.13 文献标识码:A 文章编号:1674-098X(2021)04(c)-0162-03
Summary and Analysis of FAQ in Laboratory Data Reliability
CHAI Shiying ZHANG Yueyuan
(Xinchang Pharmaceutical Factory of Zhejiang Medicine Co., Ltd., Xinchang, Zhejiang Province,
312500 China)
Abstract: With the improvement of data integrity awareness of enterprises and the update of laboratory computerization system, the reliability of laboratory data in pharmaceutical industry has decreased in recent years, but it is still the top priority of regulatory inspection. In the current regulatory requirements and regulatory environment, how to continuously and dynamically improve the laboratory management level to meet the regulatory requirements is still the focus of enterprises. In this paper, combined with the typical data reliability defects found in the laboratory inspection by the regulatory agencies, we sort out the data reliability problems that are prone to occur in daily work, analyze these problems, and put forward the corresponding solutions and measures.
Key Words: Laboratory; Data reliability; FAQ; Management
1 數据可靠性介绍
数据可靠性(Data integrity)是指完全、一致和准确的数据应当归属到人、清晰可溯、同步记录、原始一致和准确真实。在过去几年中,各国监管机构对存在数据可靠性问题严重的制药公司,采取了越来越多的执法行动,例如警告信、进口警报、产品收缴和禁制令等。
实验室作为制药企业放行药品的检测机构,涉及检测的产品及项目众多,配备各种检测仪器、计算机系统及信息化平台,产生数据量大,人员流动性强,这都意味着实验室的数据可靠性是制药企业及监管机构不能忽略且非常重视的问题。
本文主要根据各国法规对数据可靠性的要求,结合近几年制药行业实验室出现的数据可靠性状况,梳理常见的实验室数据可靠性问题,讨论解决数据可靠性问题的方法和策略。
2 数据可靠性主要相关法规指南
近年各监管当局发布的数据可靠性主要法规指南,见表1。
3 近年实验室数据可靠性问题
3.1 实验室数据可靠性问题占比
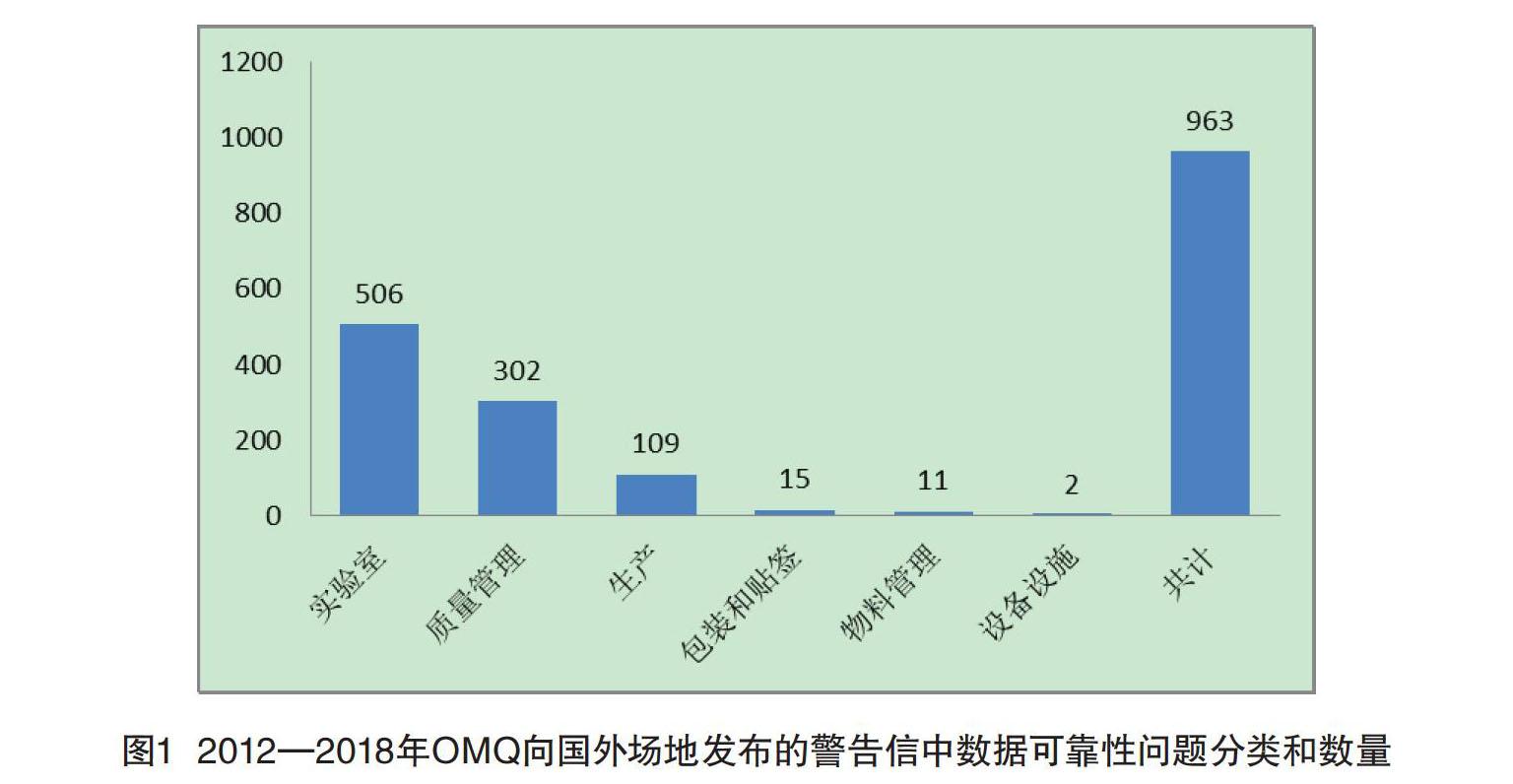
2012年至2018年OMQ共向国外场地发布239封警告信,其中涉及数据可靠性的有177封,其中指证数据可靠性问题的警告信的占比一直在70%以上。在这177封涉及数据可靠性问题的警告信中,共有约963项指证,其中实验室数据可靠性问题共有约506项指证,占比53%,如图1所示。
3.2 常见实验室数据可靠性问题
(1)未能防止对数据未授权的访问和更改,不能防止电子原始数据的篡改和删除。这条缺陷主要包括以下几个方面:①系统审计追踪显示数据或时间有更改;②分析员共用登录账号和密码,使得数据不能追溯到个人;③账号权限都是管理员权限,权限未进行分级;④产品进行未经说明或论证的“预测”或者“复试”;⑤分析测试过程中未经说明或论证地中断测试;⑥原始数据被删除;⑦数据未进行备份,或未将元数据和审计追踪包括在产品的数据备份中;⑧备份数据不能恢复;⑨分析员对数据进行手动积分,甚至从序列中删除或增加样品;⑩有审计追踪功能但未激活;⑩仪器使用日志与审计追踪不符;⑩分析者擅自关闭或开启审计追踪等。
(2)数据检测前未运行系统适用性:例如2017年6月22日FDA发布的警告信中指出某测试中心的NMR在检测前,未运行系统适用性,X月X日系统适用性失败后,没有调查原因也没有确定该系统适用性失败之前其他检测结果是否可靠。
(3)未能在活动发生的同时进行记录,例如:①2016年8月11日FDA发布的针对某制药企业的警告信中指出微生物检测结果没有同步记录某批原料药的微生物限度测试结果。②2016年6月21日FDA发布的针对某制药企业的警告信中指出不同批次产品的批生产记录上的时间基本一致,显示记录的填写和实际操作并不是同步完成的。③2019年7月某韩国OTC企业的483中指出,工厂在有“不进行同步记录”的前科下,在审计期间被检察官发现检测已完成,但未完成原始记录的填写。
(4)记录填写不完整:2017年4月24日FDA发布的针对某制药企业警告信中提出生产部门的清洁记录和设备使用日志填写不完整,质量部门清楚这种情况但未采取有效措施来避免发生。
综上所述,数据可靠性的问题不外乎这几个方面:账户权限、审计追踪、数据备份、数据更改或删除、预测或复试。
4 实验室出现的可靠性问题实例及讨论
4.1 账户和权限问题
文件规定QC的QA要进行计算机系统的审计追踪检查,但系统在分配角色时并未单独设置QA角色, QA进行检查时,使用资深分析者的角色和权限。仪器供应商的工程师校验人员没有“工程师”账户,在对公司的仪器设备进行校验时,使用的是实验室资深分析员的账户。现场要求QA打开审计追踪进行检查时,发现QA的权限分配过低,无法浏览产生的数据日志。
针对上述账户权限问题,首先要建立书面程序对计算机系统的用户角色如,对QA监督员、普通分析员、资深分析员、系统管理员、工程师等进行账户和权限分级,并对账户密码的难易程度、密码周期、允许的最大登录次数等进行规定。
4.2 审计追踪问题
有审计追踪功能但不开启;审计追踪被覆盖;审计追踪未随检测数据进行备份;审计追踪审核力度不够,存在问题但未发现;只有审核要求,未规定异常处理流程等。
针对上述审计跟踪问题,实验室应建立书面程序对审计追踪的方法、频率、角色、职责和方法;审计追踪审核人权限;审计追踪检查书面报告;审计追踪功能不能随意开启或关闭;发现异常情况的处理流程等内容进行规定。
4.3 数据备份问题
(1)某中控实验室的数据迄今为止从未进行过备份。(2)备份数据不完整。由于部分检测人员在进行数据分析时,未将数据保存至规定路径,导致备份人员进行备份时,出现数据遗漏。(3)备份的数据未按规定进行定期核查。
数据备份应关注的几个要点:(1)数据备份的频率(基于科学的评估);(2)数据备份不仅包括检测数据还应包括所有的审计追踪;(3)数据备份和恢复要进行验证;(4)备份数据应进行定期核查;(5)至少应一式两份且放在不同的区域。
5 如何提升实验室数据完整性管理水平
在监管机构介入之前,企业如何有效防范、察觉和整改这些问题,“数据可靠性”究竟靠什么?
(1)形成“从上而下”的质量文化。高级管理层必须发展和加强质量文化。建立并维护一种开放的企业文化,员工可以报告问题和失败,开诚布公,畅所欲言,不必担心打击报复,应该鼓励和奖励报告问题。
(2)关注和追踪监管机构的执法行动。根据法规和监管机构的要求,识别确定和修复存在的风险,加强监督,对纸质和计算机化系统开展漏洞评价。针对发现的问题,确定整改措施和实施时间表,将合规的解决方案落实到位。
(3)建立完善的数据完整性管理体系,包括整个实验室的数据可靠性管理策略,不同计算机化系统的权限分配及账户管理,审计跟踪检查的操作规程及实施频率、数据备份、服务器管理等。近年来,制药企业对于IT和质量监督也投入了越来越多的人力和资源,这也是数据完整性的一种趋势。
(4)基于评估和资源,进行设备设施或软硬件的升级。若经济实力允许,购买更新功能更强大的设备设施,或者对现有老旧的软件进行升级,使其具备用户权限分级、审计追踪、自动备份等功能,这样有利于对数据的管理。
(5)加强培训,提高企业员工整体水平。平时多组织开展数据完整性相关知识和实际案例的培训,让数据完整性的概念深入人心,使每位员工在具体操作实施时都能按照规范去做,去思考如何能够保证数据完整性,使得人人参与其中,创造一种好的企业氛围和质量文化。
参考文献
[1] 范一灵,秦峰,刘浩,等.WHO药品预认证微生物实验室质量管理的要求与思考[J].中国药事,2020, 34(4):417-423.
[2] 王濤.浅谈制药企业QC实验室检验数据可靠性的监控[J].首都食品与医药,2020,27(2):185-187.
[3] 杨涛.面向医学大数据的实验室检查结果结构化、标准化研究[D].苏州:苏州大学,2020.
[4] 周凡.数据挖掘在实验室信息管理系统中的应用研究[D].荆州:长江大学,2020.
[5] 苏丹,孙玉锋.电子数据管理系统在药物分析实验室中的应用[J].化工管理,2017(35):59.
[6] 林伟强.药品质量控制实验室数据备份合规性研究[J].现代计算机,2019(30):97-100.
