不同决策分析模型在抗肿瘤药物经济学评价中的应用
2021-08-10孟蕊芮明军王欣恬杨岚王子婧马爱霞
孟蕊 芮明军 王欣恬 杨岚 王子婧 马爱霞


中图分类号 R956 文献标志码 A 文章编号 1001-0408(2021)14-1752-06
DOI 10.6039/j.issn.1001-0408.2021.14.15
摘 要 目的:为我国抗肿瘤药物经济学评价的模型选择、以及我国肿瘤药物药物经济学评价证据质量的提升提供参考。方法:在加拿大藥品与卫生技术局(CADTH)官网对抗肿瘤药物卫生技术评估(pCODR)报告进行系统检索,报告时间限定为2015年1月1日-2020年9月6日,对其基本信息、模型类型及结构、模型中存在的关键问题等进行提取与总结。结果与结论:共检索获得185份pCODR报告,涉及114种肿瘤适应证和98种抗肿瘤药物。近5年CADTH抗肿瘤药物经济学评价数量呈递增趋势。在137份附有最终经济性指导报告的pCODR报告中,98份报告(占71.5%)使用了分区生存模型进行评估,21份报告(占15.3%)使用了状态转移模型,还有部分报告(6份,4.3%)同时使用了分区生存模型和状态转移两种模型以探讨模型结构的不确定性。在模型健康状态设定方面,86份报告(占62.8%)使用了三状态模型以评估不同抗肿瘤药物的经济性,还有16份报告(占11.7%)使用了不少于4种健康状态来模拟疾病的状态转归。但CADTH模型中尚存在研究时限选择不合理、疗效(生存)数据外推方法不合理或外推结果不确定、通过间接比较获取的疗效数据不确定以及部分假设或参数设置不符合实际诊疗环境等问题。鉴于分区生存模型的诸多优势,建议我国未来抗肿瘤药物经济学评价优先考虑使用分区生存模型或联合使用马尔可夫模型与分区生存模型来验证模型结构的不确定性,并合理设置重点模型参数,以提升我国抗肿瘤药物经济学评价的证据质量。
关键词 加拿大药品与卫生技术局;抗肿瘤药物;经济学评价;马尔可夫模型;分区生存模型
Application of Different Decision Analysis Models in the Economic Evaluation of Antitumor Drugs:Taking CADTH in Canada as an Example
MENG Rui1,2,RUI Mingjun1,2,WANG Xintian1,2,YANG Lan1,2,WANG Zijing1,2,MA Aixia1,2(1. School of International Pharmaceutical Business, China Pharmaceutical University, Nanjing 211198, China; 2. Pharma- coeconomic Evaluation Research Center, China Pharmaceutical University, Nanjing 211198, China)
ABSTRACT OBJECTIVE: To provide reference for selecting antitumor drugs economic evaluation models and improving the quality of evidence for antitumor drugs economics evaluation in China. METHODS: A systematic search of the antitumor drug health technology evaluation (pCODR) reports were conducted on the official website of the Canadian Agency for Drugs and Technologies in Health (CADTH). The search time was limited to Jan. 1st, 2015 to Sep. 6th, 2020. The basic information, model types and structure, and key limitations were extracted and summarized. RESULTS & CONCLUSIONS: A total of 185 pCODR reports were finally retrieved, involving 114 types of tumor indications and 98 types of antitumor drugs. The number of CADTH antitumor drugs economics evaluations in the past 5 years had shown an increasing trend. Among 137 pCODR reports with final economic guidance report, 98 reports (71.5%) adopted the PartSA model, 21 reports (15.3%) used the Markov model, and some reports (6 reports, 4.3%) used both PartSA and Markov models to explore the uncertainty of the model structure. In terms of model health status setting, 86 reports (62.8%) used three-state models to evaluate the economy of different antitumor drugs, and 16 reports (11.7%) used no less than four health states to simulate the outcome of disease state. However, there were still some problems in CADTH models, such as the unreasonable choice of research time limit, the unreasonable extrapolation method or uncertain extrapolation results of efficacy (survival) data, the uncertainty of efficacy data obtained by indirect comparison, and some assumptions or parameter settings did not conform to the actual diagnosis and treatment environment. In view of the advantages of PartSA model, it is suggested that PartSA model or Markov model combined with PartSA model should be used first to verify the uncertainty of model structure in the future economic evaluation of antitumor drugs; reasonable settings of key model parameters should be considered to improve the quality of evidence for antitumor drugs economics evaluation in China.
KEYWORDS CADTH; Antitumor drug; Economic evalua- tion; Markov model; PartSA model
据估计,2018年全球有1 700万癌症新发病例和950万死亡病例,到2040年,這一人数预估会增长到2 750万和1 630万[1]。随着临床诊治水平的提升,涌现出了较多的新型抗肿瘤治疗方案,在延长患者生存期和提高患者生存质量方面获益显著,然而,这些新型治疗方案的治疗成本通常十分高昂[2]。随着我国医保支出的持续增长,评估新方案多花的成本是否因改善健康产出而具有经济性成为用药决策中一项较为重要的问题。
通常,抗肿瘤药物治疗方案的药物经济学评估均采用决策分析模型,该模型可为综合现有证据提供定量框架,并生成相关的成本-效果评估结果,进而为相关决策提供证据支持[3-5]。决策分析常用的模型包括决策树模型、马尔可夫(Markov)模型(离散或连续)、分区生存(PartSA)模型和个体样本模型等。由于不同模型的构建技术与特征差异较大,因此选择不同的建模方法会对所模拟的结果产生较大影响[6-7],但限于资料难以获得或计算烦琐,很少有研究者会同时建立多个模型来评估同一个决策问题[8]。不同模型有其各自的特点和优势,由于传统Markov模型较早被应用于我国药物经济学评价中,因此目前发表的中文研究中,抗肿瘤药物治疗方案的经济学评价以Markov模型居多,而采用PartSA或其他模型的较少[9]。
加拿大药品与卫生技术局(Canadian Agency for Drugs and Technologies in Health,CADTH)作为全球较早开展卫生技术评估(health technology assessment,HTA)的机构之一,其完整规范的HTA体系可为各国开展卫生循证决策及相关研究提供方法学借鉴[10]。在加拿大,有关抗肿瘤药物的国家报销决策是由CADTH作出的。CADTH下设两个药物评议部门,即针对抗肿瘤药物的抗肿瘤药物HTA(pan-Canadian Oncology Drug Review,pCODR)部门和针对其他药物的普通药物审查(Common Drug Review,CDR)部门。其中,pCODR部门负责对抗肿瘤药物进行评估,根据评估结果向魁北克省以外的加拿大省级和地区级公共药物计划提供报销建议,以指导其抗肿瘤药物的报销决策[10-11]。因此,pCODR文件数量可直接反映出加拿大抗肿瘤药物的审批情况。pCODR报告中除了抗肿瘤药物的基本信息外,还包含了药品的最终经济性指导报告,以及针对药物经济学评价中所使用的模型及其存在的问题进行的介绍和总结。本研究拟在介绍国内外常用抗肿瘤药物经济学评价模型的基础上,以CADTH官网中近5年发布的pCODR报告为例,统计其不同药物经济学评价模型的应用情况,总结其模型构建中可能存在的问题,以期为我国抗肿瘤药物经济学评价模型的选择、以及我国抗肿瘤药物药物经济学评价证据质量的提升提供参考。
1 常用抗肿瘤药物经济学评价模型简介
1.1 PartSA模型
PartSA模型可通过一系列独立模拟的、非互斥的生存曲线直接估计每个健康状态下的人数比例[12]。如果N代表模型中的健康状态数,假设第n个健康状态的累积生存概率为S(t)n(n=1,2,…,N)(累积生存概率表示观察对象生存时间大于t时刻的概率),那么第1个健康状态的人数比例将直接由S(t)1决定,第2个直到第(N-1)个状态的人数比例分别由S(t)n-[S(t)n-1](n>1且n≤N-1)决定;而最后一个状态(一般为死亡)的人数比例由1-[S(t)n-1](n=N)决定。因此,若假设模型中有N个健康状态,模型构建则需要(N-1)条生存曲线[13]。
PartSA模型最常采用无进展(progression free,PF)、疾病进展(progression disease,PD)、死亡(death)等3种健康状态来构建模型,这种情况下通常需要两条生存曲线:总体生存(overall survival,OS)曲线和无进展生存(progression free survival,PFS)曲线。其中,PFS曲线下方的区域代表尚未进展的患者比例,OS和PFS曲线之间的区域代表已进展且仍存活的患者比例,其余区域代表已死亡的患者[14](如图1所示)。在某些治疗情境下,该模型也可以纳入更多的健康状态,例如,如果接受了初始治疗的患者在接受进一步治疗时发生了疾病进展,则该模型可以设置为4种健康状态——初始治疗无进展、进一步治疗无进展、进一步治疗后进展、死亡,这时则需要3条生存曲线以确定各状态的人数分布[13]。
PartSA模型具有较多优势:一是可直接应用生存曲线来获取不同健康状态患者的人数比例[15],且可通过外推的方法直接重构复杂的风险函数[16],因此计算上较为简单;二是无需对模型作出额外的假设以计算状态间的转移概率[17],因此更贴合患者的实际生存情况。由于PartSA模型仅适用于经历一系列渐进式健康状态过程且无法返回到上一状态的患者[17],因此常被应用在抗肿瘤药物的经济学评价中。
1.2 Markov模型
与PartSA模型直接从生存曲线得到各健康状态人数分布不同,Markov模型是基于健康状态之间随时间变化的转移概率来构建的,这些健康状态应是互斥的[18]。以三状态Markov模型(PF、PD、death)为例,其时间依赖的转移概率计算逻辑如下[19]——PF到PF的转移概率(pFTF)可直接根据PFS曲线重新拟合后的分布参数值得到,一般假设PF到death的概率(pFTD)为自然死亡率,因此PF到PD的概率(pFTP)=1-pFTF-pFTD。PD到PD的转移概率(pPTP)通常需要从OS曲线中剥离:首先根据OS重新拟合后的分布参数值可直接得到从存活到存活的转移概率(pSTS),模型从第2个周期开始的pPTP校正值=[(nPFS+nPD)×pSTS-nPFS×pFTF-nPFS×pFTD]/nPD(其中,nPFS表示上一周期处于PFS的患者数,nPD表示上一周期处于进展生存的患者数),因此PD到death的pPTD校正值即为1-pPTP,详见图2。
相较于PartSA模型,Markov模型最大的优点就是允许不同健康状态间的多向转移(即允许模型返回上一健康状态),更为灵活,因此可容纳更多的健康状态并考虑状态之间更为复杂的转归过程[15]。相应地,由于该模型对患者不同健康状态下的生存数据的要求更为全面具体,而在现实研究中这些临床数据往往缺失或不可得,因此模型中某些状态转移概率的计算常常基于假设[8]。尽管这些假设尽可能地贴合临床实际,但也不可避免地增加了结果估计的不确定性;除此之外,相较于PartSA模型直接从生存曲线获得不同健康状态患者的比例,Markov模型的状态转移概率计算也更为复杂。
2 CADTH中相关模型的应用情况
2.1 检索策略
在CADTH官网(https://www.cadth.ca/)对pCODR报告进行系统检索,报告时间限定为2015年1月1日至2020年9月6日,对其基本信息(报告号、年份、药品名称、适应证)进行统计,对最终经济性指导报告中的模型选择、健康状态确定以及pCODR药物经济学指导小组(clinical guidance panel,EGP)提出的模型中存在的关键问题[模型结构、研究假设、疗效(生存)数据获取及外推、模型参数来源等]进行提取与总结。
2.2 结果
共检索出185份pCODR报告,其中有137份报告附有最终经济性指导报告,故重点对这137份报告进行模型关键特征及结果分析。
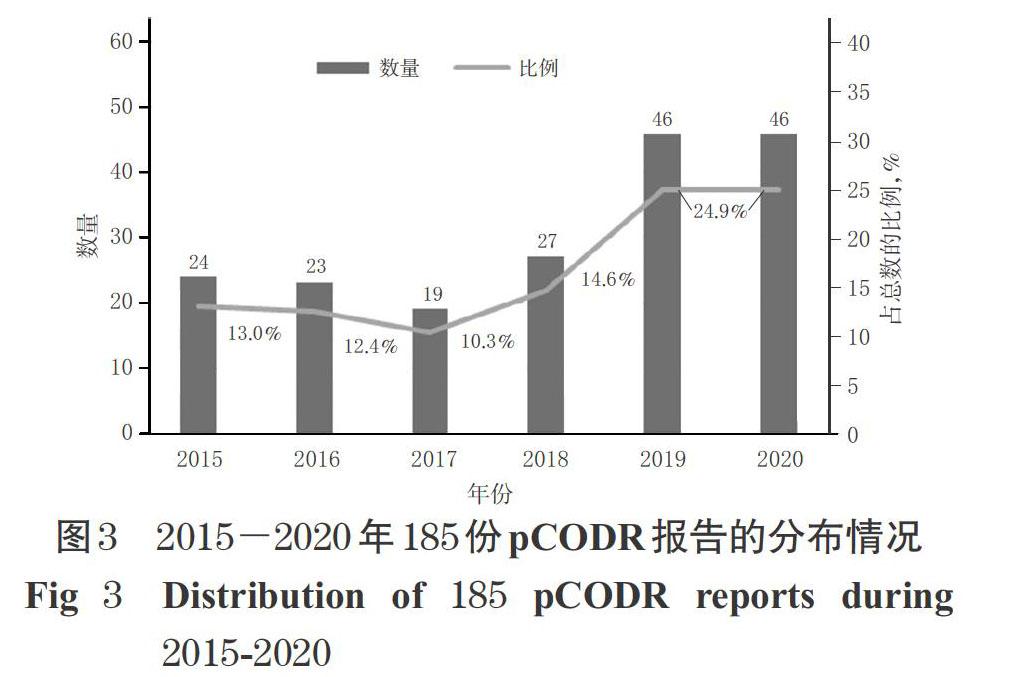
2.2.1 基本信息 2015-2020年185份pCODR报告的分布情况见图3。由图3可知,2019、2020年(截止到9月)的pCODR数量相比于2015-2018年增长较快。纳入的pCODR报告涉及的适应证包括非小细胞肺癌、多发性骨髓瘤、卵巢癌、急性髓性白血病、慢性淋巴细胞白血病、晚期或转移性乳腺癌等114种,其中评估数量最多的适应证为非小细胞肺癌,占pCODR报告总数的7%;其次为多发性骨髓瘤、卵巢癌和急性髓性白血病。185份pCODR报告中涉及的抗肿瘤药物(包括联合方案)多达98种,被评估最多的抗肿瘤药物为程序性死亡受体1(programmed death 1,PD-1)抑制剂帕博利珠单抗和纳武利尤单抗,其中,仅帕博利珠单抗,CADTH在2015-2020年期间共针对其进行了转移性黑色素瘤、晚期非小细胞肺癌、头颈部鳞状细胞癌和霍奇金淋巴瘤等13个适应证的pCODR评估。
2.2.2 模型特征 137份附有最终经济性指导报告的pCODR报告中,98份报告(占71.5%)使用了PartSA模型进行评估,21份报告(占15.3%)使用了状态转移模型[其中Markov模型(12.4%)占绝大多数,semi-Markov模型(2.9%)占极少数],还有部分报告(6份,占4.3%)同时使用了PartSA和状态转移两种模型以探讨模型的结构不确定性。在模型健康状态设定方面,86份报告(占62.8%)使用了三状态模型以评估不同抗肿瘤药物的经济性,还有16份报告(占11.7%)使用了不少于4种健康状态来模拟疾病的状态转归,详见表1。
2.3 模型中存在的问题
药品生产企业往往为了增大治疗组方案具有经济性的可能性,在进行药物经济学评估时会对研究假设、疗效(生存)数据获取及外推、模型参数来源等进行干预,以使成本-效果估计结果倾向于治疗组。对此,EGP会对企业提交的整个经济性评价模型进行审查,并对其中的主要问题提出质疑并责令其进行参数修改,以重新判断其所评价的药物治疗方案是否具有经济性[20]。为此,本研究对137份pCODR报告中EGP提出的修改意见或关键问题进行了总结,以期为我国抗肿瘤药物经济学评估研究提供借鉴。
2.3.1 研究时限选择不合理 企业所提交的模型常存在研究时限选择不合理的问题(55份,占40.1%)。当模型选择的研究时限过短时,研究时限到达终点时研究中的总体存活人数还未降至某较低比例(一般为1%),导致模型结果不能反映治疗方案对患者终生的经济性。对于某些进展较快、患者存活时间较短的恶性肿瘤,选择较长的研究时限也是不合适的:首先这不符合临床实际,其次外推也会增加生存曲线长期估计的不确定性,最终导致经济性评价结果估计存在较大偏差。例如,某项研究采用了25年的研究时限,而该治疗方案的患者中位OS只有1年,且在该研究的关键临床试验中,患者开始治疗的基线年龄为70岁,而这一目标群体的平均預期存活时间不会达到25年[21]。故该模型在研究时限方面选择不够合理,使得所得结果不能适当反映相关药物治疗方案的经济性。
2.3.2 疗效(生存)数据外推方法不合理或外推结果存在不确定性 本研究纳入的pCODR报告中,共有56份(占40.9%)报告被EGP提出存在疗效(生存)数据外推方法不合理或外推结果存在不确定性的问题。在对抗肿瘤药物进行经济性评价时,企业提交的报告中的模型常常会存在上述问题,包括临床生存数据不成熟(比如试验期结束时仍未到达中位OS或PFS),生存曲线存在较长的平台期或交叉等,使得对生存曲线的拟合外推存在极大的不确定性;此外,选择不恰当的生存分布函数可能会导致生存曲线的外推结果与试验期内趋势相悖,也会增加外推结果的不确定性。例如,基于拟合结果,某治疗药物OS曲线外推使用广义Gamma模型和Log-Logistic模型都是合适的,然而由于使用广义Gamma模型进行OS外推时,在第4年至第5年拟合所得治疗组与对照组患者的OS曲线存在交叉,因此该研究采用了Log-Logistic模型。但实际上广义Gamma模型能更准确地反映第4年至第5年治疗组与对照组患者OS的趋同,与试验期内生存曲线趋势一致,而Log-Logistic模型则无法反映,这时采用Log-Logistic模型可能会增加OS外推的不确定性[22]。
2.3.3 通过间接比较获取疗效数据存在不确定性共有23份报告(占16.8%)存在通过间接比较获取疗效数据的问题。由于缺乏组间直接疗效比较证据,许多研究会采用网状Meta分析(network-meta analysis,NMA)或匹配调整间接比较以得出治疗组和对照组的疗效比较结果,这些间接方法的使用会给药物经济学评价过程引入较大的不确定性。例如,NMA常常会面临样本量小、没有形成闭环以验证一致性、在研究设计和基线特征方面存在异质性等问题[23],这些问题都会导致经济性评价结果不确定性较大。
2.3.4 其他 在药物经济学评价中,不合理的模型假设及参数设置会对成本-效果估计结果产生极大的影响,企业所提交的模型除了上述问题外,还存在着诸多不符合实际诊疗环境的问题,包括:健康状态的设置无法代表患者实际的状态转移路径;换药方案不符合本国临床用药实际;未考虑药物治疗所带来的不良反应负效用值;死亡率假设不合理,如使用一般人群死亡率代表某疾病状态人群死亡率;成本考虑不够全面合理,如未考虑复发成本和临终护理成本,或在缺少某些成本数据时,假设该项成本与其他肿瘤治疗成本相同,但未有足够的证据支持这些假设等。
3 对我国抗肿瘤药物经济学研究的启示
3.1 相关研究可优先考虑使用PartSA模型
除了CADTH外,英国国家卫生和临床技术优化研究所(NICE)在HTA和药物经济学研究方面也有较多经验值得借鉴。Bullement等[12]在2019年对NICE发布的抗肿瘤药物技术评估中使用的经济学评价模型进行了总结,研究结果表明,这些评估大多数使用的是PartSA模型,其次是Markov模型。而在我国,相较于较早被应用的Markov模型,PartSA模型还未得到广泛使用,目前仅有少数研究应用了此模型方法。例如,邵荣杰等[9]在2019年对PartSA模型的概念及其与Markov模型的区别联系进行了介绍,并对PartSA模型的计算方法进行了实例分析;刘新义等[24]在2019年也作了类似方法学的介绍。与邵荣杰等[9]研究的不同之处在于,刘新义等[23]在生存曲线试验期与外推期均使用了参数拟合出的生存数据,而邵荣杰等[9]仅在外推期使用了参数拟合所得到的生存数据。曾小慧等[25]在2020年对PartSA模型健康状态设置及四状态模型结构进行了介绍。徐赫等[26]在2020年使用PartSA模型进行了帕博丽珠单抗一线治疗非小细胞肺癌的成本-效果分析。由于相较于Markov模型,PartSA模型因计算更为简便且不用因数据不可得而对某些转移概率作出假设,已逐渐在抗肿瘤药物经济学评价中得到越来越广泛的应用,因此建议我国学者在未来开展此类研究时可优先考虑在合适的情况下使用PartSA模型。
3.2 结合Markov模型与PartSA模型以验证模型结构的不确定性
尽管目前国内外较少有研究使用多种模型模拟产出以验证模型结构的不确定性,但英国NICE曾指出,Markov模型应和PartSA模型一起使用,以帮助验证PartSA模型外推的合理性并消除外推期的不确定性[13]。Rui等[14,27]在对顺铂+吉西他滨对比紫杉醇+吉西他滨一线治疗晚期转移性三阴乳腺癌、奥西替尼对比多西他赛+贝伐珠单抗三线治疗晚期转移性非小细胞肺癌等方案进行经济性评价时,均分别采用了Markov与PartSA模型等两种模型对同一套参数进行模拟,结果显示,两种模型模拟出的增量成本-效果(ICER)存在差异;Smare等[15]采用3种不同的模型(PartSA、Markov、semi-Markov模型)对同一个体水平试验数据进行了OS拟合,结果3种模型均存在差异;Gibson等[28]运用两种PartSA模型以及1种Markov模型对肿瘤免疫制剂的健康产出进行了模拟,基于PartSA模型所得不同健康状态患者的短期生存情况与临床试验非常接近,而Markov模型得到的短期结果却高估了处于PFS状态的患者比例。以上这些研究均表明,运用不同模型结构对抗肿瘤药物成本及产出的模拟结果均存在着差异。可见,在对抗肿瘤药物方案进行经济性评估时模型的选择尤为重要,研究者可考虑同时采用不同模型对结果进行验证。
3.3 合理设置重点模型参数,以增加结果估计的准确性
在运用模型进行抗肿瘤药物经济学评价的过程中,数据获取常常是较难实现的一部分,常见的问题有:比较方案缺乏头对头的疗效直接比较结果;临床生存数据不成熟,外推存在极大不确定性[29];实际诊疗过程中发生的成本复杂且难以估测;不良反应负效用值的数据缺失等,而这些问题常常要通过一些更贴合实际的假设或通过专家咨询来解决。本研究综合了CADTH的137份抗肿瘤药物经济学评价报告中EGP所提出的问题,发现其主要聚集在研究时限的设置,疗效(生存)数据的获取及外推,以及模型健康狀态、用药方案、患者效用值、死亡率、成本等模型参数的考量和假设上,而这些模型参数的变动对成本-效果估计结果的影响是极大的[30-31]。因此,建议我国相关研究者在今后进行抗肿瘤药物经济学评价时重点考虑这些模型参数的来源及假设是否合理、证据支持是否充分,从而提高经济性评价结果的准确性,提升经济学评价证据的质量。
4 本研究的局限性
(1)本研究仅纳入了近5年的报告进行分析。由于pCODR报告总数量较多,但报告数量在2019年之后才出现较大幅度的增加,且由于药物经济学评价的时间依赖性,笔者认为近5年的报告数量和结果可以反映当前CADTH抗肿瘤药物评估现状。(2)由于Markov和PartSA模型为抗肿瘤药物经济学评估中应用最广泛的两类模型,因此本研究仅对这两种模型进行了对比总结,但肿瘤药物经济学评价中还有semi-Markov模型、决策树模型、个体样本模型等,虽应用较少,但可在今后的研究中对其模型特征和构建技术进行总结。(3)CADTH公开的pCODR报告对模型具体结构、研究方法及假设、参数设置的描述有限,因此本研究无法获取模型的详细说明,而英国HTA机构NICE的HTA报告对模型的描述较为规范、具体,但已有学者对其进行了相关总结,今后的研究可将NICE及CADTH的模型总结结果进行综合比较,以期为我国肿瘤药物HTA提供更为合理全面的方法学参考。
5 结语
近5年CADTH抗肿瘤药物经济学评价数量呈递增趋势,多数评价采用PartSA模型,其次是Markov模型;鉴于PartSA模型的诸多优势,建议我国未来肿瘤药物经济学评价在合适的情况下优先考虑使用PartSA模型,或联合使用Markov模型与PartSA模型来验证模型结构的不确定性,并合理设置重点模型的参数,以提升我国抗肿瘤药物经济学评价的证据质量。
参考文献
[ 1 ] American Cancer Society. Cancer facts & figures 2018[EB/OL]. [2021-06-30]. https://www.cancer.org/research/cancer-facts-statistics/all-cancer-facts-figures/cancer-facts-fi-
gures-2018.html.
[ 2 ] FRANCOIS C,ZHOU J,POCHOPIEN M,et al. Oncology from an HTA and health economic perspective[J]. Recent Results Cancer Res,2019,213:25-38.
[ 3 ] FREDERIX GW,HAJI A L I,AFZALI H,et al. Development and use of disease-specific(reference)models for economic evaluations of health technologies:an overview of key issues and potential solutions[J]. Pharmacoecono- mics,2015,33(8):777-781.
[ 4 ] CARLSON J J,SUH K,ORFANOS P,et al. Cost effectiveness of alectinib vs. crizotinib in first-line anaplastic lymphoma kinase-positive advanced non-small-cell lung cancer[J]. Pharmacoeconomics,2018,36(4):495-504.
[ 5 ] BENSIMON AG,ZHOU ZY,JENKINS M,et al. An economic evaluation of pembrolizumab versus other adjuvant treatment strategies for resected high-risk stage Ⅲ melanoma in the USA[J]. Clin Drug Investig,2020,40(7):629- 643.
[ 6 ] DRUMMOND M F,BARBIERI M,WONG J B. Analytic choices in economic models of treatments for rheumatoid arthritis:what makes a difference? [J]. Med Decis Mak,2005,25(5):520-533.
[ 7 ] BRENNAN A,CHICK SE,DAVIES R. A taxonomy of mo- del structures for economic evaluation of health technologies[J]. Health Econ,2006,15(12):1295-1310.
[ 8 ] RUI M,WANG Y,FEI Z,et al. Will the Markov model and partitioned survival model lead to different results:a review of recent economic evidence of cancer treatments[J]. Expert Rev Pharmacoecon Outcomes Res,2021,21(3):373-380.
[ 9 ] 邵榮杰,唐文熙,马爱霞.分区生存模型在药物经济学评价中的应用[J].中国卫生经济,2019,38(9):60-63.
[10] 徐赫,田磊,孟蕊,等.不同类型研究设计在卫生决策中的应用情况[J].中国医院药学杂志,2020,40(18):1905- 1909,1956.
[11] 周挺,李洪超,马爱霞,等.加拿大药品统一审评制度及价格管理体系简析[J].中国卫生经济,2018,37(2):94-96.
[12] BULLEMENT A,CRANMER H L,SHIELDS G E. A review of recent decision-analytic models used to evaluate the economic value of cancer treatments[J]. Appl Health Econ Health Policy,2019,17(6):771-780.
[13] WOODS B S,SIDERIS E,PALMER S J, et al. NICE DSU technical support document 19:partitioned survival analysis for decision modelling in health care:a critical review [EB/OL].(2017-06-02)[2021-06-30]. http://nicedsu.org.uk/wp-content/uploads/2017/06/Partitioned-Survival-
Analysis-final-report.pdf.
[14] RUI M,SHI F,SHANG Y,et al. Economic evaluation of cisplatin plus gemcitabine versus paclitaxel plus gemcitabine for the treatment of first-line advanced metastatic triple-negative breast cancer in China:using Markov mo- del and partitioned survival model[J]. Adv Ther,2020,37(9):3761-3774.
[15] SMARE C,LAKHDARI K,DOAN J,et al. Evaluating partitioned survival and Markov decision-analytic mode- ling approaches for use in cost-effectiveness analysis:estimating and comparing survival outcomes[J]. Pharmacoeconomics,2020,38(1):97-108.
[16] BULLEMENT A,LATIMER N R,BELL GORROD H. Survival extrapolation in cancer immunotherapy:a validation-based case study[J]. Value Health,2019,22(3):276- 283.
[17] WILLIAMS C,LEWSEY J D,MACKAY D F,et al. Es- timation of survival probabilities for use in cost-effectiveness analyses:a comparison of a multi-state modeling survival analysis approach with partitioned survival and Markov decision-analytic modeling[J]. Med Decis Making,2017,37(4):427-439.
[18] SIEBERT U,ALAGOZ O,BAYOUMI A M,et al. ISPOR- SMDM modeling good research practices task force. State-transition modeling:a report of the ISPOR-SMDM modeling good research practices task force-3[J]. Value Health,2012,15(6):812-820.
[19] 周挺,马爱霞,付露阳.药物经济学评价Markov模型中转移概率计算的探讨[J].中国卫生经济,2017,36(12):40- 42.
[20] CADTH. Procedures for the CADTH pan-Canadian onco- logy drug review[EB/OL].(2015-05-05)[2020-09-04]. https://www.cadth.ca/sites/default/files/pcodr/pCODR%27s%20Drug%20Review%20Process/pcodr-procedures.pdf.
[21] CADTH. Arzerra for chronic lymphocytic leukemia:details[EB/OL].(2015-01-29)[2020-09-04]. https://www.cadth.ca/sites/default/files/pcodr/pcodr-arzerra-cll-fn-egr.pdf.
[22] CADTH. Cabozantinib(Cabometyx)for hepatocellular carcinoma[EB/OL].(2020-04-22)[2021-06-30]. https://www.cadth.ca/sites/default/files/pcodr/Reviews2020/10186Ca-
bozantinibHCC_fnEGR_NOREDACT-ABBREV_EC_22-
Apr2020_final.pdf.
[23] SONG F,LOKE Y K,WALSH T,et al. Methodological problems in the use of indirect comparisons for evaluating healthcare interventions:survey of published systematic reviews[J]. BMJ,2009,338:b1147.
[24] 劉新义,谭重庆,曾小慧,等.分区生存模型在药物经济学评价中的应用简介及实例解析[J].中国现代应用药学,2019,36(24):3090-3093.
[25] 曾小慧,彭六保,谭重庆,等.药物经济学评价中的分区生存模型[J].中国新药与临床杂志,2020,39(8):504-507.
[26] 徐赫,马爱霞.基于分区生存模型的帕博利珠单抗单药与化疗一线治疗PD-L1肿瘤比例分数不同的非小细胞肺癌的成本-效果分析[J].中国医院药学杂志,2020,40(23):2468-2473.
[27] RUI M,LI H. Cost-effectiveness of osimertinib vs doce- taxel-bevacizumab in third-line treatment in EGFR T790M resistance mutation advanced non-small cell lung cancer in China[J]. Clin Ther,2020,42(11):2159-2170.
[28] GIBSON E J,BEGUM N,KOBLBAUER I,et al. Mode- ling the economic outcomes of immuno-oncology drugs:alternative model frameworks to capture clinical outcomes[J]. Clinicoecon Outcomes Res,2018,10:139-154.
[29] 田磊,赵昕锐,李洪超.我国肿瘤免疫治疗经济学评价研究现状与挑战[J].卫生经济研究,2021,38(1):35-39.
[30] CARO J J,BRIGGS A H,SIEBERT U,et al. ISPOR- SMDM modeling good research practices task force:mo- deling good research practices:overview:a report of the ISPOR-SMDM modeling good research practices task force-1[J]. Med Decis Making,2012,32(5):667-677.
[31] BRIGGS A H,WEINSTEIN M C,FENWICK E A,et al.ISPOR-SMDM modeling good research practices task force:model parameter estimation and uncertainty analysis:a report of the ISPOR-SMDM modeling good research practices task force working group-6[J]. Med Decis Making,2012,32(5):722-732.
(收稿日期:2021-01-20 修回日期:2021-06-30)
(编辑:孙 冰)
