“从脾论治方”对原发免疫性血小板减少症小鼠血管活性因子的影响
2021-08-09王佳褚雨霆王冲侯丽郎海燕陈科陈信义张雅月
王佳 褚雨霆 王冲 侯丽 郎海燕 陈科 陈信义 张雅月

摘要 目的:观察“从脾论治方”对原发免疫性血小板减少症(ITP)小鼠血管活性因子的影响,探讨“从脾论治方”的止血效应机制。方法:以被动型免疫造模法建立ITP小鼠模型,以泼尼松、归脾汤、健脾益气方、健脾益气摄血方为干预药物,以ELISA检测模型小鼠血清血管内皮素-1(ET-1)、血栓素A2(TXA2)、血管性血友病因子(vWF)、血管内皮细胞黏附分子-1(VCAM-1)、前列腺素(PG)、前列环素(PGI2)、一氧化氮(NO)、一氧化氮合酶3(NOS3)、血栓调节蛋白(TM)水平。结果:1)升血小板疗效:注射APS后第15天(给药第8天),模型对照组小鼠外周血血小板计数(PLT)仍显著低于正常对照组,而各给药组小鼠外周血PLT与正常对照组比较差异无统计学意义(P>0.05),并且明顯高于模型对照组。2)止血疗效:注射APS后各组小鼠均有不同程度出血倾向,药物干预第6天及第8天,各观察组出血等级明显低于模型对照组。3)血管促凝活性因子:实验各组VCAM-1水平显著低于正常对照组,差异有统计学意义(P<0.05);健脾益气组和归脾汤组VCAM-1水平均显著高于模型对照组和泼尼松组,健脾益气摄血组VCAM-1水平明显高于泼尼松组,差异有统计学意义(P<0.05)。4)血管抗凝活性因子:实验各组TM水平明显低于正常对照组,健脾益气摄血组TM水平显著低于模型对照组,差异有统计学意义(P<0.05)。结论:“从脾论治”方可以升高ITP模型小鼠外周血PLT,降低出血分级,并且可以通过上调VCAM-1、下调TM检测值调节促凝与抗凝活性因子的动态平衡。
关键词 从脾论治;原发免疫性血小板减少症;血管活性因子;血管促凝活性因子;血管抗凝活性因子
Abstract Objective:To observe the effect of “Congpi Lunzhi Formula” on vasoactive factors in ITP mice,and to explore the hemostatic effect mechanism of “Congpi Lunzhi Formula”.Methods:The ITP mice immune model was established by means of passive immunization.Prednisone,Guipi Decoction,Jianpi Yiqi Decoction,Jianpi Yiqi Shexue Formula were used as intervention drugs,and serum ET-1,NO,NOS3,TXA2,PGI2,vWF,VCAM-1 of model mice were detected by ELISA and TM levels were detected by ELISA.Results:1)Increasing efficacy of platelet:On the 15th day after APS injection(the 8th day of administration),the PLT count in the peripheral blood of the model control group was still significantly lower than that of the normal control group,while the peripheral blood PLT of the mice in the model control group was lower than the normal control group.However,the peripheral blood PLT of mice in each administration group had no statistical difference compared with the normal control group,and was significantly higher than the model control group.2)Hemostatic effect:After injection of APS,mice in each group have different degrees of bleeding tendency.On the 6th and 8th day of drug intervention,the bleeding level of each experimental group was significantly lower than that of the model control group.3)Vascular procoagulant activity factors:the levels of VCAM-1 in each experimental group were significantly lower than those in the normal control group; the levels of VCAM-1 in the Jianpi Yiqi group and the Guipi Decoction group were significantly higher than those in the model control group and the prednisone group.The level of VCAM-1 in the Jianpi Yiqi Shexue group was significantly higher than that in the prednisone group.4)Vascular anticoagulant activity factors:the TM levels of each experimental group were significantly lower than those of the normal control group,and the TM levels of Jianpi Yiqi Shexue group were significantly lower than the model control group.Conclusion:Treatment from spleen could improve PLT count of ITP model mice,degrade the bleeding scale.Moreover,it can upregulate VCAM-1,downregulate TM,keep the dynamic balance of coagulant and anticoagulant factors.
Keywords Treatment from spleen; Immune thrombocytopenic purpura; Vasoactive factors; Vascular coagulant active element; Vascular anticoagulant active element
中图分类号:R242文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.11.011
原发免疫性血小板减少症(Immune Thrombocytopenic Purpura,ITP)以外周血小板破坏增多,以及骨髓生成血小板减少为主要病理表现,是临床常见的血液系统出血性疾病。目前对于ITP发病机制尚不完全清晰,公认的发病机制系多重因素导致的自身免疫功能紊乱[1-2]。根据中医学理论,结合慢性ITP的临床特征,其发病系脾气虚弱,不能正常发挥统摄血液的功能所致[3]。因此,“从脾论治”是ITP的基本治疗原则[4-5]。课题组在前期临床与实验研究基础上,采用被动免疫造模法成功复制了ITP动物模型[6-8]。本研究利用ITP模型小鼠,选择归脾汤、健脾益气摄血方、健脾益气方和泼尼松为干预药物,以外周血血小板计数(PLT)、出血程度分级、血管相关促凝及抗凝活性因子为检测指标,试图从血管活性因子动态平衡的角度探索“从脾论治”缓解ITP出血的效应机制。
1 材料与方法
1.1 材料
1.1.1 动物
豚鼠100只(雌雄各半),体质量250 g,许可证号:SCXK(陕)2012-001(陕西省兴平市天瑞实验动物养殖厂),普通環境饲养;BALB/c小鼠160只(雌雄各半),体质量18~22 g,许可证号:SCXK(陕)2014-002(原解放军第四军医大学实验动物中心),无特定病原体(SPF)级实验室IVC鼠笼饲养。其中,40只用于抗小鼠血小板血清制备,120只用于造模并进行疗效机制研究。该研究通过伦理委员会审批(伦理审批号:XYLS2019069)。
1.1.2 药物
实验用中药浸膏由西安星华药物研究所按照中药新药药学标准制备并提供(批号:20140322):健脾益气摄血浸膏(黄芪、党参、茯苓、白术、阿胶、茜草、炙甘草)。健脾益气浸膏(黄芪、党参、茯苓、白术、炙甘草)。归脾汤浸膏(人参、白术、当归、茯苓、黄芪、龙眼肉、远志、炒酸枣仁、木香、炙甘草)。泼尼松(上海晶纯生化科技股份有限公司,批号:28778)。
1.1.3 试剂与仪器
对硝基苯磷酸二钠(上海晶纯生化科技股份有限公司,批号:H1419017);弗氏完全佐剂(Sigma-Aldrich,美国,批号:SLBF2619V),弗氏不完全佐剂(Sigma-Aldrich,美国,批号:SLBH7317V);冻干酶联A蛋白(博士德生物,批号:BST07A19B80);叠氮化钠(郑州派尼化学试剂厂,批号:20140515);二乙醇胺(天津市科密欧化学试剂有限责任公司,批号:20140110);小鼠血清ET-1、NO、NOS3、TXA2、PGI2、vWF、VCAM-1、TM试剂盒(武汉基因美生物科技有限公司,批号:201411)。微量高速离心机(湖南长沙湘仪检测设备有限公司,型号:H1650-W);全波长酶标仪(美国赛默飞科技公司,美国,型号:Multiskan GO no.51119300);全自动动物血液分析仪(北京普朗新技术有限公司,型号:XFA6130)。
1.2 方法
1.2.1 抗小鼠血小板血清(Anti-platelet Serum,APS)制备与效价检测
本研究中APS的制备与效价检测方法沿用课题组在国家重点基础研究发展计划(2013CB531705)“脾主运化、主统血等脏象理论研究”项目下的“脾不统血所致血小板减少性紫癜从脾论治的疗效机制及规律研究”课题中使用的方法[6-8]。
1.2.2 造模与分组给药
从120只小鼠尾静脉取血,用全自动血液分析仪检测PLT,随机分为6组(正常对照组,模型对照组,泼尼松组,归脾汤组,健脾益气组,健脾益气摄血组),每组20只。给予正常对照组小鼠生理盐水腹腔注射(100 μL/20 g),其余5组1次/d腹腔注射黄芪多糖注射液(APS)(100 μL/20 g),直至实验结束。注射APS第8天开始,除正常对照组和模型对照组外,其余4组均按照0.1 mL/10 g体积灌胃给药,实验结束后(注射APS第15天)进行各项指标检测。
1.2.3 外周血PLT检测
分别于注射APS前、注射后48 h、第8天(开始给药)、第12天以及第15天,从各组小鼠尾静脉取血,用全自动血液分析仪检测各组小鼠外周血PLT。
1.2.4 出血程度分级观察
参照2010年卫生部医政司发布的《免疫性血小板减少性紫癜临床路径》,结合动物实验特点,将出血程度分4级[9]。0级:无出血现象。Ⅰ级:注射部位轻度出血,其他部位有散在出血点。Ⅱ级:注射部位明显出血,并见有其他部位瘀斑、瘀点。Ⅲ级:注射部位严重出血,皮肤大量瘀斑、瘀点,或皮肤发黑或破溃。观察时间点为注射APS第8天(用药前)、注射APS第13天(用药第6天)、注射APS第15天(用药第8天)3个时间点动态观察出血分级变化。
1.2.5 血管活性因子检测
实验结束后,各组随机取12只小鼠予以断颈处死,取腹主动脉血,稍静置,上机560×g离心,收集血清,根据酶联免疫吸附试验法(ELISA)试剂盒说明书,进行各项指标检测。其中,6只小鼠血清用于血管促凝活性因子血管内皮素-1(ET-1)、血栓素A2(TXA2)、血管性血友病因子(vWF)、血管内皮细胞黏附分子-1(VCAM-1)检测;6只小鼠血清用于血管抗凝活性因子前列腺素(PG)、前列环素(PGI2)、一氧化氮(NO)、一氧化氮合酶3(NOS3)、血栓调节蛋白(TM)检测。酶标仪测定OD值,根据标准曲线计算样品的水平。
1.3 统计学方法
采用SPSS 23.0统计软件分析所有数据,计量资料以均数±标准差(±s)表示,组间多重比较采用方差分析,两两比较采用LSD检验,计数资料则采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 抗血清效价测定结果
APS血清组OD值平均为0.300,空白孔OD值平均为0.163,相差约2倍(P<0.01)。
2.2 升血小板疗效
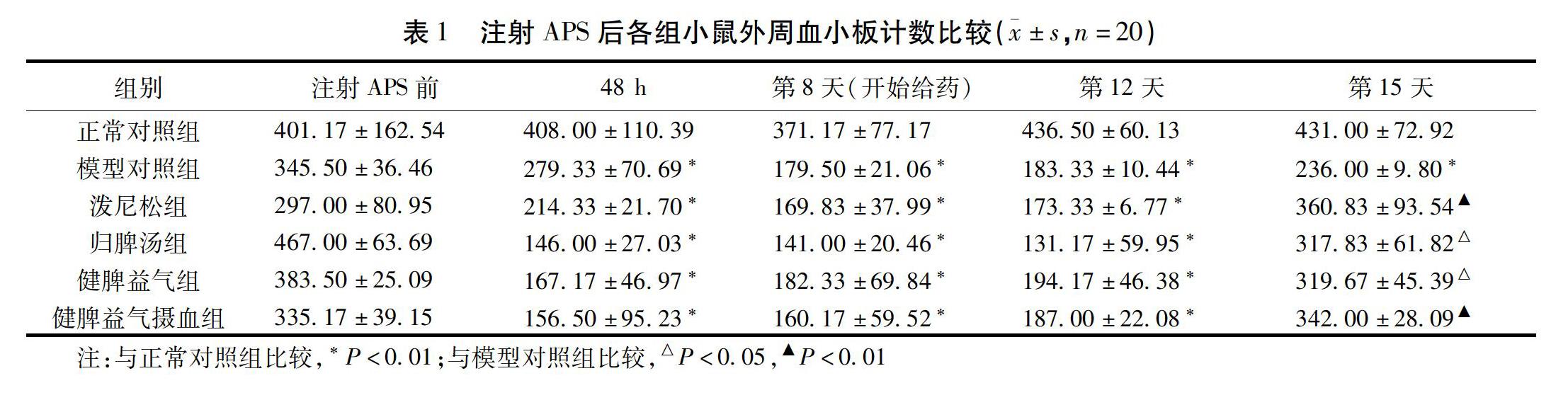
注射APS前各组小鼠外周血PLT比较差异无统计学意义(P>0.05),具有可比性。注射APS后的48 h,实验各组小鼠外周血PLT均显著低于正常对照组,差异有统计学意义(P<0.01),提示已成功建立血小板减少模型。注射APS第8天(开始给药)到第12天,实验各组小鼠外周血PLT仍然显著低于正常对照组,差异有统计学意义(P<0.01)。注射后第15天(给药第8天),模型对照组小鼠外周血PLT仍显著低于正常对照组,差异有统计学意义(P<0.01),而各给药组小鼠外周血PLT与正常对照组比较,差异无统计学意义(P>0.05),证明实验药物可明显提高实验小鼠外周血PLT。其中,泼尼松组(P<0.01),健脾益气摄血组(P<0.01),归脾汤组(P<0.05),以及健脾益气组(P<0.05)小鼠外周血PLT均明显高于模型对照组,提示泼尼松与“从脾论治方”在提升ITP模型小鼠外周血PLT方面具有明显优势。见表1。
2.3 止血疗效
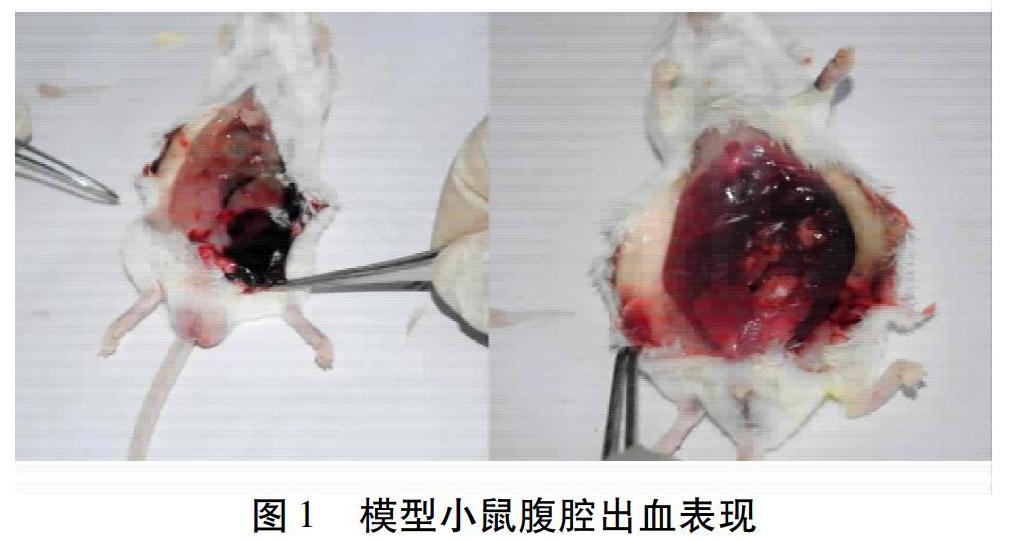
注射APS造模后小鼠出现不同程度出血。如图1所示,处死小鼠腹腔中有大量出血,腹膜遍布出血点,提示造模成功。
按照觀测时间点以及出血分级标准,每组随机观察10只小鼠出血分级变化。给药前(注射APS第8天),除正常对照组外,实验各组出血程度分级分布经非参数检验,差异无统计学意义(P=0.998),提示组间具有可比性。说明注射APS后各组小鼠均有不同程度出血倾向。药物干预第6天,各组出血等级显著降低,与模型对照组比较,差异有统计学意义(P=0.014)。下降幅度从大到小依次为泼尼松组(P=0.002)、健脾益气摄血组(P=0.003)、归脾汤组(P=0.003)、健脾益气组(P=0.021)。药物干预各组间比较差异无统计学意义(P>0.05)。药物干预第8天,各组出血等级明显下降,与模型对照组比较,经非参数检验,差异有统计学意义(P<0.01)。出血等级下降幅度从大到小依次为泼尼松组(P<0.01)、健脾益气摄血组(P<0.01)、归脾汤组(P<0.01)、健脾益气组(P<0.01)。药物干预组间比较差异无统计学意义(P>0.05)。见表2。
2.4 血管促凝活性因子
ET-1:实验各组与正常对照组比较,ET-1水平明显降低,差异有统计学意义(P<0.01)。TXA2:实验各组与正常对照组、模型对照组比较,TXA2水平均明显升高,差异有统计学意义(P<0.01);各给药组组间比较,差异无统计学意义(P>0.05)。vWF:实验各组与正常对照组比较,vWF水平明显降低,差异有统计学意义(P<0.01)。VCAM-1:实验各组与正常对照组比较,VCAM-1水平明显降低,差异有统计学意义(P<0.01);但是健脾益气组和归脾汤组VCAM-1水平均显著高于模型对照组和泼尼松组(P<0.01),健脾益气摄血组VCAM-1水平明显高于泼尼松组,差异有统计学意义(P<0.01);健脾益气组和归脾汤组比较,差异无统计学意义(P>0.05)。见表3。
2.5 血管抗凝活性因子
NO:实验各组与正常对照组比较,NO水平明显下降,差异有统计学意义(P<0.01),组间比较差异无统计学意义(P>0.05)。NOS3:除归脾汤组外,各组检测值与正常对照组比较均明显下降(P<0.05),归脾汤组NOS3水平显著高于模型对照组,差异有统计学意义(P<0.05);其余各组间比较差异无统计学意义(P>0.05)。PGI2:与正常对照组比较,只有健脾益气组和归脾汤组PGI2水平明显下降(P<0.01),其中归脾汤组PGI2水平显著低于模型对照组(P<0.05)。TM:实验各组与正常对照组比较TM水平明显降低,差异有统计学意义(P<0.01);健脾益气摄血组显著低于模型对照组,差异有统计学意义(P<0.05)。见表4。
3 讨论
从骨髓巨核细胞分化产生的血小板在机体止血和凝血过程中发挥着重大作用,当ITP患者外周血小板计数低于50×109/L时,则存在出血发生的风险,ITP出血与患者外周血PLT数量及其质量密切相关[10]。然而在临床实际中,许多ITP特别是慢性ITP患者,虽然外周血PLT低于50×109/L,甚至低于安全水平(30×109/L),但其出血倾向并不明显。有些患者经相关治疗后外周血PLT依然处于较低水平,但是并没有伴随明显的出血症状。可见ITP患者外周血PLT减少并不是导致出血的唯一因素,很可能是参与凝血机制多个环节共同作用的结果。
其中,血管及其血管分泌的活性因子发挥着至关重要的作用[11]。血管是生物体运送血液的管道,除维持血液与组织间物质交换外,正常血管中存在大量的活性物质,以调控血管生理状态。特别是血管内皮细胞是分泌、合成和释放血管活性物质的重要场所,这些活性物质具有舒缩血管、调控血管张力与促进血液凝固的多重效果。
舒张血管活性因子与抗凝机制关系密切,主要包括前列腺素:前列腺素(PG)及其代谢后的衍生物如前列环素(PGI2)。其对血液凝固作用主要是导致血管舒张,抑制血小板聚集与调节血小板活化[12]。一氧化氮和一氧化氮合酶3:一氧化氮(NO)和一氧化氮合酶3(NOS3)可以通过松弛平滑肌,使血管扩张,从而穿过细胞膜进入血管腔,降低血小板的凝集和黏附性,发挥舒张血管和抗凝作用[13]。血栓调节蛋白:血栓调节蛋白(TM)是使凝血酶由促凝转向抗凝的重要血管内凝血抑制因子,主要是调节机体凝血与抗凝血动态平衡[14]。
收缩血管活性因子与凝血机制密切相关,主要包括血管内皮素:血管内皮素(ET)是维持血管张力的重要内源性活性因子,具有长效收缩血管的作用。在ET系统的3个肽配体中,血管内皮素-1(ET-1)收缩血管的作用最强,其对血管特别是微小血管的收缩作用有利于血液凝固和止血[15]。血栓素A2:血栓素A2(TXA2)是一强血管收缩因子,可以激活血小板、使其聚集,有利于修复组织损伤和止血[16]。血管性血友病因子:血管性血友病因子(vWF)是一种有黏附性的多聚体糖蛋白。与血小板膜GPⅠb-Ⅸ复合物及细胞内皮下胶原结合,介导血小板在血管损伤部位黏附以及与因子凝血因子Ⅷ结合来有效止血[17]。此外,vWF也能结合GPⅡb-Ⅲa,参与血小板聚集过程。血管内皮细胞黏附分子-1:血管内皮细胞黏附分子-1(VCAM-1)是一种介导细胞间或者细胞和外基质间相互作用的细胞黏附分子,其活性降低会导致血管通透性增加,组织缺血与缺氧,增加血液外渗[18]。
控制血管张力的血管舒缩活性因子是一对矛盾的统一体。一般认为,血管舒张活性因子具有抗凝效应,既是预防血栓形成的关键因子,也是影响血液凝固/止血的重要物质;血管收缩活性因子具有促进凝血效应,既是血栓形成的危险因素,也是促进血液凝固/止血的关键。二者的动态平衡在不同的疾病中担当不同角色。当机体发生血小板减少特别是原发免疫性血小板减少症,紊乱的免疫机制可导致血管内皮细胞损伤,血管分泌、合成和释放血管活性因子比例失调,直接或间接影响了血管舒缩与凝血功能。因此,有效的调节血管舒缩活性因子,能在ITP患者低血小板数值情况下,预防出血风险或达到止血效果。基于此,课题组在临床实践中,确立了“从脾论治”ITP的重要治则[19],拟定了“从脾论治”的健脾益气摄血方。前期临床试验证明,该方可明显提升ITP患者外周血PLT,改善出血与相关临床症状[20-21]。动物实验也证实,该方具有提升模型小鼠外周血PLT与良好的止血效果[22-25],并明确了部分效应机制[26-28]。为进一步探讨“从脾论治”ITP疗效机制,我们以健脾益气摄血方(四君子汤加炙黄芪、阿胶、茜草)为标准观察药物,选择健脾益气方(四君子汤加炙黄芪)、归脾汤原方为“从脾论治”方,观察三方对ITP动物模型外周血PLT、出血程度分级与血管活性因子影响。经效价检测,证实本研究所制备的血清有效[4]。研究结果显示:注射APS后第15天(给药第8天),模型对照组小鼠外周血PLT仍显著低于正常对照组,而各给药组小鼠外周血PLT与正常对照组比较差异无统计学意义,并且明显高于模型对照组;注射APS后各组小鼠均有不同程度出血倾向,药物干预第6天及第8天,各观察组出血等级明显低于模型对照组,提示“从脾论治”方可有效提升ITP小鼠外周血小板数值,缓解出血症状。此外,造模成功后模型对照组VCAM-1和TM水平显著降低,而健脾益气组和归脾汤组VCAM-1水平均显著高于模型对照组和泼尼松组,健脾益气摄血组VCAM-1水平明显高于泼尼松组,健脾益气摄血组TM水平也显著低于模型对照组,可见“从脾论治”方可提升ITP小鼠外周血VCAM-1水平,并且降低TM检测值。
综上所述,“从脾论治”方除具有提升ITP模型小鼠外周血PLT、降低出血分级作用以外,其上调血管促凝活性因子VCAM-1,下调血管抗凝活性因子TM检测值,调节促凝与抗凝活性因子的动态平衡可能是其有效止血的效应机制之一。
参考文献
[1]熊婷婷.免疫性血小板减少症的细胞免疫致病机制研究最新进展[J].中国小儿血液与肿瘤杂志,2019,24(6):321-327.
[2]Kühne T,Berchtold W,Michaels LA,et al.Newly diagnosed immune thrombocytopenia in children and adults:a comparative prospective observational registry of the Intercontinental Cooperative Immune Thrombocytopenia Study Group[J].Haematologica,2011,96(12):1831-1837.
[3]刘元梅,周延峰.中医治疗原发免疫性血小板减少症研究进展[J].中国民族民间医药,2018,27(1):57-59.
[4]吴玉霞,袁忠,马西虎,等.从脾论治慢性原发性免疫性血小板减少性症临床疗效观察[J].世界中医药,2016,11(9):1782-1785.
[5]李天天,侯丽,张雅月,等.从脾论治免疫性血小板减少性紫癜的理论基础与临床实践[J].北京中医药,2015,34(4):304-306.
[6]张爱军,侯明.免疫性血小板减少性紫癜动物模型的研究进展[J].中国实验血液学杂志,2006,14(3):623-626.
[7]郎海燕,褚雨霆,马薇,等.免疫性血小板减少症病证结合动物模型研究[J].中医药信息,2017,34(1):39-43.
[8]何昊,徐玥,秦蓓,等.免疫性血小板减少性紫癜动物模型建立方法与应用评价[J].现代生物医学进展,2016,16(10):1971-1974.
[9]陈锐.免疫性血小板减少性紫癜临床路径(2010年版)[J].中国社区医师,2011,27(11):17.
[10]余钢成.22例ITP临床出血风险的分析[J].江西醫药,2010,45(8):801-802.
[11]李伟,张咪娟,王琰,等.血小板活化因子和血管内皮活性标志物与腔隙性脑梗死的关系[J].华西医学,2019,34(10):1143-1147.
[12]蔡大振,张霞.当归对高血压病患者中医证候疗效、血清炎性因子、血浆血栓素及前列环素水平的影响研究[J].中医临床研究,2019,11(32):37-39.
[13]全守东,于亚杰,梁志霞.一氧化氮吸入联合米力农治疗新生儿持续性肺动脉高压的疗效及对血流动力学、血小板聚集功能的影响[J].临床和实验医学杂志,2020,19(1):89-91.
[14]徐静,丁艳妮,杨敏,等.联合检测D二聚体与活化部分凝血活酶时间、凝血酶调节蛋白对乳腺癌患者术后下肢深静脉血栓形成的价值[J].血栓与止血学,2019,25(6):952-953.
[15]武曲星,王攀,王冬芝,等.免疫性血小板减少症气不摄血证小鼠模型血管内皮活性物质变化动态研究[J].中国中医药信息杂志,2019,26(12):56-61.
[16]张颖,刘红旭,康群甫,等.参元丹优化方对动脉粥样硬化小鼠胰岛素抵抗及血清血栓素A_2/前列环素比值和DNA甲基化水平的影响[J].中国中医药信息杂志,2018,25(8):53-57.
[17]常方圆,冯泽瑞,王志敏.冠心病病人血清vWF、GDF-15、PCSK-9、APN的变化特点及与冠状动脉病变程度的关系[J].中西医结合心脑血管病杂志,2019,17(22):3570-3573.
[18]朱翔鸿,丁秦超,赖尚磊,等.激活自噬改善炎性因子诱导的血管细胞粘附分子1的表达[J].现代预防医学,2019,46(13):2419-2423.
[19]吴晓勇,陈广雷,王云龙,等.中医药治疗免疫性血小板减少症的机制[J].中国实验方剂学杂志,2017,23(8):213-219.
[20]王珺,张蕴,张玲,等.健脾益气摄血颗粒治疗免疫性血小板减少症临床疗效观察[J].中华中医药杂志,2018,33(12):5700-5704.
[21]郎海燕,张玲,王佳,等.健脾益气摄血颗粒影响免疫性血小板减少症患者出血与免疫功能研究[J].医学研究杂志,2019,48(9):45-49.
[22]李潇,朱长乐,赵宁,等.健脾益气摄血方及其拆方对辛伐他汀诱导斑马鱼脑出血的防治作用研究[J].北京中医药大学学报,2017,40(12):1004-1010.
[23]张雅月,田劭丹,祁烁,等.健脾益气摄血方及其拆方对辛伐他汀诱导斑马鱼心脏出血模型血流量影响研究[J].中国医药导报,2017,14(36):9-12,24.
[24]褚雨霆,朱晓宇,张雅月,等.健脾益气摄血方对辛伐他汀诱导斑马鱼出血模型的止血效果研究[J].中国实验血液学杂志,2017,25(3):853-859.
[25]何昊,孙艳平,郑蕾,等.健脾益气摄血方对ITP模型小鼠外周血象的影响[J].中医药学报,2015,43(6):22-24.
[26]陈科,戴欣媛,赵宁,等.脾不统血证相关疾病与血液神经递质变化关系研究[J].辽宁中医杂志,2018,45(2):245-248.
[27]徐玥,何昊,郑蕾,等.健脾摄血方对ITP小鼠血清神经递质表达影响研究[J].世界中西医结合杂志,2017,12(7):928-932.
[28]何昊,徐玥,鄭蕾,等.健脾益气摄血方对ITP模型小鼠血清SIgA和β-EP影响研究[J].中医药信息,2015,32(5):47-49.
(2020-02-24收稿 责任编辑:杨觉雄)
