傣百解醇提取物不同极性部位体外抗氧化和抑菌活性研究
2021-08-09李晓花段志航赵彩云金玲钰曾绮雯张丽霞
李晓花 段志航 赵彩云 金玲钰 曾绮雯 张丽霞


摘要:目的 研究傣百解醇提物不同极性萃取物对1,1-二苯基-2-三硝基苯肼自由基(DPPH·)和羟基自由基(·OH)的清除率,及对大肠杆菌(EC.)和绿脓假单胞菌(Pa.)的抑菌活性。方法 采用95%乙醇回流提取傣百解根,减压浓缩以水分散,依次用乙酸乙酯、正丁醇萃取,得到乙酸乙酯部位(DBJ-1)、正丁醇部位(DBJ-2)和水部位(DBJ-3);采用经典体外抗氧化活性试验,以抗坏血酸(Vc)作为阳性对照,考察傣百解醇提物不同极性部位对DPPH·和·OH的清除率;采用滤纸片法测定提取物的抑菌圈,二倍稀释法测定提取物及阳性药物的最低抑菌浓度(MIC)和最小杀菌浓度(MBC)。结果 傣百解醇提物不同极性萃取物均具有的抗氧化和抑菌活性,排序为DBJ-2>DBJ-1>DBJ-3,抗氧化活性和抑菌效果随质量浓度的增加而增强。DBJ-2对DPPH·和·OH的IC50分别为0.75 mg/mL和0.98 mg/mL;对EC.和Pa.的抑菌圈(2.79±0.10)cm和(1.89±0.06)cm,最小抑菌浓度(MIC)为0.195 mg/mL和0.781 mg/mL,最小杀菌浓度(MBC)为1.563 mg/mL和6.25 mg/mL。结论 傣百解醇提取物不同极性部位均具有一定的抗氧化和抑菌活性,正丁醇萃取部位效果最强,为该植物的临床应用及开发提供理论依据。
关键词:傣百解;提取物;抗氧化;抑菌
中图分类号:R285.5 文献标志码:A 文章编号:1007-2349(2021)06-0069-05
傣百解为萝藦科牛奶菜属植物通光散Marsdenia tenacissima(Roxh.)Moon,傣名“雅解先打”,意为解百毒的药,具有清火解毒、消肿止痛的功效,临床用于咽喉肿痛、口舌生疮、疗疡斑疹、肺热咳嗽、胃脘痛、尿痛、解药食毒;还可用于清除因饮食不洁、用药不当而致的各种不良反应,在西双版纳、德宏等地,及东南亚国家老挝、缅甸等傣族居住地区使用广泛[1-2]。前期调研发现,傣百解民间用于多种肿瘤疾病、皮肤病的治疗,并具有解酒保肝作用。现代药理学研究显示:傣百解具有抗肿瘤,调节脂肪肝等药理活性和抗病毒;文献报道,傣百解中含有生物碱、脂肪酸、酯类、莽草酸、糖等成分,主要活性成分为C21甾体皂苷类化合物[3-8]。近年来的研究表明:中药的次生代谢产物,如黄酮、多酚、皂苷等,具有抗氧化、抗炎、促细胞凋亡多种生物活性[9-10]。目前,国内外对傣百解的化学成分及药理活性研究报道较少,本文依据傣百解的临床及民间应用,以醇提取物的乙酸乙酯、正丁醇和水部位作为研究对象,通过1,1-二苯基-2-三硝基苯肼(DPPH)自由基和羟基自由基的清除实验,以及对大肠杆菌和绿脓假单胞菌的抑菌活性,考察傣百解不同极性部位的体外抗氧化和抑菌活性,为傣百解的临床应用和开发利用提供支持。
1 材料与方法
1.1 材料
1.1.1 仪器 流水式粉碎机(DF-35,温州大德),旋转蒸发仪(R-100,瑞士步琦),恒温水浴锅(HWS-24,上海一恒科学仪器有限公司),电子天平(ME204,梅特勒-托利斯),鼓风干燥箱(BGZ-246,上海博迅实业有限公司),恒温摇床培养箱(ST20H,冠森生物科技上海公司),超净工作台(HCB-1300V,青岛海尔特种电器有限公司),高压灭菌锅(GI80TW,厦门致微仪器有限公司),台式离心机(L420,长沙湘仪离心机仪器有限公司)。
1.1.2 药物与试剂 傣百解有西双版纳版纳药业有限责任公司提供,经中国医学科学院药用植物研究所云南分所张丽霞副研究员鉴定为萝藦科牛奶菜属植物傣百解Marsdenia tenacissima 的根茎,材料经过粗粉后,备用。原标本保存于中国医学科学院药用 植 物 研 究 所 云 南 分 所 标 本 馆(标 本 号D20100720008)。FeSO4·7H2O(天津索罗门生物科技有限公司),水杨酸(天津索罗门生物科技有限公司),福林酚试剂(BR,南京奥多尼生物科技有限公司),DPPH(BR,成都艾科达化学试剂有限公司),LB培养基(北京鼎国昌盛生物技术有限公司),琼脂(美国Invitrogen公司),葡萄糖(美国Sigma公司),琼脂粉(日本Japan公司),DMSO(美国Sigma公司)。
1.1.3 菌种 绿脓假单胞菌(Pa.,博伟生物技术有限公司),大肠杆菌(Ec.,天津赛尔生物技术有限公司)。
1.2 实验方法和步骤[11-13]
1.2.1 提取物的制备 傣百解药材采自西双版纳,根切段后,烘干粉碎、过20目筛,加入10倍量的95%乙醇回流提取2次,每次2 h,将提取液减压浓缩至无醇,适量热水混悬后放置至室温,依次用等体积的乙酸乙酯和正丁醇萃取,每种溶剂萃取至萃取液色浅量少。合并各极性萃取液,减压浓缩至干,称重,获得傣百解乙酸乙酯萃取部位、正丁醇萃取部位和水部位,分别标记为DBJ-1、DBJ-2和DBJ-3。
DBJ-3用超纯水溶解,DBJ-1和DBJ-2用0.2%的DMSO-水溶液溶解,母液浓度为1000 mg/mL,备用。
样品浓度设置为200、400、600、800、1000、1200 μg/mL,用于抗氧化活性检测。
母液稀释至终浓度25 mg/mL,0.22 μm过滤器过滤除菌,用于抑菌活性检测。
1.2.2 试剂的配制 (1)DPPH贮备液的制备:准确称取19.72 mgDPPH,用无水乙醇定容至500 mL,得到浓度为0.1 mmol/L的DPPH溶液贮备液,置于冰箱中冷藏备用。(2)9 mmol/L乙醇-水杨酸的制备:称1.243 g水杨酸,乙醇溶解,定容至100 mL,稀释10倍。(3)9 mmol/L FeSO4的制备:称2.502 g,FeSO4·7H2O,蒸馏水溶解,定容至100 mL,稀释10倍。(4)8.8 mmol/L H2O2的制备:量取1 mL 30%双氧水,蒸馏水定容至100 mL,稀释10倍。(5)LB培养基的制备:10 g胰蛋白胨、5 g酵母提取物、10 g氯化钠、15 g琼脂粉,加蒸馏水至950 mL,混匀后,NaOH調pH至7.0,加水至1000 mL,121℃高压灭菌20 min。(6)营养胨培养基的制备:10 g蛋白胨、3 g牛肉膏、氯化钠5 g,15 g琼脂粉,加蒸馏水至950 mL,混匀后,NaOH调pH至7.2~7.4,加水至1000 mL,121℃高压20 min。
1.2.3 含菌平板的制备 将15 mL灭菌琼脂培养基倒入无菌培养皿制平板,待平板完全凝固冷却,取100 μL稀释好的浓度1×107 cfu/mL菌液至培养皿内,用无菌棒涂抹均匀,封口膜密封后放4 ℃冰箱备用。
1.2.4 傣百解提取物的抗氧化活性 采用DPPH自由基、羟基自由基清除率等方法,评价傣百解提取物不同极性部位的抗氧化活性,明确活性部位。
1.2.4.1 DPPH自由基清除能力的测定 将傣百解提取物的各萃取部位配成浓度为200、400、600、800、1000、1200 μg/mL浓度的溶液,移取1 mL提取物与3 mL浓度为0.1 mmol/L的DPPH溶液摇匀,反应30 min后在517 nm处测吸光值A1;同时测定1 mL对应浓度提取液加入3 mL无水乙醇反映30 min后的吸光值A2;作为对照,在1 mL蒸馏水中加入3 mL DPPH溶液做空白试验并测吸光值A0。每个实验做3份平行试验,取平均值。以同浓度梯度的抗坏血酸做为阳性。
1.2.4.2 羟基自由基清除能力的测定 将傣百解提取物的各萃取部位配成浓度为200、400、600、800、1000、1200 μg/mL浓度的溶液,各取1 mL稀释后的溶液,依次先加入9 mmol/L FeSO4溶液1 mL,9 mmol/L乙醇-水杨酸溶液1 mL,及8.8 mmol/L H2O2溶液1 mL,摇匀。37℃加热30 min后取出,510 nm处测其吸光度A1;以蒸馏水替代水杨酸在相同条件下测吸光值A2,将提取液用蒸馏水代替水杨酸在相同条件下测吸光值为A0,每个实验3次重复,取平均值,清除率按照下式计算:
式中:A0—用蒸馏水代替提取液与过氧化氢-水杨酸体系反应后测得的吸光值;
A1—提取物与体系反应后测得的吸光值;
A2—用蒸馏水代替水杨酸与体系反应后测得的吸光值
1.2.5 傣百解提取物体外抑菌活性研究 选取大肠杆菌和绿脓假单胞菌菌种,将供试菌涂布于固体培养基斜面上,37℃活化培养24 h;挑取单个菌落接种无菌液体培养基中,37℃摇床培养18~24 h,制得初始菌悬液;用无菌生理盐水将菌悬液稀释至含菌体约107 CFU/mL,备用。
将15 mL灭菌琼脂培养基倒入无菌培养皿制平板,待平板完全凝固冷区,取100 μL稀释好的浓度为1×107CFU/mL菌液至培养皿内,用无菌棒涂布均匀,封口膜密封后放4℃冰箱备用。
1.2.5.1 抑菌圈测定 取灭菌双层圆形滤纸片(6 mm),将滤纸浸在各样品溶剂中,设DMSO和纯水空白对照,对羟基甲酸乙酯阳性对照。取出滤纸片晾干,轻轻放在含菌平板的相应位置;贴好滤纸片的含菌平板倒置放入4℃冰箱静置2 h后,置于恒温培养箱37℃培养24 h;培养结束后,用精确度为1/10 mm的游标卡尺十字交叉测量抑菌圈直径,实验结果取3个平行组的平均值。抑菌圈越大,表示抑菌效果越好。
1.2.5.2 最小抑菌浓度(MIC)的测定 采用试管等倍稀释法,量取1.0 mL样品浓度为50 mg/mL的溶液加入到第一支试管中,再加入1 mL灭菌培养基;从第一支试管中取出1 mL溶液,滴加到第二支试管中,依此类推至第九管。第10管含有2 mL培养基,并弃去1 mL;同时以1 mL 相同浓度的DMSO和纯水代替药物提取物与培养基混合做空白对照,相同浓度的对羟基苯甲酸乙酯为阳性对照;采用微量加样器向各试管中均加入制备好的菌悬液100μL(1×107 CFU/mL),摇匀后放入培养箱中37 ℃培养24 h,取出试管充分震荡混匀,并对各个试管进行检查,用肉眼观察期浑浊度,以此来判断有无菌生长;对照管中菌呈现浑浊状生长,溶液开始出现澄清的最低浓度确定为样品的MIC值。
1.2.5.3 最小杀菌浓度(MBC)的测定 自样品浓度高于MIC值(包括MIC浓度)的试管中各吸取100 μL混悬液分别滴加到灭菌的平板培养基上,涂布均匀,培养箱中37 ℃培养24 h,肉眼观察结果,菌落数小于5个或无菌落生长的最低样品浓度确定为MBC值。
2 结果与讨论
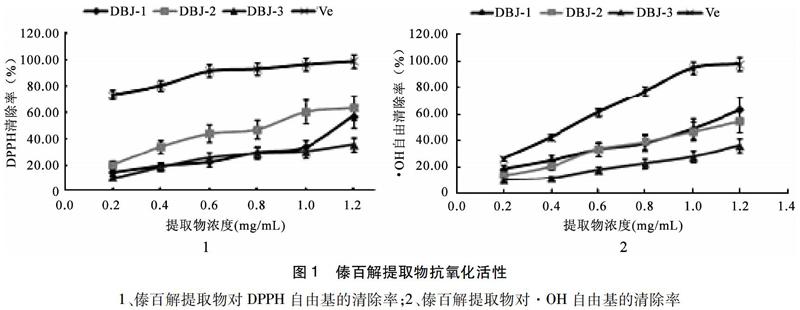
2.1 傣百解提取物具有清除DPPH自由基和·OH自由基的活性 傣百解提取物抗氧化活性研究的结果显示:随着提取物浓度的升高,对DPPH自由基和·OH自由基的清除率逐渐升高,具有浓度依赖性。由下图结果显示,傣百解不同极性提取物对两种自由基的清楚能力依次为DBJ-2>DBJ-1>DBJ-3。三者对DPPH自由基的IC50分别为1.34 mg/mL、075 mg/mL和2.55 mg/mL;对·OH的IC50分别为1.09 mg/mL、0.98 mg/mL和2.15 mg/mL,相同质量浓度条件下,对DPPH自由基的清除率由于羟基自由基。见图1。
2.2.1 滤纸片法检测傣百解提取物对大肠杆菌和绿脓假单胞菌抑菌圈的大小 大肠杆菌和绿脓假单胞菌均为临床常见条件致病菌,可引起皮肤、肠道等部位的疾病。由表1结果显示,傣百解不同极性提取物对大肠杆菌和绿脓假单胞菌的生长均具有抑制作用,抑菌强弱顺序为:DBJ-2>DBJ-1>DBJ-3,DBJ-2显示了较强的抑菌活性,对EC.和Pa.的抑菌圈分别(2.79±0.10)cm和(1.89±0.06)cm,各个极性部位对大肠杆菌的抑菌效果优于对绿脓假单胞菌的抑制作用。见表1。
2.2.2 傣百解提取物对大肠杆菌和绿脓假单胞菌的最小抑菌浓度(MIC) 最小抑菌浓度越小,说明药物的抗菌活性越强。表2实验结果显示:在设定的浓度范围内,不同极性傣百解提取物均检测出最小抑菌浓度,对大肠杆菌的最小抑菌浓度分别为0.391 mg/mL、0.195 mg/mL和1.563 mg/mL;對绿脓假单胞菌的最小抑菌浓度分别为3.125 mg/mL、0.781 mg/mL和6.250 mg/mL。说明不同极性提取物对大肠杆菌敏感性由于绿脓假单胞菌,抑菌活性最强的为正丁醇萃取物(DBJ-2)。见表2。
2.2.3 傣百解提取物对大肠杆菌和绿脓假单胞菌的最小杀菌浓度(MBC) 在检测了抑菌圈和最小抑菌浓度的基础上,检测了3种提取物对两种细菌的最小杀菌浓度,由表3结果显示:三种提取物均检测出对大肠杆菌的最小杀菌浓度,而只有DBJ-2检测出对绿脓假单胞菌的最小杀菌浓度。说明傣百解提取物对大肠杆菌的杀菌效果优于绿脓假单胞菌。见表3。
3 小结
现代研究结果表明,自由基堆积引起的氧化应激和线粒体损伤是肝损伤的重要原因。在病理状态下,自由基产生或多或清除过慢,则可引起细胞生物膜上的脂质过氧化和蛋白质、核算变形,造成生物体损害,甚至加速机体的衰老和死亡[14]。傣百解在临床和民间主要用于肝保护和解酒,通过本研究,理论上为傣百解开发成解酒保肝药物奠定了重要的理论基础。
感染性疾病在临床上很普遍,是各科医生经常面临的问题。但是,目前对感染性疾病的诊治也较普遍地存在着误区,使得临床中的感染问题变得愈发复杂和严重[15]。现代研究表明,中药中的很多次生代谢产物具有显著的抑菌活性。本项目依据傣百解民间用于治疗皮肤疾病的应用历史,选取大肠杆菌和绿脓假单胞菌为指示菌株,进行抑菌圈、最小抑菌浓度和最小杀菌浓度的检测。实验结果显示:傣百解提取物具有较好的抑菌活性,且对大肠杆菌的抑菌作用优于对绿脓假单胞菌的抑制作用。
通过研究,为傣百解健康产品和辅助治疗的药品开发奠定理论基础,为傣百解的推广提供支持。
参考文献:
[1]中国科学院昆明植物所.云南植物志[M].北京:科学出版社,1983:657.
[2]林艳芳,依专,赵映红.中国傣医药彩色图谱[M].昆明:云南民族出版社,2000:397.
[3]李晓花,李海涛,金玲钰,等.傣百解体外细胞毒活性评价及其化学成分预实验[J].中国现代中药,2017,19(4):529-532.
[4]李晓花,李海涛,金玲钰,等.傣百解提取物对人肺癌A549裸鼠移植瘤的影响[J].中国实验方剂学杂志,2017,23(2):104-108.
[5]李松梅,夏杰,张贵华,等.傣百解醇提物调控趋化素表达发挥对非酒精性脂肪肝大鼠治疗作用[J].药物评价研究,2018,41(11):1976-1980.
[6]PANG X,KANG LP,FANG XM,et al.Polyoxypregnane Glycosides from the roots of Marsdenia tenacissima and Their Anti-HIV Activities.Planta Med.,2017,83(1-02):126-134.
[7]廖矛川,张雨馨,陈凤,等.傣百解化学成分研究[J].中南民族大学学报(自然科学版),2016,35(3):39-41.
[8]PANG X,KANG LP,YU HS,et al.New polyoxypregnane glycosides from the roots of Marsdenia tenacissima.Steroids,2015,93:68-76.
[9]TU Y,ZHU S,WANG J,et al.Natural compounds in the chemoprevention of alcoholic liver disease[J].Phytother Res,2019,33(9):1-21.
[10]YANG J,WANG B,ZHANG CF et al.A C21-Steroidal Glycoside from Cynanchum atratum Attenuates Concanavalin A-Induced Liver Injury in Mice[J].Molecules(Basel,Switzerland),2019,24(6):1087-1100.
[11]徐曼,汪詠梅,张亮亮,等.化香果提取物体外抑菌活性研究[J].生物质化学工程,2020,54(2):15-20.
[12]高欣妍,王海英,刘志明.桑叶乙醇提取物的体外抗氧化与抑菌活性[J].生物质化学工程,2019,53(2):35-40.
[13]陈石梅,黄比翼,黄锁义.草果醇提物不同极性部位的体外抗氧化活性研究[J].中国药房,2020,31(8):953-956.
[14]解温品,秦士新.自由基医学研究进展[J].中华损伤与修复杂志(电子版),2012,7(2):194-196.
[15]刘洁,杨晶.感染性疾病病原体二代测序应用进展[J].中华医院感染学杂志,2020(13):2076-2080.
(收稿日期:2021-01-27)
