进水亚硝氮限制下Anammox去除氨氮研究
2021-08-09牛晚霞袁林江有小龙牛泽栋西安建筑科技大学陕西省环境工程重点实验室西北水资源与环境生态教育部重点实验室陕西西安710055
牛晚霞,袁林江,有小龙,牛泽栋 (西安建筑科技大学,陕西省环境工程重点实验室,西北水资源与环境生态教育部重点实验室,陕西 西安 710055)
与传统生物脱氮技术相比,厌氧氨氧化(Anammox)因不需要曝气、不需要有机碳源、污泥产量低等明显优势,被公认是一种效率高、能耗低的生物脱氮处理技术[1-3].相关研究[4]提出Anammox反应中氨氮去除量与亚硝氮去除量以及硝氮产生量之间(ΔNH4+-N/ΔNO2--N/ΔNO3--N)的理论比值为1:1.32:0.26.由 于 AnAOB(Anaerobic ammonium oxidation bacteria)很难进行纯培养,当 Anammox体系中存在异养型亚硝酸盐氧化菌或反硝化菌时,利用微生物内碳源消耗部分亚硝氮,使 ΔNO2--N/ΔNH4+-N大于1.32[5].然而,有许多Anammox研究[6-8]得到ΔNO2--N/ΔNH4+-N小于1.32,即氨氮被超量去除.且当进水中亚硝氮供给比例减少时,Anammox反应器会出现氨氮相对更多的去除[9].
在 Anammox体系中通过研究氨氮和硫酸盐转化途径时发现在NO2-缺失且 SO42-未被去除的情况下,NH4+就能稳定去除,认为该体系中氨氮的去除存在其他未知的电子受体[10].有研究[11]根据Anammox化学模型,从化学平衡移动的角度对此进行了分析,但对其中微生物机理尚不清楚.减少进水NO2--N进行厌氧氨氧化脱氮,可减少废水中亚硝化过程、且还能保证废水中氨态氮的去除量,对污水脱氮处理具有重要实用价值.
本研究设计了一系列批式实验,探究了Anammox反应器中氨氮超量去除方式以及超量去除氨氮量的限制性因素,同时结合微生物菌群解析对氨氮去除的代谢途径进行分析,旨在为厌氧氨氧化直接脱除水中氨态氮技术开发奠定基础.
1 材料与方法
1.1 反应器实验装置及进水水质
实验采用有机玻璃制作的 UASB反应器(图1),有效体积 6.28L,总体积10.5L.反应器内侧柱高114.4cm,直径100mm,壁厚5mm,外侧为32℃水浴保温层,厚 10mm;在保温层外包裹铝箔纸进行隔光,进水由蠕动泵打入反应器底部.实验开始前,该反应器在室温条件下饥饿放置 120d后提供基质短期恢复为氮去除负荷达 1.3kgN/(m3·d)并稳定运行.
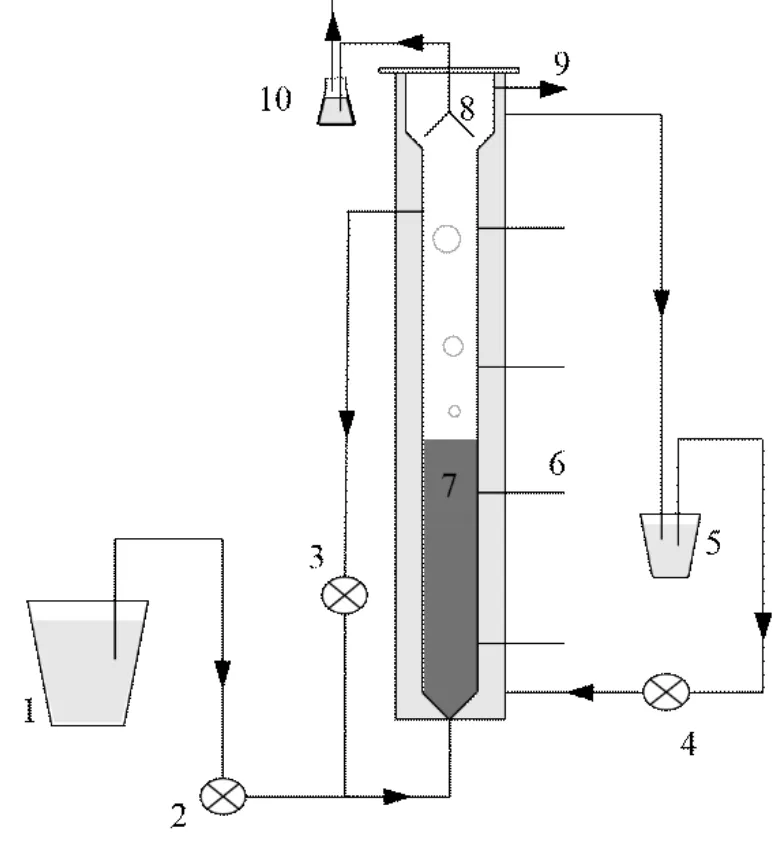
图1 Anammox-UASB装置示意Fig.1 Schematic diagram of the Anammox-UASB reactor
实验采用人工配制进水,配水成分为:KHCO31250mg/L,KH2PO427.2mg/L,MgCL2·6H2O 165mg/L,CaCl2·2H2O 250mg/L,微量元素Ⅰ 1mL/L,微量元素Ⅱ 2mL/L,NH4+-N和NO2--N分别以NH4Cl、NaNO2按需提供,SO42-由 Na2SO4提供,投加浓度为342.3mg/L.各阶段主要进水基质如表 1所示.利用1mol/L的HCl调节pH值为(7.5±0.2),水力停留时间(HRT)为20h.
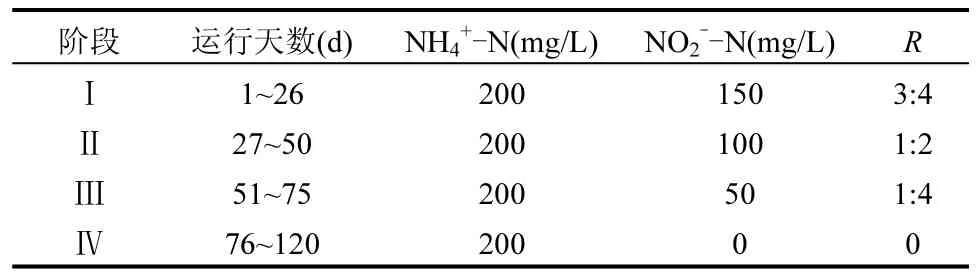
表1 各阶段主要进水基质Table 1 Components of influent
1.2 批式实验装置及运行条件
据实验需求,在反应器的不同阶段,从反应器中分别取10mL泥水混合物倒入50mL离心管,用磷酸盐缓冲溶液(PBS)洗涤2~3次,然后将清洗后的污泥和120mL配制好的基质(基质提前曝高纯氮气除氧20min),倒入总容积为 130mL的血清瓶,后利用高纯氮气对血清瓶中泥水进行除氧5min,将其密闭后置于恒温振荡器(150r/min,35℃)进行反应.在验证Fe3+与氨氮超量去除的关系时,主要基质为NH4+,取样间隔为 12h;验证内碳源反硝化与氨氮超量去除的关系时,主要基质为 NH4+和 NO3-,每隔 24h取一次样;验证DO与氨氮超量去除的关系时,主要基质为 NH4+,每隔 24h取一次样.其他配水元素与反应器进水相同.
为提高实验代表性,批式实验均设 3组平行.为保证血清瓶内厌氧环境,每次用注满氮气的注射器取样,且平行组取样体积保持一致.取样后用0.22μm有机滤头过滤后测定相关指标.
1.3 分析方法
常规指标的测试方法参考《水和废水监测分析方法》[12]:pH值采用PHS-3S型pH计测定;DO采用MO128-2M型便携式溶解氧仪测定;硝酸盐氮采用紫外分光光度法和离子色谱法;亚硝酸盐氮采用N-(1-萘基)-乙二胺光度法;氨氮采用纳氏试剂分光光度法;硫酸盐采用 ICS1100离子色谱仪;总铁采用火焰原子吸收法.
污泥微生物群落结构分析采用基于 Illumina MiSeq测序平台的细菌16S rDNA高通量测序技术.测序流程包括微生物总DNA 提取、目标片段 PCR扩增、扩增产物回收纯化、扩增产物荧光定量、MiSeq文库构建和MiSeq测序[13-14].其中PCR 扩增采用的引物为Miseq测序平台的V3-V4通用引物341F(5’-CCTACGGGNGGCWG-CAG-3’)和 805R(5’-GACTACHVGGGTATCTAATCC-3’).Miseq 测序得到的PE reads首先根据overlap关系进行拼接,同时对序列质量进行质控和过滤,区分样本后进行OUT聚类分析和物种分类学分析.以上工作均由生工生物工程(上海)股份有限公司完成.
2 结果与讨论
2.1 不同亚硝氮浓度供给条件下Anammox反应器运行特性
2.1.1 氨氮、亚硝氮及硝氮变化规律 阶段Ⅰ~Ⅰ逐步减小 R(降低进水亚硝氮浓度)条件下,反应器氨氮、亚硝氮及硝氮变化情况如图2所示.阶段Ⅰ投加NH4+-N为200mg/L,R为3:4,氨氮平均去除率为81%,亚硝氮去除率始终接近 100%,硝氮平均产生量为30.8mg/L.阶段Ⅱ保持 NH4+-N浓度不变,调整 R为1:2,此时氨氮平均去除率为 74.2%,亚硝氮依然没有剩余,硝氮平均产生量为 17.7mg/L.阶段Ⅲ继续减小R为1:4,氨氮平均去除率为45.2%,出水检测到极少量亚硝氮,硝氮平均产生量为6.6mg/L.阶段Ⅰ对反、应器停供亚硝氮,R=0,连续运行了 45d,停供亚硝氮后氨氮仍有去除,平均去除率为 22.5%,出水监测到少量的亚硝氮,无硝氮产生.从阶段Ⅰ至阶段Ⅰ,随进水NO2-浓度的降低,氨氮去除率由81%降至22.5%.因为较低浓度的亚硝氮不会对Anammox系统造成毒性抑制,故氨氮去除率降低是由于电子受体的减少.Jetten等[15]指出厌氧氨氧化过程中产生少量的硝氮,因此,硝氮的产量在一定程度上反映了反应器内厌氧氨氧化反应的情况.随进水 NO2-浓度的降低,硝氮产量从 30.8mg/L最后降至 0,说明厌氧氨氧化反应越来越弱.
2.1.2 Anammox反应化学计量比及 pH值变化规律 反应器中 ΔNH4+-N/ΔNO2--N,ΔNH4+-N/ΔNO3--N值对系统中厌氧氨氧化反应以及其它反应可能性的程度具有指导意义.逐步降低进水亚硝氮浓度条件下,如图 3(a)所示,当 R 为 3:4 时,ΔNO2--N/ΔNH4+-N平均比值为0.96;当R为1:2时,ΔNO2--N/ΔNH4+-N平均比值为 0.76;当 R为 1:4时,ΔNO2--N/ΔNH4+-N平均比值为 0.58.可见 ΔNO2--N/ΔNH4+-N 均小于厌氧氨氧化理论值1.32,说明氨氮实际去除量大于厌氧氨氧化反应理论去除量,即存在氨氮超量去除现象[7,16-17].图 2(c)显示了硝态氮实际产生量与理论产生量之间的差异,阶段Ⅰ到阶段Ⅲ,硝态氮实际产量平均值分别为 30.77,17.7,6.62mg/L,而根据厌氧氨氧化反应理论比值衡算硝态氮理论产量平均值分别为32.26,20.7,10.48mg/L,可见硝态氮实际产生量均小于理论产生量.此外,由图 3(a)可知,从阶段Ⅰ到Ⅲ,ΔNO3--N/ ΔNH4+-N 平均值分别为0.18、0.13、0.07,随 R的降低而减小,且均小于厌氧氨氧化理论值0.26.造成这种现象的原因除了氨氮超量去除,还有另一种可能是厌氧氨氧化生成的硝态氮被部分消耗,这与硝态氮实际产量总是小于理论产量相吻合,说明反应器内存在某种消耗硝态氮的反应.
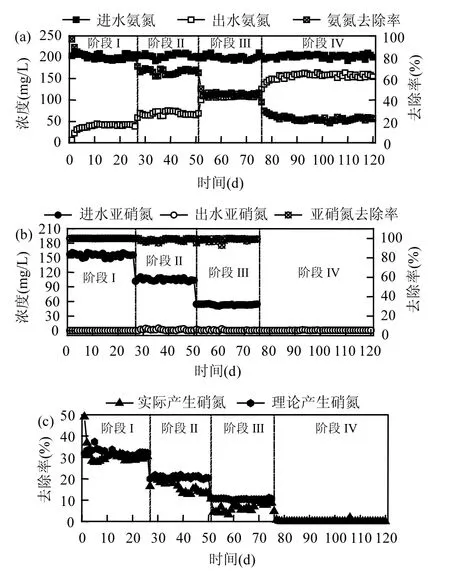
图2 限NO2-厌氧氨氧化反应器运行状况Fig.2 Performance of Anammox reactor with less nitrite
降低进水亚硝氮浓度过程中,反应器进出水 pH值变化如图3(b)所示.阶段Ⅰ初始,反应器出水pH值高于进水,从阶段Ⅰ末至阶段Ⅰ,出水 pH 值均低于进水.单纯厌氧氨氧化反应是一个产碱的过程,而反应器出水pH值低于进水,可以判断氨氮超量去除途径是一个pH值降低的过程.

图3 限NO2-厌氧氨氧化反应器ΔNO2--N/ΔNH4+-N,ΔNO3--N/ΔNH4+-N和进出水pH值变化Fig.3 ΔNO2--N/ΔNH4+-N,ΔNO3--N/ΔNH4+-N variation and pH value of Anammox reactor with less nitrite
2.2 氨氮超量去除的可能途径
有研究在逐渐提高进水氨氮浓度且体系中始终供给亚硝氮条件下,出现的氨氮超量去除,认为氨氮过量供给使得 Anammox反应化学平衡向生成N2H4的方向移动,表现为Anammox体系对氨氮的额外吸纳现象[11].而本研究中始终保持进水氨氮浓度一定、逐渐降低进水亚硝氮浓度直至停供亚硝氮,难以利用该化学平衡说来解释氨氮的超量去除现象.
无机条件下,AnAOB除了利用最佳电子受体亚硝氮外,还会以SO42-为电子受体进行反应[18-19].但是本反应器长期投加 SO42-,并没有 SO42-去除现象(图4),这与刘福鑫[20]研究类似.因此,本研究中 NH4+的超量去除与 SO42-没有明显关系.Bi[10]通过对 NH4+和SO42-同时去除的转化途径研究认为Anammox过程不会以 SO42-为电子受体氧化氨,而是两者各自独立转化.
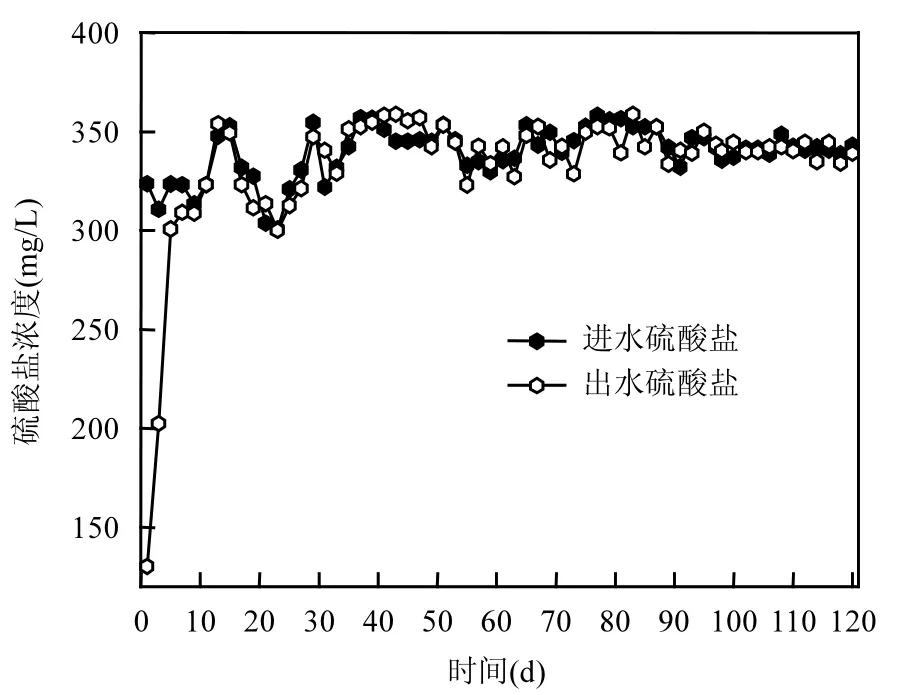
图4 反应器进出水硫酸盐浓度Fig.4 SO42- concentrations in effluent and influent
由于本反应器进水未采取除氧措施,故进水中向系统中引入少量的 DO(进水 DO约 8mg/L),为了验证进水 DO对氨氮超量去除的影响,保持其它条件不变,从 85d开始对反应器进水进行曝氮气除氧,使DO降至2mg/L以下,并将进水桶密封防止进水复氧,连续 10d对进水除氧发现氨氮去除量并未发生明显变化,这与严锋[21]研究结果相同.经计算 6mg/L的DO仅能氧化1.75mg/L的NH4+-N,因此,进水中DO远不足以去除如此多的氨氮.故必然存在其他的电子受体参与氨氮的超量去除.
2.3 氨氮超量去除的转化方式
2.3.1 Fe3+与氨氮超量去除关系 研究表明,亚硝氮缺乏时,Fe3+可以作为电子受体被 AnAOB利用[22-23],由于微生物自身细胞含有 0.02%的铁元素[24].从反应器取适量污泥测定总铁,发现污泥中的铁含量(0.43mg/gVSS)不足以引起氨氮的超量去除.并且研究发现AnAOB体内的铁对其氮代谢途径无显著影响[25-26].由于配水中加入的微量元素Ⅰ也含有铁盐,推测此类物质参与了氨氮的超量氧化.故设计批式实验验证配水中微量元素Ⅰ中Fe3+是否参与了氨氮的超量氧化.
研究认为[27]Fe3+投加量为 0.08mmol/L时,反应器氮去除性能最好,而本研究微量元素Ⅰ中 Fe3+浓度为 0.02mmol/L.因此设置对照实验,确定 B组加4.48mL/L微量元素Ⅰ,A组不加微量元素Ⅰ,两组实验主要基质为氨氮.由图 5可知,前 24h,A组氨氮从44.4mg/L降至 37.7mg/L,B组从 45.2mg/L降至34.8mg/L,在12h监测到A、B两组亚硝氮积累量分别为0.02,0.05mg/L,硝氮积累量分别为2.5, 1.6mg/L.24h至实验结束,A、B组氨氮含量均未发生下降,实验结束时测得 A、B组氨氮浓度分别为 35.4和34.6mg/L.虽然B组下降较快,但与A组相比,实验结束时 B组没有去除更多的氨氮,说明本研究中氨氮的超量去除与铁没有明显相关关系.研究报道[28-29]在厌氧环境下 Fe3+还原氨氧化的现象,而本研究未发现 Fe3+参与氨氮的氧化现象,可能是由于实验条件的不同,有待于进一步研究.

图5 Fe3+与氨氮超量去除关系Fig.5 The relationship between Fe3+ and excess removal of ammonium
2.3.2 内碳源反硝化以及与氨氮超量去除之间的关系 对于反应器中可能存在消耗硝酸盐的反应的问题,设计批式实验探究反应器中是否存在内碳源反硝化.如图 6(a)所示,经 48h反应,硝酸盐浓度从39.6mg/L降至 34.3mg/L,同时检测到2.8mg/L亚硝氮,pH值从7.51升至7.81.
早有 Graaf[30]发现硝酸盐作为间接电子受体与氨氮同步去除.由图 6(b)可知,氨氮和硝氮均匀下降,氨氮由71.25mg/L降至38.77mg/L,硝氮由54.17mg/L降至 11.13mg/L,整个过程未监测到亚硝氮,实验结束体系pH值为8.2,高于初始pH值.

图6 内碳源反硝化与氨氮超量去除之间的关系Fig.6 The relationship between endogenous denitrification and excess removal of ammonium
Waki等[31]认为AnAOB不能直接以NH4+-N和NO3--N作为电子供受体,要使其顺利进行,需要在其他电子供体存在的条件下将NO3--N还原为NO2--N后,进行缓慢的 Anammox反应.该批式实验中氨氮与硝酸盐同步去除,这是由于Anammox反应器内存在少量的反硝化菌[32],无机条件下,异养反硝化菌会利用有限的内碳源将Anammox过程产生的硝酸盐部分还原为亚硝酸盐[33],从而与氨氮发生Anammox反应.亚硝酸盐是 Anammox最适合的电子受体,能够与氨氮在短暂的时间内完全反应[34],这为系统中未监测到亚硝氮提供了依据.由于缺乏碳源,硝酸盐还原为亚硝酸盐过程缓慢,内碳源反硝化过程为氨氮的超量去除提供了一种理论依据.
2.3.3 氨氮超量去除的限制性因素 为了进一步探究氨氮超量去除的原因,只投加氨氮进行批式实验.如图 7所示,初始氨氮浓度为 48.21mg/L,前 24h氨氮降低了13.62mg/L,有少量的亚硝氮和硝氮产生,24~72h氨氮浓度稳定在 35.17mg/L左右,未监测到亚硝氮和硝氮.72h时向系统注入约10mL空气,96h氨氮浓度为 20.24mg/L,同时检测到 4.03mg/L的亚硝氮和2.24mg/L的硝氮,pH值从7.6降至7.29.

图7 溶解氧与氨氮超量去除的关系Fig.7 The relationship between dissolved oxygen and excess removal of ammonium
前 24h,氨氮浓度下降,紧接着又保持不变,说明反应体系中某种物质含量有限.而向系统注入空气后发现氨氮浓度迅速降低,足以说明氨氮的去除与DO有关,认为Anammox体系中存在AOB参与了氨氮的超量去除.将 DO 和氮去除之间关系衡算,系统总氮损失量为 0.61mmol/L,假定总氮都通过厌氧氨氧化方式去除,通过式(1)计算得所需的氨氮、亚硝氮及通过该步骤产生的硝氮含量分别为 0.3,0.39,0.08mmol/L;假定Anammox所需的亚硝氮和反应体系剩余的亚硝氮均由亚硝化所得,通过式(2)计算出该亚硝化过程所需氧气的量为 1.02mmol/L;根据反应体系共产生硝氮的量,得知 0.083mmol/L的硝氮由硝化过程产生,通过式(3)可得该过程所需氧气量为0.17mmol/L.故实验共需氧气量为1.19mmol/L,通过血清瓶中剩余溶液体积(以 80mL计)换算得3.04mg的氧气,再根据氧气质量分数及实验温度下空气密度(25℃.1.184mg/mL)计算出实验所需空气量为 11.15mL,接近于注入的 10mL空气.因此,该批式实验中氨氮是通过AOB和AnAOB共同去除的.

前文已经证实反应器进水中DO的量不足以去除反应器中氨氮超量去除的量,但批式实验说明氨氮的去除必与氧气有关,故存在其它 DO渗入反应器的途径.UASB回流过程会把部分带有DO的出水重新带到反应器底部,同时回流过程会造成三相分离器空间变化引起内外气压差,使得外界空气更容易进入反应器[35].
除了以上原因,还有报道称[36-37]微生物代谢过程能够产生活性氧类物质,形成超氧自由基(O2-)和羟基自由基(OH⋅),在缺乏亚硝氮的Anammox反应器中,微生物抑制或腐烂过程同样释放出 OH⋅等氧化剂,这些自由基也是氨氮超量氧化的潜在电子受体来源[38].甚至有研究[20]认为亚硝氮缺乏时,HCO3-作为电子受体氧化了氨氮,NH4+和 HCO3-之间发生的是生物反应.但这些报道只是理论推测,还需进一步研究.
2.4 污泥微生物菌群解析
反应器中氮素的脱除是微生物作用的结果,通过高通量测序进行微生物群落结构的解析能够更进一步对氨氮去除的代谢途径进行预测分析.分别在 R为3:4运行末期和停供亚硝氮后运行45d从反应器取2个污泥样品,分别记为A2、A4,进行高通量测序.如表2所示,两个样本的Coverage指数均为 100%,说明测序结果足够代表样本中的微生物群落组成.ACE和Chao指数[39]均有所增大,说明从进水供少量亚硝氮阶段到停供亚硝氮阶段,物种总数在增多.Simpson指数越大,说明优势菌群占总体生物菌群比例越大[40];Shannon[41-42]指数越高,群落复杂程度越大.停供亚硝氮后微生物多样性在增加,说明停供亚硝氮后氨氮的去除需要更多类型的微生物共同完成.
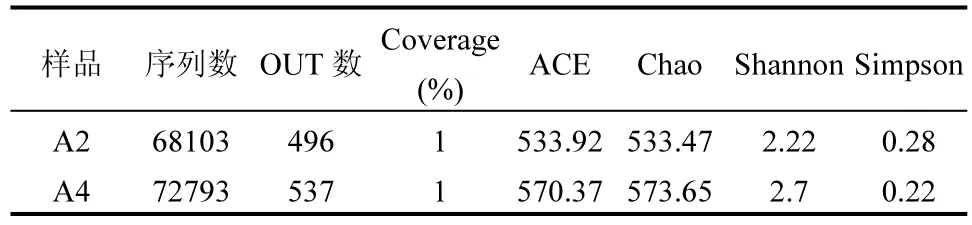
表2 污泥样品Alpha多样性Table 2 Alpha diversity of the two samples
利用高通量测序技术分别考察了反应器 R为3:4和停供亚硝氮两个阶段污泥在属水平上的微生物菌群结构,如图8所示,在限亚硝氮和停供亚硝氮2个阶段微生物群落中,厌氧氨氧化菌、好氧氨氧化菌、反硝化菌和亚硝酸盐氧化菌同时存在.Anammox体系中停供亚硝氮前后亚硝化单胞菌属(Nitrosomonas)相对丰度从 3.29%增长到 7.3%,虽然Anammox体系为厌氧环境,但Nitrosomonas被认为是需氧氧化铵[43],说明反应器内部确实存在外界氧气渗入的可能,这与2.3.3讨论相吻合.检测到的反硝化菌属主要为Ignavibacterium,其相对丰度由0.54%增加到 3.14%, Ignavibacterium能够利用细菌衰老和死亡的细胞产物进行厌氧发酵和反硝化作用[44].
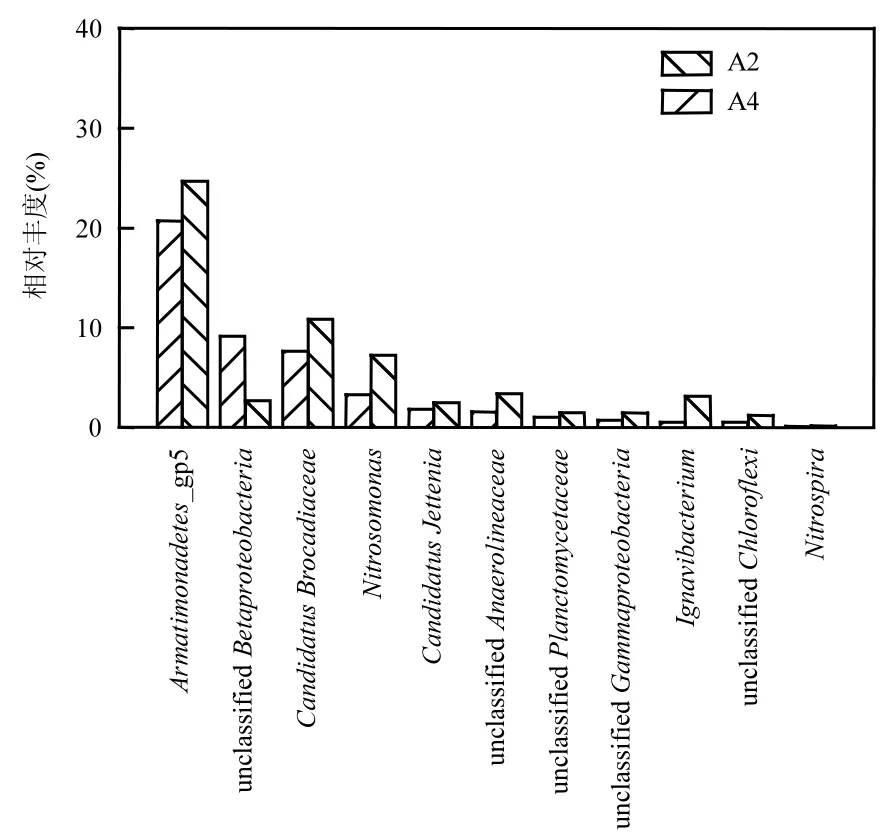
图8 NO2--N/NH4+-N为3:4和停供亚硝氮2阶段主要脱氮细菌(属)组成变化Fig.8 Microbial community for nitrogen removal in the reactor NO2--N/NH4+-N is 3:4 and after no feeding of nitrite
停供亚硝氮后Candidatus_Brocadiaceae属有所增长,相对丰度由 7.67%增长到 10.83%,而Candidatus_Jettenia属无明显变化,这是由于氨氧化菌将部分氨氮氧化为亚硝氮,反硝化菌将部分硝酸盐还原为亚硝氮,为AnAOB供应了极少量的亚硝氮,说明Candidatus_Brocadiaceae能够适应极低亚硝氮环境并生长繁殖,Candidatus_Jettenia也能够在此环境中生存.反应器从 R为 3:4到停供亚硝氮阶段,Armatimonadetes_gp5相对丰度由 20.7%增长到24.6%,Mi等[45]认为Armatimonadetes_gp5是一种适合在低氨氮浓度下生存的新型厌氧氨氧化菌.两个污泥样品中还检测到极少量的亚硝酸盐氧化菌属(Nitrospira),约占总细菌的0.1%,Nitrospira未增长说明不适合在该环境中生长.
不管是反应器R为3:4还是停供亚硝氮,超量去除的这部分氨氮均由氨氧化菌、厌氧氨氧化菌和反硝化菌共同完成.主要有两种途径:一是在微量 DO的作用下,氨氧化菌将部分氨氮氧化为亚硝氮,AnAOB再将该部分亚硝氮与剩余的氨氮去除;二是Anammox产生的硝氮有一部分被反硝化菌经内碳源反硝化作用还原为亚硝氮,该部分亚硝氮与体系中其余的氨氮也通过Anammox作用去除.
2.5 反应器中氨氮超量去除量变化规律
由图9可知,从阶段Ⅰ到阶段Ⅰ,当R为3:4时,超量去除氨氮量均值为45.5mg/L;当R为1:2时,均值为 57.2mg/L;而当 R为 1:4时,其均值为 52mg/L;当R为0时,均值为45.5mg/L.可见,当R从3:4减小为1:2时,超量去除氨氮的量有所增加;而当R从1:2降至 0时,超量去除氨氮的量缓慢减少;当 R为 1:2时,超量去除氨氮的量最大.

图9 限NO2-厌氧氨氧化反应器氨氮超量去除量Fig.9 Excess removal of ammonium in the Anammox reactor with less nitrite
由前文可知,氨氧化菌在氨氮超量去除中起着关键的作用.阶段Ⅰ(R为 3:4)进水亚硝氮浓度为150mg/L,污泥层的亚硝酸盐浓度较高可能会对氨氧化菌活性造成抑制,氨氧化速率较低,使得氨氮超量去除量较低.而R小于1:2时,反应器中厌氧氨氧化菌可利用的基质已相对较少,反应器中氮的去除主要由氨氧化协同厌氧氨氧化菌完成,由于Anammox过程产生的碱度已相对较少,体系中 pH值下降较多(图 3b).并且,通过数据核算了各阶段稳定后硝酸盐实际生成量与理论生成量的差值(图 2c),在 R等于3:4(17~27d稳定)时为1mg/L,在R等于1:2时(39~50d稳定)为 6.7mg/L,在 R等于 1:4时(65~75d稳定)为2.7mg/L,而在不投加亚硝酸盐后,以亚硝酸盐计的硝酸盐生成量降低为0.可推测反硝化菌在各阶段所起作用的程度大小,在R等于1:2时硝酸盐实际生成量与理论生成量的差值最大.所以本文在R等于1:2时氨氮超量去除量达最大.
3 结论
3.1 当 Anammox体系中进水 R(NO2--N/NH4+-N)由理论比值1.32减小为1:2时,氨氮超量去除量增加;而当R由1:2减小至1:4时,氨氮超量去除量保持稳定.当R为1:2时,氨氮超量去除量最大,为57.2mg/L.批式实验证明溶解氧是氨氮超量去除量的限制性因素.
3.2 当 Anammox体系长期停供亚硝氮时,氨氮依然得以脱除且 SO42-并未去除,无证据表明本Anammox体系能够利用硫酸盐为电子受体氧化氨氮.此外,停供亚硝氮后 Anammox体系中微生物群落多样性有所增加,AnAOB、氨氧化菌(Nitrosomonas)和反硝化菌(Ignavibacterium)相对丰度均增加,氨氧化菌在微量 DO作用下将部分氨氮氧化为亚硝氮,AnAOB将与之协同实现氮的去除.Candidatus Jettenia属和Candidatus Brocadia属都能够在亚硝氮缺失的条件下进行氮的脱除.
3.3 本Anammox体系中氨氮超量去除的途径包括好氧氨氧化、Anammox与部分异养反硝化.参与上述生化反应的微生物有氨氧化菌、厌氧氨氧化菌和反硝化菌.
