海南岛黎母山国家自然保护区热带云雾林土壤酶活性的根际效应
2021-08-09涂志华周凌峰黄艳萍陈夙怡陈金辉李胜男
涂志华, 周凌峰, 黄艳萍, 陈夙怡, 陈金辉, 李胜男
(1.海南大学 林学院 热带特色林木花卉遗传与种质创新教育部重点实验室, 海南 海口 570228;2.海南省热带珍稀名贵树种工程研究中心, 海南 海口 570228; 3.海南五指山森林生态系统国家定位观测研究站, 海南 海口 570228; 4.海南省建设项目规划设计研究院有限公司, 海南 海口 570203)
德国微生物学家Lorenz Hiltner于1904年提出根际(rhizosphere)是指植物根系周围距根系表面数毫米的微土壤区域,受根系活动强烈影响[1-3],是根系—土壤—微生物三者相互作用围绕根系进行生物地球化学循环最活跃的区域[4-6]。植物根系分泌物及根系凋落物持续输入根际土壤,改变根际区营养环境,根际土壤生物学特征区别于非根际土壤,存在明显的“根际效应”[7-9]。研究表明,根际土壤酶作为根际效应重要的驱动者,影响根际养分转化与利用[3-4,10]。土壤酶作为土壤中的生物催化剂,是土壤生物化学过程中的重要参与者,直接影响着土壤生态系统的物质循环和能量流动[11-12]。土壤酶调节有机质的分解,是评价土壤质量变化的重要生物指标之一[10-12],其活性与土壤物理生物化学性质及水热条件密切相关[12-13],对环境变化比较敏感,不同植被类型其季节动态特征具有很大差异[13-14]。因此,开展土壤酶活性及其根际效应对认识区域土壤质量变化以及土壤酶介导的根际生态过程具有重要意义。
热带云雾林是陆地生态系统热带森林的重要组成部分,仅占世界热带森林面积的2.5%,具有生物多样性价值高,保持水土、涵养水源等重要生态服务功能[15-16],在维持全球碳氮平衡和应对气候变化等方面都发挥重要的作用[17]。海南岛热带云雾林主要分布在海拔1 200 m以上的林区,常被云雾萦绕且土壤含水量常处于饱和状态[18],是海南中西部地区重要的水源涵养区。该区域热带云雾林是水生态安全的重要保障,随着水环境安全问题的重视,从土壤酶学角度分析热带云雾林不同植被发挥水土保持功能对认识如何提升水源涵养林的生态功能保护和建设具有重要意义。近年来,针对海南云雾林的研究主要集中在群落结构特征、环境特征、植物多样性、植物功能性状分异规律、植物叶片养分特征等方面开展研究[18-21],而对根际土壤酶如何介导根际生态过程中养分循环与转化的作用鲜见报道,制约着热带云雾林发挥保育土壤、水源涵养功能的准确评估。因此,本研究以海南岛黎母山林区热带云雾林为研究对象,分析岭南青冈、罗浮锥、细枝柃3种主要优势树种根际与非根际土壤酶活性差异及其季节动态变化特征,探讨土壤酶活性季节变化的影响因子,以期更加深入揭示热带云雾林土壤酶在根际生态过程中碳、氮养分循环机制中的作用,为准确评估热带云雾林发挥保育土壤、水源涵养功能及区域水源涵养林管理和建设提供依据。
1 材料与方法
1.1 研究区概况
研究区位于海南黎母山国家自然保护区(109°39′05″—109°48′31″E,19°07′22″—19°14′03″N),是海南岛保存较好的热带原始林地区之一,该区属于热带海洋季风气候,四季不明显气候,终年温暖湿润,雨量充沛。主峰黎母岭海拔1 411.7 m。区内年平均气温23.1 ℃,年平均降雨量为2 343.1 mm,年平均相对湿度84%,平均年蒸发量为1 617.8 mm。土壤类型主要为砖红壤、赤红壤和山地黄壤。区域内植物资源丰富,野生维管植物190科759属1 490种。在保护区内热带云雾林内各布设3块50 m×50 m样地(109°45′58″—109°46′00″E,19°10′58″—19°11′07″N),海拔为1 340~1 350 m,样地土壤类型为山地黄壤,优势树种主要有:岭南青冈(Cyclobalanopsischampionii),罗浮锥(Castanopsisfabri),细枝柃(Euryaloquaiana)[20]。
1.2 样品采集
在样地内每个优势树种(岭南青冈、罗浮锥、细枝柃)选择标准木5株,根际土壤样品采集采用抖落法[22],具体方法:除去地表枯落物,挖取有主根及须根的土体,先轻轻抖落不含根系的大块土壤,用小刀刮下附着在根系周围的土壤为非根际土壤(non-rhizosphere soil,用S表示);用毛刷收集经抖落后依然黏附在根系周围的土壤(0—5 mm)为根际土即(rhizosphere soil,用R表示),将收集的根际土与非根际土充分混匀并装入无菌自封袋内。新鲜土壤样品分两份,一份放置于装有冰袋的保温箱内,立即带回实验室,用于测定土壤酶活性;另一份带回实验室后风干,过筛用于测定土壤理化性质。样品采集时间为2019年2—12月,每月采集样品一次,每次取样在每个样地相同的样点进行,即在前一次采样点附近取样,尽量保持土壤样本的一致性。
1.3 分析测定
土壤化学性质采用鲁如坤的分析方法[23],土壤含水量采用105 ℃烘干恒重法测定,土壤有机碳含量用重铬酸钾外加热氧化法测定,土壤全氮用凯氏定氮法测定,速效氮碱解扩散法法,土壤全磷、速效磷采用钼锑抗比色法,全钾、速效钾采用火焰光度计法。土壤酶活性采用关松荫的分析方法[24]。土壤蔗糖酶活性采用3,5-二硝基水杨酸比色法测定,以24 h后1 g土壤生成葡萄糖毫克数表示〔mg/(g·d)〕;土壤脲酶活性采用苯酚钠—次氯酸钠比色法测定,以24 h后1 g土壤中NH3-N的毫克数表示〔mg/(g·d)〕;土壤过氧化氢酶活性采用高锰酸钾滴定法测定,以1 g土壤消耗0.1 mol/L KMnO4的毫升数表示〔mL/(g·h)〕;土壤酸性磷酸酶采用磷酸苯二钠比色法测定,以24 h后1 g土壤释放酚的毫克数表示〔mg/(g·d)〕。
土壤酶根际效应(rhizosphere effect,RE)采用如下公式进行分析:
RE=〔(根际土壤含量—非根际土壤含量)/
非根际土壤含量〕×100%
根际效应可反映植物根际酶活性富集效应的强弱,RE>0为根际正效应,RE<0为根际负效应。
1.4 数据分析
利用SPSS 18.0软件进行数据统计分析,采用单因素方差分析不同优势树种土壤蔗糖酶、脲酶、过氧化氢酶、酸性磷酸酶含量以及根际效应的差异显著性,并利用最小显著差异法(LSD)进行多重比较分析(α=0.05),采用Origin 8.0软件制图。
2 结果与分析
2.1 土壤蔗糖酶活性季节动态变化
岭南青冈、罗浮锥、细枝柃根际与根际土壤蔗糖酶活性的动态变化明显,2—7月逐渐增大,8月达到峰值,而后9—12月逐渐降低,均呈现单峰型曲线变化趋势,动态变化显著(p<0.05)(图1)。

注:图中不同小写字母表示同一时间不同树种之间差异显著(p<0.05)。下同。
如图1所示,在5—10月岭南青冈、罗浮锥、细枝柃差异显著;而在2,3,4,11,12月,岭南青冈、罗浮锥差异不显著,但显著大于细枝柃。不同树种根际土壤蔗糖酶活性存在显著差异(p<0.05)。岭南青冈、罗浮锥、细枝柃根际土壤蔗糖酶活性动态变幅分别为:33.82~79.73,32.61~77.06,30.20~64.39 mg/(g·d),其均值表现为:岭南青冈〔51.49±15.76 mg/(g·d)〕>罗浮锥〔48.34±14.98 mg/(g·d)〕>细枝柃〔42.45±12.35 mg/(g·d)〕,岭南青冈显著大于细枝柃(p<0.05)。3个树种根际土壤蔗糖酶活性均显著高于非根际(p<0.05),不同月份动态变化中,岭南青冈、罗浮锥、细枝柃非根际土壤蔗糖酶活性变幅分别为27.27~65.21,26.45~63.53,23.71~56.86 mg/(g·d),其根际比变幅分别为:1.05~1.26,1.08~1.29,1.10~1.33。
2.2 土壤脲酶活性季节动态变化
岭南青冈、罗浮锥、细枝柃根际与非根际土壤脲酶活性的动态变化趋势与土壤蔗糖酶活性相似,从2月始逐渐增大,8月上升至峰值后逐渐下降,均呈现单峰型变化,月际动态变化显著(p<0.05)(图2)。不同树种根际土壤脲酶活性月份变幅分别为1.01~2.54,0.99~2.50,0.60~2.05 mg/(g·d),最大值分别为最小值的2.51,2.52,3.11倍;其均值表现为:岭南青冈〔1.48±0.53 mg/(g·d)〕>罗浮锥〔1.43±0.50 mg/(g·d)〕>细枝柃〔1.09±0.48 mg/(g·d)〕,岭南青冈与罗浮锥差异不显著,但显著大于细枝柃(p<0.05),分别是罗浮锥、细枝柃的1.03,1.36倍。3个树种根际土壤脲酶活性均显著高于非根际(p<0.05),不同月份动态变化中,岭南青冈、罗浮锥、细枝柃非根际土壤脲酶活性变幅分别为0.48~1.83,0.45~1.81,0.28~1.70 mg/(g·d),其根际比变幅分别为:1.39~2.10,1.38~2.21,1.20~2.15。

图2 海南岛黎母山热带云雾林根际与非根际土壤脲酶活性动态变化
2.3 土壤过氧化氢酶酶活性季节动态变化
岭南青冈、罗浮锥、细枝柃根际与非根际土壤过氧化氢酶活性的动态变化呈现单峰型变化,月份动态变化显著(p<0.05)(图3),从2月开始逐渐增大,8月上升至峰值后逐渐下降。不同树种根际土壤过氧化氢酶活性月际变幅分别为16.08~33.19,16.07~31.69,8.44~24.20 ml/(g·h);其均值表现为:岭南青冈〔22.65±5.81 ml/(g·h)〕>罗浮锥〔21.50±5.43 ml/(g·h)〕>细枝柃〔13.99±5.45 ml/(g·h)〕,岭南青冈与罗浮锥差异不显著,但显著大于细枝柃(p<0.05),分别是罗浮锥、细枝柃的1.05,1.62倍。3个树种根际土壤过氧化氢酶活性均显著高于非根际(p<0.05),不同月份动态变化中,岭南青冈、罗浮锥、细枝柃非根际土壤过氧化氢酶活性变幅分别为9.45~19.60,8.71~19.17,6.79~16.75 ml/(g·h),其根际比分别为:1.73±0.10,1.76±0.08,1.36±0.12。

图3 海南岛黎母山热带云雾林根际与非根际土壤过氧化氢酶动态变化
2.4 土壤酸性磷酸酶活性季节动态变化
由图4可知,岭南青冈、罗浮锥、细枝柃根际与非根际土壤酸性磷酸酶活性的动态变化呈现单峰型变化,月际动态变化显著(p<0.05),2—7月逐渐增大,8月达到峰值,而后9—12月逐渐降低。不同树种根际土壤酸性磷酸酶活性月际变幅分别为2.36~6.46,1.62~5.71,1.86~4.96 〔mg/(g·d)〕,最大值分别为最小值的2.74,3.52,2.67倍;其均值表现为:岭南青冈〔4.09±1.34 mg/(g·d)〕>罗浮锥〔3.57±1.32 mg/(g·d)〕>细枝柃〔3.08±0.98 mg/(g·d)〕,岭南青冈显著与大于罗浮锥、细枝柃(p<0.05),分别是罗浮锥、细枝柃的1.14,1.33倍。

图4 海南岛黎母山热带云雾林根际与非根际土壤酸性磷酸酶活性动态变化
3个树种根际土壤酸性磷酸酶活性均显著高于非根际(p<0.05),不同月份动态变化中,岭南青冈、罗浮锥、细枝柃非根际土壤酸性磷酸酶活性变幅分别为1.22~4.09,0.85~4.07,0.93~3.84 mg/(g·d),其根际比分别为:1.86±0.25,1.88±0.29,1.83±0.30。
2.5 土壤酶活性根际效应
土壤酶活性的根际效应动态变化趋势总体呈“U”字型变化(图5),从2月开始逐渐下降,7—8月降至谷值后逐渐增大。土壤酶活性根际效应均为正效应(根际效应>0)。岭南青冈、罗浮锥、细枝柃土壤蔗糖酶活性根际效应变幅分别:4.66%~25.86%,7.54%~28.76%,10.11%~32.81%;其均值分别为18.15±6.94%,17.49±6.46%,19.90±8.89%,3个树种差异不显著(p>0.05);土壤脲酶活性根际效应变幅分别:50.28%~112.97%,37.61%~121.26%,20.44%~115.47%;其均值分别为72.26±26.06%,71.52±24.04%,67.65±27.01%,3个树种差异不显著(p>0.05);土壤过氧化氢酶活性根际效应变幅分别:60.68%~91.56%,65.31%~91.20%,24.28%~64.17%;其均值分别为73.95±9.65%,76.28±8.45%,36.25±12.16%,岭南青冈、罗浮锥差异不显著,但显著大于细枝柃(p>0.05);土壤酸性磷酸酶活性根际效应变幅分别:57.67%~121.65%,34.30%~122.49%,29.12%~116.11%;其均值分别为85.73±24.54%,88.01±29.26%,83.97±29.67%,3个树种差异不显著(p>0.05)。
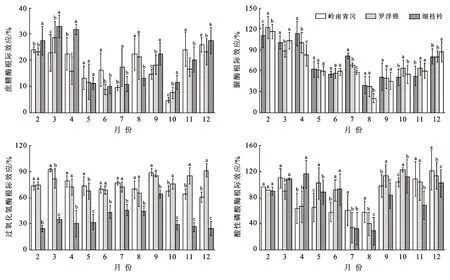
图5 海南岛黎母山热带云雾林土壤酶活性根际效应动态变化
2.6 土壤酶活性与土壤养分相关性分析
由表1可知,在根际与非根际土壤中,土壤蔗糖酶、脲酶、过氧化氢酶、酸性磷酸酶与有机碳、全氮、速效氮、全磷、速效磷、全钾、速效钾呈极显著相关(p<0.01),土壤酶活性总体与速效养分的相关性大于全氮、全磷、全钾;但与土壤含水量、pH值相关性不显著(p>0.05)。

表1 海南岛黎母山热带云雾林根际与非根际土壤酶活性与土壤养分相关性分析
3 讨 论
3.1 土壤酶活性的动态变化
土壤酶活性季节动态变化是一个复杂的生物化学生态过程,受到了气候因子、土壤水热条件、土壤理化性质、植被类型等的影响[10-14],本研究中,不同树种根际与非根际土壤酶活性月际动态变化显著,峰值出现在雨季8月。这与前人研究结果一致,例如,韩国君等[11]研究表明土壤酶活性在6月相对高于3月与12月,不同植物与季节交互作用显著影响着土壤酶活性。裴丙等[13]研究表明太行山南麓5个林龄侧柏人工林土壤酶活性季节变化明显,峰值在夏季,谷值在冬季。朱海强等[14]研究也表明湿地不同植物群落类型土壤酶活性具有明显季节变化,峰值在旺盛期的8月。Dien等[25]研究认为土壤酶活性高峰值出现在7—8月。这可能是夏季气温稳定在较高水平,本研究区5—10月为雨季,降雨较多,水热条件较为适宜,植物生长旺盛,根系生长活力增强,根际分泌物水平增大[7],土壤微生物生长繁殖旺盛[13-14,25],从而促进了土壤酶活性的提高。而在11月至翌年4月为干旱季,水分条件处于较低水平,温度较低,有机质分解减弱,根系生长活力下降,土壤微生物活性受到一定的抑制,因此土壤酶活性降低[13,25]。本研究表明3中优势植物土壤酶活性存在差异,主要是由于土壤酶来源于植物根系、微生物及动植物残体的分泌或释放[13,25],不同植物细根产量及根系分泌物存在差异,土壤微生物区系不一且数量与质量差异较大,加之凋落物分解提供碳源和能源存在差异,导致不同植被土壤酶活性不同[10-11,14,26]。
3.2 土壤酶活性根际效应的动态变化
植物通过根系摄取生长所需的养分,在根土界面层根际微环境由于根系与微生物活动的强烈影响,根际区物质和能量交换十分频繁,具有明显的根际效应[1-2,6]。研究表明植物类型差异与根际吸收养分速率有关,受到根际吸收影响,土壤养分可表现为富集或亏缺[3-4]。本研究3种树种根际土壤酶活性大于非根际土壤,呈显著的根际效应,表现为根际富集作用。这与范周周等[3]、田平雅等[4]、王小平等[7]、李丽娟等[10]研究结果一致,这主要是根系不断的分泌化合物以及细根凋落物分泌或释放酶类物质进入根际土壤,同时向根际区输入易于被土壤微生物利用的有机物[3-4],为土壤微生物提供大量碳源和能量,微生物的代谢活动增强[7,10],进而促进土壤酶活性。有研究表明,根际区土壤微生物数量是非根际区的19~32倍以上,根际区土壤微生物活性是非根际区的10倍以上[1-2],微生物不断的向周围介质分泌酶,极大的提高根际土壤酶活性[7]。土壤酶活性的提高,有利于土壤速效养分的在根际区积累,影响土壤养分循环[10]。本研究表明土壤酶根际效应表现为:酸性磷酸酶>脲酶>过氧化氢酶>蔗糖酶,这与黄娜等[26]研究结果土壤脲酶根际效应>蛋白酶>酸性磷酸酶不一致,这主要可能是不同植被根系分泌物的组成、数量与质量差异,且不同植物根系分布特征、细根的发达程度及根系凋落物的分解存在明显的差异,加之根系穿插影响土壤团聚体粒径及细根的根际沉积,进而影响土壤酶活性根际效应[3-4,10,27]。有研究指出土壤酶活性与土壤养分循环有直接关系[10],相关分析可知,在根际和非根际土壤酶活性与土壤C,N,P养分具有显著相关性,说明了土壤酶活性与C,N,P养分具有协同作用,可以在一定程度上反映养分转化与周转效率的生物学指标[25-27]。这主要是因为酶活性的提高,加速了有机质的分解与转化,增加了土壤营养成分的有效性[7-9]。
4 结 论
热带云雾林岭南青冈、罗浮锥、细枝柃3个树种对土壤酶活性的影响显著,其根际与非根际酶活性具有明显的季节动态变化,呈单峰型变化趋势。根际土壤酶活性均高于非根际土壤,表现为根际正根际效应,且根际效应显著,土壤脲酶、过氧化氢酶和酸性磷酸酶根际效应大于蔗糖酶根际效应,表明在根际区有利于土壤脲酶、过氧化氢酶和酸性磷酸酶富集,截留效应更大。本研究区土壤酶活性及其季节变化的主导控制因子可能与土壤有机质和N,P,K养分限制有关,而不同植物生长特性、凋落物分解归还、根系分泌物等也可能影响土壤C,N,P养分的可利用特性,导致不同植物类型土壤酶活性及其季节变化的差异,雨季旱季的降雨格局变化及台风雨的干扰也影响着土壤微生物进而影响着土壤酶活性,因而对于降雨格局变化、凋落物特性、根系分泌物及土壤微生物区系对土壤酶活性的影响有待进一步深入研究。
