广西北部湾入侵植物互花米草内生可培养细菌多样性及促生防病活性分析
2021-08-03李慧颖申乃坤吴家法杨立芳吴宛容邓礼霞姜明国
李慧颖 申乃坤 吴家法 杨立芳 吴宛容 邓礼霞 姜明国


摘要:【目的】探究不同入侵程度互花米草(Spartina alterniflora)根、茎和叶内生可培养细菌的多样性,并分析其对植物的防病促生活性,为互花米草入侵研究提供新思路,同时为后续的农业应用提供菌种资源。【方法】以不同入侵程度的互花米草为研究对象,采用6种选择培养基,通过稀释涂布法分离内生细菌;利用16S rRNA序列相似性及构建系统发育进化树确定内生细菌的分类地位。通过平板对峙法检测内生细菌拮抗香蕉枯萎病病原菌活性;通过功能培养基分析内生细菌产吲哚乙酸(IAA)、溶磷和固氮等促生活性。【结果】从互花米草的根、茎和叶中共分离出269株内生细菌,根据菌落形态和培养特征去重复后获得82株细菌;对内生细菌进行16S rRNA测序及比对分析,82株细菌分属于6纲16目19科31属,其中包括固氮细菌21株(占25.61%)、产IAA细菌21株(占25.61%)、溶磷菌11株(占13.41%),可拮抗香蕉枯萎病病原菌14株(占17.07%),并发现潜在新种13株(占15.85%)。互花米草入侵程度不同,内生细菌多样性也發生变化,随着入侵程度的增加,γ变形菌占据优势,而放线菌和芽孢杆菌多样性增加。【结论】互花米草内生细菌具有丰富的多样性,且多具有促生活性和生防功能,在未来农业生产中具有潜在应用价值。
关键词: 入侵植物;互花米草;内生细菌;多样性;促生活性;生防功能
中图分类号: S459;Q938.1 文献标志码: A 文章编号:2095-1191(2021)04-1012-10
Diversity of culturable endophytic bacteria in invasive plant Spartina alterniflora of Guangxi Beibu Gulf and their biocontrol effect and plant-growth-promoting activity
LI Hui-ying1,2, SHEN Nai-kun1,2, WU Jia-fa1,2, YANG Li-fang3, WU Wan-rong1,2,
DENG Li-xia1,2, JIANG Ming-guo1,2*
(1Guangxi Key Laboratory for Polysaccharide Materials and Modifications, Nanning 530008, China; 2School of Marine Sciences and Biotechnology, Guangxi University for Nationalities, Nanning 530008, China; 3School of Chemistry and Chemical Engineering, Guangxi University for Nationalities, Nanning 530008, China)
Abstract:【Objective】To study diversity of culturable endophytic bacteria in the roots, stems and leaves in different degrees of invasion of Spartina alterniflora,and analyze their biocontrol and plant-growth-promoting activity,provide new research ideas for S. alterniflora invasion research and provide microbial resources for subsequent agricultural applications. 【Method】S. alterniflora with different invasion degrees were used as the research object, and six selective media were used to isolate microorganisms by dilution coating method. 16S rRNA sequence similarity and construction of phylogenetic trees were used to determine the classification status of microorganisms. The plate confrontation method was used to detect the antagonistic activity of the bacterial strain against the pathogen of banana fusarium wilt; and the indole acetic acid production(IAA), phosphorus solubilization and nitrogen fixation were analyzed through functional plate analysis.【Result】A total of 269 endophytic bacteria were screened from the roots, stems and leaves of S. alterniflora. After deduplication according to the colony morphology and culture characteristics, the 16S rRNA sequencing and comparison of 82 strains were performed, and they belonged to 6 classes, 16 orders, 19 families and 31 genera, including 21 strains of nitrogen-fixing bacteria(25.61%), 22 strains of IAA-producing bacteria(25.61%), 11 strains of phosphate solubilizing bacteria(13.41%), 14 strains(17.07%) could antagonize the pathogen of banana fusarium wilt, and discovered potential 13 new strain species(15.85%). The degree of invasion of S. alterniflora was different, and the diversity of endophytic bacteria also changed. As the degree of invasion increased, γ-proteobacteria dominated, while the diversity of actinomycetes and bacillus increased. 【Conclusion】The endophytes of S. alterniflora are rich in diversity, and mostly have life-promo-ting and biological control functions. They have potential application value in future agricultural production.
Key words: invasive plant; Spartina alterniflora; endophyte; diversity; plant-growth-promoting activity; biocontrol effect
Foundation item: Science and Technology Major Project of Guangxi(Guike AA18242026); Specific Research Pro-ject of Guangxi for Research Bases and Talents(AD18281066,AD18126005); Innovation Project of Guangxi Graduate Education(gxun-chxzs2019037)
0 引言
【研究意義】互花米草(Spartina alterniflora)原产于大西洋沿岸,1979年由南京大学徐国万教授等为了替代大米草保滩护岸、改良土壤引入我国(杨东和万福绪,2014)。由于互花米草耐盐、耐淹、繁殖力极强(Prasanta and Niranjan,2011),已扩散至除海南省外北起辽宁南至广西的全部沿海省份(宫璐等,2017)。互花米草入侵造成生物多样性降低及生态系统退化,对生态环境和水产养殖业等造成严重危害和巨大经济损失(Li et al.,2008)。2003年国家环保总局公布首批16种外来入侵物种名单,互花米草作为唯一的海岸盐沼植物被列入其中(谢宝华等,2019)。因此,开展互花米草内生菌多样性及其防病促生活性研究,对了解互花米草入侵机制和扩大农业菌种资源具有重要意义。【前人研究进展】内生菌广泛分布于各植物组织中,且在各组织中存在差异。植物内生菌可增加植物的抗逆性,促进植物生长(Baldan et al.,2014;陈利云等,2020)。随着科学研究的不断深入,植物内生细菌在生物防治及生理生态方面的作用逐步被挖掘,成为国内外农业和医药领域的研究热点(何珊和田志宏,2020)。迟惠荣等(2019)采用平板对峙法从多花黄精中筛选生防菌,发现1株对尖孢镰刀菌具有较强抑菌作用和促生作用的芽孢杆菌。邓振山等(2019)、阳湖荣等(2019)采用稀释涂布法对巨菌草和白术内生菌进行分离并鉴定其促生活性,发现其内生菌具有固氮、溶磷、解钾和合成吲哚乙酸(IAA)的潜力。付思远等(2020)采用IS-PCR指纹图谱对泓森槐固氮内生菌进行聚类分析,发现其菌株多具有固氮、溶磷、解钾等促生活性。目前,已有部分科学家关注入侵植物内生菌对入侵植物的影响,将内生菌与植物入侵机制相联系,以探寻内生菌对植物入侵的作用机理。Rout等(2013)通过抗生素抑制入侵植物石茅内生菌,结果发现石茅生长速度和生物量明显下降,根茎明显减少,从侧面证明入侵植物内生菌对植物入侵起重要作用。Dai等(2016)构建入侵植物南美蟛蜞菊接种其内生菌的完全无菌纯培养系统,培养发现其内生菌可较明显地促进南美蟛蜞菊的生长。侯晓杰等(2018)利用平板对峙法从入侵植物黄顶菊内生细菌中筛选出对苹果轮纹病菌具有良好抑制效果的生防菌。程丹丹等(2019)利用16S rRNA序列的高通量测序技术和后续分析,探索入侵植物小蓬草内生菌群落的组成和多样性,发现鞘氨醇单胞菌属和根瘤菌属等优势菌株为植物益生菌。【本研究切入点】已有研究表明植物内生菌多具有促生和生防功能,且植物入侵可能与其内生菌群落结构和多样性存在关联,但关于不同入侵程度互花米草内生细菌多样性差异及其功能分析至今未见报道。【拟解决的关键问题】采用分离培养法对不同入侵程度的互花米草内生细菌进行多样性差异分析,探究内生细菌在互花米草入侵过程中发挥的作用,为从微生物学角度解释互花米草入侵机制提供参考,同时筛选获得具有防病促生功能菌株,为后续的农业应用提供菌种资源。
1 材料与方法
1. 1 试验材料
1. 1. 1 样品采集 于广西北海市铁山港区(东经108°18′9.76″~109°47′80.46″,北纬21°26′46.88″~21°47′0.78″)采样时选取刚入侵(互花米草单种盖度≤30%的入侵群落)和大范围入侵(互花米草单种盖度≥70%的入侵群落)的互花米草健康植株各5株,保存在无菌密封袋中,置于冰盒带回实验室,24 h内进行内生细菌分离。
1. 1. 2 供试病原菌 香蕉枯萎病病原真菌尖孢镰刀菌(Fusarium oxysporum f. sp. cubense)由广西多糖材料与改性重点实验室提供。
1. 1. 3 分离培养基 (1)YIM171培养基:甘油10.00 g,天冬酰胺1.00 g,磷酸氢二钾1.00 g,七水硫酸镁0.50 g,碳酸钙0.30 g,复合维生素0.03 g,微量元素溶液(七水硫酸亚铁0.10 g,四水氯化锰0.10 g,七水硫酸锌0.10 g,溶于100 mL水)1 mL,海盐25.00 g,琼脂15.00 g,蒸馏水1000 mL,pH 7.2±0.2。(2)R2A培养基:酵母浸出粉0.500 g,蛋白胨0.500 g,酪蛋白水解物0.500 g,葡萄糖0.500 g,可溶性淀粉0.500 g,磷酸二氢钾0.300 g,硫酸镁0.024 g,丙酮酸钠0.300 g,琼脂15.000 g,蒸馏水1000 mL,pH 7.2±0.2。(3)LB培养基:胰蛋白胨10.00 g,酵母提取物5.00 g,氯化钠10.00 g,蒸馏水1000 mL,pH 7.2±0.2。(4)Zobell 2216E培养基:蛋白胨5.00 g,酵母膏1.00 g,磷酸高铁0.01 g,琼脂15.00 g,陈海水1000 mL,pH 7.2±0.2。(5)NBRIP培养基:葡萄糖10.00 g,磷酸三钙 5.00 g,氯化镁 5.00 g,七水硫酸镁0.25 g,氯化钾0.20 g,硫酸铵1.00 g,蒸馏水1000 mL,pH 6.8~7.0。(6)Ashby无氮培养基(g/L):甘露醇10.00 g,磷酸二氢钾0.20 g,七水硫酸镁0.20 g,氯化钠0.20 g,石膏0.10 g,碳酸钙 5.00 g,蒸馏水1000 mL,pH 7.2±0.2。
1. 2 试验方法
1. 2. 1 样品处理 分别取不同入侵程度互花米草植株的根、茎和叶,去除表面附着土壤颗粒并用无菌水冲洗3次后,取根、茎和叶组织各1 g,以75%酒精消毒根组织3 min、茎和叶组织1 min;1% NaClO溶液浸泡根组织5 min、茎和叶组织3 min;最后以无菌水进行反复冲洗,并吸干水分。吸取最后1次漂洗的无菌水100 μL涂布于配置好的培养基上,验证消毒效果。将处理后的各样品加入9 mL无菌水研磨至匀浆后,分别用无菌水稀释3次,得到浓度为10-2、10-3和10-4稀释液,取200 μL涂布于配置好的培养基上(刘鲁峰等,2019)。
1. 2. 2 菌株分离及保存 将涂布好的培养基于30 ℃倒置培养3~7 d,挑取单菌落接种于LB培养基斜面上,根据菌落形态和培养特征去重复后,纯化菌株,转入斜面4 ℃短期保存,转入20%(v/v)甘油管 -20 ℃长期保藏。
1. 2. 3 DNA提取与菌株鉴定 基因组DNA提取参考周双清等(2010)的方法。采用细菌通用引物27F(5'-CAGAGTTTGATCCTGGCT-3')和1492R(5'-AGGAGGTGATCCAGCCGC-3')进行PCR扩增。PCR 扩增体系50.0 μL:2×Taq MasterMix 25.0 μL ,上、下游引物(10 μmol/L)各1.0 μL,DNA模板1.0 μL,ddH2O 22.0 μL。扩增程序:95 ℃预变性4 min;95 ℃ 1 min,56 ℃ 1 min,72 ℃ 2 min,进行32个循环;72 ℃延伸10 min。
扩增产物送至生工生物工程(上海)股份有限公司进行测序。测序结果输入EzBioCloud数据库中进行比对,获取分离菌株最相似菌株及其相似性,16S rRNA序列相似度小于98.65%定义为潜在新种(Kim et al.,2014),根据比对结果判断分离菌株的分类地位。使用MEGA 6.0中的邻接法(Neighbour-joining)构建系统发育进化树。
1. 2. 4 促生菌株筛选 通过功能培养基分析内生细菌产吲哚乙酸(IAA)、溶磷和固氮等促生活性。
1. 2. 4. 1 固氮能力菌株筛选 将筛选出的互花米草内生细菌于LB液体培养基中活化1 d,分别接种于Ashby无氮固体培养基和Ashby无氮液体培养基,以清水为对照,3次重复,30 ℃恒温培养3~7 d,观察固体培养基中有菌落和液体培养基浑浊为阳性,则有固氮活性(姚玉玲等,2014)。
1. 2. 4. 2 溶磷能力菌株筛选 将筛选出的互花米草内生细菌于LB液体培养基中活化1 d,接种于NBRIP培养基,以清水为对照,3次重复,30 ℃恒温倒置培养3~7 d,出现透明圈则该菌株具有溶磷活性(赵龙飞等,2015)。
1. 2. 4. 3 产IAA能力菌株筛选 采用Salkowski比色法,将待测菌株接种于加有色氨酸的LB液体培养基,30 ℃下180 r/min培养3 d,离心取上清液100 μL,加入等体积Salkowskis试剂混匀,室温下避光反应30 min,观察颜色变化,红色或粉红色为阳性,即产生IAA(Glickmann and Dessaux, 1995)。
1. 2. 5 抑制病原真菌能力菌株筛选 采用平板对峙法测定。使用灭菌打孔器(r=0.5 cm)从PDA培养基中获取已培养完成的香蕉枯萎病病原菌尖孢镰刀菌接种于PDA培养基正中心,并将分离得到的互花米草内生细菌接种于PDA培养基四周,以不接种内生细菌的PDA培养基为对照。30 ℃恒温培养2~3 d,筛选得到具有抑菌效果的内生细菌,再接种于病原菌的四周,重复3次,进行复筛,测定病原菌直径,计算抑菌率(徐亚军等,2013)。抑菌率(%)=(对照菌落直径-测定菌落直径)/对照菌落直径。
2 结果与分析
2. 1 互花米草内生可培养细菌多样性分析结果
从互花米草植株中共分离出269株菌株,根据菌落形态和培养特征去重复后获得82株菌株。对82株菌株进行16S rRNA序列测序,经EzBioCloud数据库比对,82株菌株分属于6纲16目19科31属,6个纲分别为放线菌纲(Actinobacteria)、芽孢杆菌纲(Bacilli)、α-变形菌纲(Alphaproteobacteria)、γ-变形菌纲(Gammaproteobacteria)、异常球菌纲(Deinococci)和黄杆菌纲(Flavobacteriia)。选取各个属中模式菌株以邻接法构建系统发育进化树。如图1所示,γ-变形菌纲和α-变形菌纲为优势类群,分别包括雷伯氏菌属(Klebsiella)、假单胞菌属(Pseudomonas)、嗜冷杆菌属(Psychrobacter)等11个属26株菌株(占31.71%)和Tistrella、Martelella等9个属14株菌株(占17.07%)。此外,还分离出与已发现菌株相似性在96.13%~98.63%的潜在新种13株(占15.85%)(表1),表明互花米草存在大量可挖掘的新的微生物资源。
2. 2 互花米草不同组织内生可培养细菌多样性差异分析结果
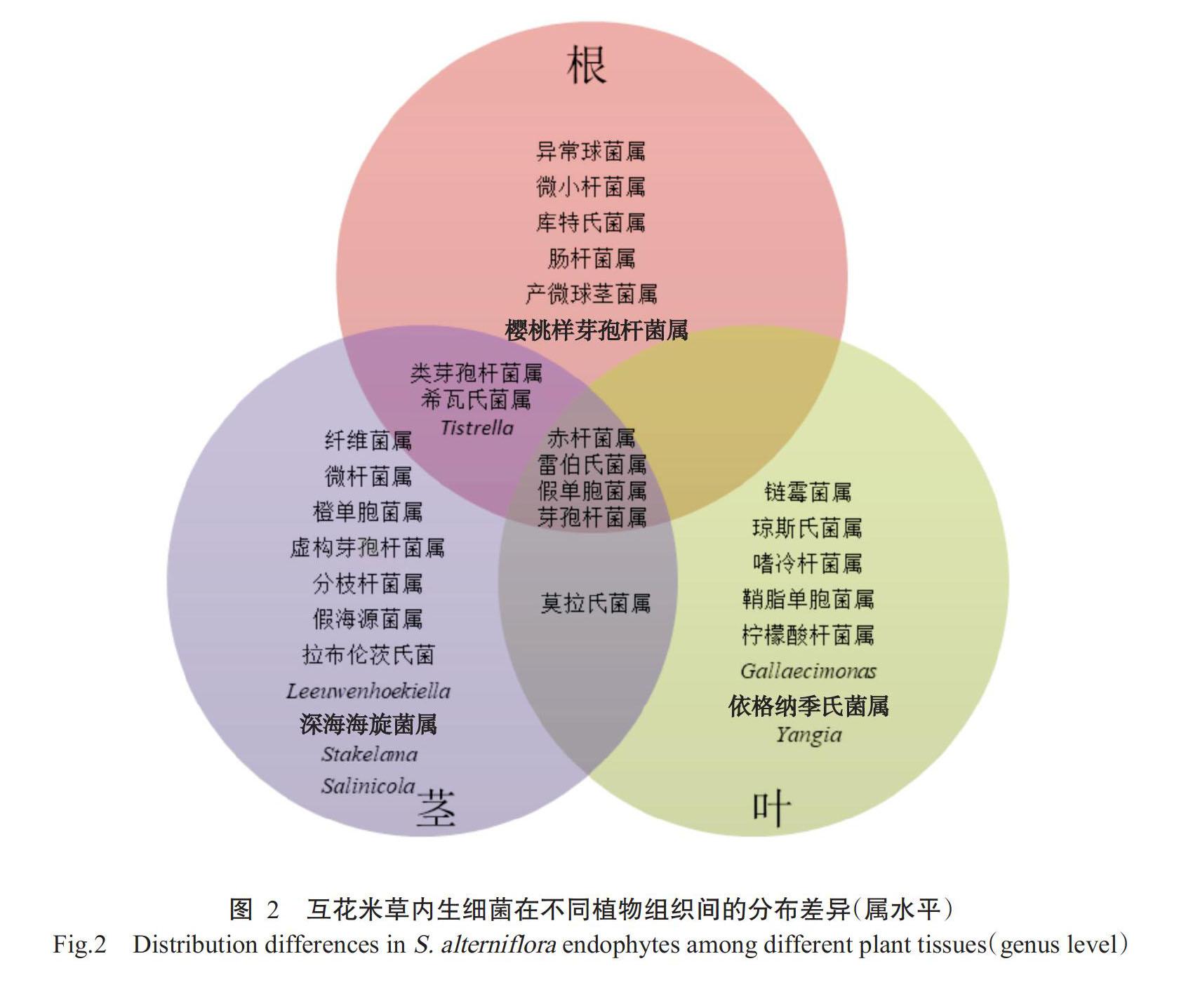
从互花米草根、茎和叶中分别分离得到107、93和69株内生菌,通过16S rRNA测序及EzBioCloud数据库比对,分属于6纲16目19科31属,属的差异如图2所示。根的内生细菌分属于13属:异常球菌属(Deinococcus)、微小杆菌属、樱桃样芽孢杆菌属(Cerasibacillus)、库特氏菌属(Kurthia)、肠杆菌属(Enterobacter)、产微球茎菌属(Microbulbifer)、类芽孢杆菌属(Paenibacillus)、雷伯氏菌属(Klebsiella)、希瓦氏菌属(Shewanella)、Tistrella、赤桿菌属(Erythrobacter)、假单胞菌属和芽孢杆菌属。茎的内生细菌分属于19属:虚构芽孢杆菌属(Fictibacillus)、微杆菌属(Microbacterium)、分枝杆菌属(Mycolicibacterium)、纤维菌属(Cellulomonas)、Leeuwenhoekiella、拉布伦茨氏菌(Labrenzia)、深海海旋菌属(Thalassospira)、Stakelama、Salinicola、橙单胞菌属(Aurantimonas)、假海源菌属(Pseudidiomarina)、类芽孢杆菌属、雷伯氏菌属、希瓦氏菌属、Tistrella、赤杆菌属、假单胞菌属、芽孢杆菌属和莫拉氏菌属(Moraxella)。叶的内生细菌分属于13属:链霉菌属(Streptomyces)、琼斯氏菌属(Jonesia)、雷伯氏菌属、Gallaecimonas、嗜冷杆菌属(Psychrobacter)、鞘脂单胞菌属(Sphingomonas)、Yangia、依格纳季氏菌属(Ignatzs-chineria)、假单胞菌属、柠檬酸杆菌属(Citrobacter)、赤杆菌属、芽孢杆菌属和莫拉氏菌属。互花米草不同组织内生细菌分布差异明显,根和茎有7个共有属(类芽孢杆菌属、希瓦氏菌属、Tistrella、赤杆菌属、 假单胞菌属、芽孢杆菌属和雷伯氏菌属),茎和叶有5个共有属(赤杆菌属、雷伯氏菌属、假单胞菌属、芽孢杆菌属和莫拉氏菌属),根和叶有4个共有属(赤杆菌属、雷伯氏菌属、假单胞菌属和芽孢杆菌属),根、茎和叶有4个共有属(赤杆菌属、雷伯氏菌属、假单胞菌属和芽孢杆菌属)。从菌株数量上看,表现为根>茎>叶。
2. 3 不同入侵程度互花米草内生细菌差异分析结果
分别从互花米草刚入侵和大范围入侵植株体内分离得到141和128株内生细菌,通过16S rRNA测序及EzBioCloud数据库比对,141和128株内生细菌分别属于19和25个属,其中9个属为共有属。通过对比发现,互花米草大范围入侵后,其内生细菌群落较刚入侵时发生明显改变,放线菌纲中分枝杆菌属被替换为琼斯氏菌属、纤维菌属和链霉菌属,芽孢杆菌中增加了微小杆菌属、樱桃样芽孢杆菌属、Kurthia和虚构芽孢杆菌属等;α变形菌多样性降低,深海海旋菌属、Yangia、Stakelama、赤杆菌属和鞘脂单胞菌属等消失;γ变形菌多样性则呈增加趋势,柠檬酸杆菌属、肠杆菌属、Gallaecimonas、嗜冷杆菌属、希瓦氏菌属、Salinicola和依格纳季氏菌属等出现。表明入侵程度不同导致互花米草内生细菌的种属差异明显,随着入侵程度的增加,γ变形菌占据优势,而放线菌和芽孢杆菌多样性增加。
2. 4 互花米草内生细菌促生性分析结果
对互花米草内生细菌进行菌株促生活性分析,结果分别获得21株固氮菌和产IAA菌,分别占分离菌株总数的25.61%,溶磷菌11株(占13.41%),分属于4纲7目10科17属中(表2)。
2. 5 互花米草内生细菌抑菌功能分析结果
通过平板对峙法筛选到对供试香蕉枯萎病病原菌尖孢镰刀菌具有抑制作用的菌株14株(占17.07%),抑菌率为15.46%~68.31%,其中抑菌活性最高的为贝莱斯芽孢杆菌(B. velezensis),抑菌率为68.31%(表3)。部分菌株对香蕉枯萎病病原菌的抑制效果见图3。
3 讨论
3. 1 互花米草内生细菌群落结构多样性
从互花米草根、茎和叶中分别分离得到内生细菌107、93和69株,分属于放线菌纲、芽孢杆菌纲、α-变形菌纲、γ-变形菌纲、异常球菌纲及黄杆菌纲。互花米草内生细菌种类较多,变形菌为主要优势菌,占48.78%,其中γ-变形菌纲和α-变形菌纲分别占31.71%和17.07%,与李虎等(2014)报道互花米草的内生细菌及程亮(2019)发现矮火绒草的内生细菌优势菌均为变形菌的结果一致。本研究发现潜在新种13株,与已发现菌株相似性在96.13%~98.63%,表明互花米草存在大量可挖掘的生物资源。
本研究结果显示,从互花米草根、茎和叶组织中分离的内生细菌数量表现为根>茎>叶,与刘鲁峰等(2019)对甘蔗不同组织内生菌的研究结果一致。大量研究表明,内生菌在植物组织的分布存在差异,可能是由于植物各组织结构不同导致供给内生菌营养成分有所差异(方珍娟等,2018)。
随着互花米草入侵程度的增加,其体内内生细菌种类发生变化,互花米草内生放线菌琼斯氏菌属、纤维菌属和链霉菌属增加。琼斯氏菌属被发现来源于海洋(Zeynab et al.,2020),链霉菌属被发现广泛来源于红树林土壤中(候师师等,2020)。γ变形菌多样性增加,柠檬酸杆菌属、肠杆菌属、Gallaecimonas、嗜冷杆菌属、希瓦氏菌属、Salinicola和依格纳季氏菌属等出现。Gallaecimonas属在红树林沉积物和海水中被分离得到(Wang et al.,2013;Zhang et al.,2018),嗜冷杆菌属和希瓦氏菌属广泛存在于红树林根内和海洋中(孙静等,2014;聂唱等,2020; Maxim et al.,2020)。因此,随着入侵程度的增加,互花米草內生细菌种类的增加可能是来源于红树林土壤及海洋中。这符合内生菌来源的假说之一,根际菌进入植物,经过长期的协同进化作用,与植物建立了一种和谐的内生关系,形成内生菌(徐亚军,2011)。
3. 2 可培养细菌促生活性及生防功能
植物内生菌是一类种类及功能多样的微生物。植物内生菌多对宿主产生有益作用,包括直接分泌生长素促进植物生长,溶磷解钾作用、固氮作用和抑制病原菌等间接促进植物生长,以及增加植物的抗逆作用等(Raheem et al.,2017; Charlie et al.,2018;Xu et al.,2019;庞发虎等,2020),探究内生菌功能活性已成为研究热点之一(Borah et al.,2019;Khan et al.,2020)。
邓振山等(2019)从巨菌草(Pennisetum giganteum)中分离出具有溶磷、固氮、抑制病原菌能力,以及产铁载体的内生菌;阳湖荣等(2019)从白术(Atractylodes macrocephala Koidz)中分离得到较多具有促生能力的芽孢杆菌以及1株兼具固氮、溶磷、解钾能力且吲哚乙酸合成能力较强的内生芽孢杆菌属内生菌;付思远等(2020)从泓森槐(Robinia pseudoacacia ‘Hongsen)中分离得到的类芽孢杆菌属(Paenibacillus sp.)内生菌具有固氮能力,而分离出的克雷伯氏菌属兼具解钾、溶磷、产生长素、产铁载体和联合固氮等多种促生长特性。本研究获得抑菌活性最高的菌株与贝莱斯芽孢杆菌的相似性达100.00%。迟惠荣等(2019)研究发现多花黄精(Polygonatum cyrtonema Hua)内生贝莱斯芽孢杆菌对尖孢镰刀菌有较强的抑制作用;程亮(2019)从青藏高原矮火绒草内生细菌中筛选得到的芽孢杆菌属拮抗细菌的拮抗能力强、种类多,本研究结果与之一致。
随着互花米草入侵程度的加深,γ变形菌多样性增加,柠檬酸杆菌属、肠杆菌属和依格纳季氏菌属等属出现,其中柠檬酸杆菌属筛选得到具有溶磷活性的菌株,肠杆菌属筛选出具有溶磷、固氮和产IAA活性的菌株;依格纳季氏菌属中筛选出具有固氮和产IAA活性的菌株;放线菌、芽孢杆菌和α变形菌中被保留的微杆菌属、类芽孢杆菌属、拉布伦茨氏菌属均筛选出具有固氮活性的菌株。因此,随着入侵程度的增加,内生菌种类更加趋向于对植株产生有益活性的菌株,与Cheng等(2019)的研究结果类似,为探究植物—细菌相互作用在植物入侵中的作用提供参考。
4 结论
互花米草内生细菌具有丰富的多样性,且多具有促生活性和生防功能,可为后续相关研究及应用提供微生物资源。
参考文献:
陈利云,呼丽萍,汪之波. 2020. 内生菌醇提取物对鸡冠花生长与抗逆性的影响[J]. 江西农业学报,32(3):61-64. doi:10.19386 /j.cnki.jxnyxb.2020.03.11. [Chen L Y,Hu L P,Wang Z B. 2020. Effects of endophytic alcohol extract on growth and stress resistance of cockscomb[J]. Acta Agriculturae Jiangxi,32(3):61-64.]
程丹丹,赵菁,田忠赛. 2019. 入侵植物小蓬草的细菌群落组成和多样性研究[J]. 安全与环境工程,26(2):16-24. doi:10.13578/j.cnki.issn.1671-1556.2019.02.003. [Cheng D D,Zhao J,Tian Z S. 2019. Composition and diversity of bacterial community of the alien invasive plant(Conyza canadensis L.)[J]. Safety and Environmental Enginee-ring,26(2):16-24.]
程亮. 2019. 青藏高原矮火絨草内生细菌多样性及生物功能分析[J]. 南方农业学报,50(10):2222-2233. doi:10.3969/ j.issn.2095-1191.2019.10.11. [Cheng L. 2019. Diversity and biological function of endophytic bacteria in Leontopodium nanum of Qinghai-Tibetan Plateau[J]. Journal of Southern Agriculture,50(10):2222-2233.]
迟惠荣,张亚惠,曾欣,陈卫良,毛碧增. 2019. 多花黄精内生贝莱斯芽胞杆菌的分离鉴定及其抗菌与促生作用分析[J]. 植物保护,45(4):122-131. doi:10.16688/j.zwbh. 2018337. [Chi H R,Zhang Y H,Zeng X,Chen W L,Mao B Z. 2019. Isolation and identification of antagonistic endophytic Bacillus velezensis from Polygonatum cyrtonema Hua and analysis of its antimicrobial and growth-promoting activity[J]. Plant Protection,45(4):122-131.]
邓振山,李买平,郝雷,陈凯凯,李静,刘玉珍,张宝宝,齐向英. 2019. 巨菌草内生细菌多样性及其促生特性[J]. 草地学报,27(5):1213-1221. doi:10.11733/j.issn.1007-0435.2019.05.013. [Deng Z S,Li M P,Hao L,Chen K K,Li J,Liu Y Z,Zhang B B,Qi X Y. 2019. Diversity and plant growth promoting activities of the culturable endophytic bacteria associated with Pennisetum sp.[J]. Acta Agrestia Sinica,27(5):1213-1221.]
方珍娟,张晓霞,马立安. 2018. 植物内生菌研究进展[J]. 长江大学学报(自科版),15(10):41-45. doi:10.16772/j.cnki. 1673-1409.2018.10.011. [Fang Z J,Zhang X X,Ma L A. 2018. Research progress of plant endophytes[J]. Journal of Yangtze University(Natural Science Edition),15(10):41-45.]
付思远,席雨晴,赵鹏菲,梁永健,宋旭,常华瑜,彭桂香,谭志远. 2020. 泓森槐可培养内生固氮细菌多样性与潜在促生长特性评价[J]. 微生物学通报,47(8):2458-2470. doi:10.13344/j.microbiol.china.190906. [Fu S Y,Xi Y Q,Zhao P F,Liang Y J,Song X,Chang H Y,Peng G X,Tan Z Y. 2020. Evaluating diversity and potential growth promoting characteristics of the culturable endophytic dia-zotrophic bacteria isolated from Robinia pseudoacacia ‘Hongsen[J]. Microbiology China,47(8):2458-2470.]
宫璐,李俊生,柳晓燕,赵相健,赵彩云. 2017. 我国部分国家级自然保护区外来入侵物种的分布概况[J]. 生态科学,36(4):210-216. doi:10.14108/j.cnki.1008-8873.2017. 04.028. [Gong L,Li J S,Liu X Y,Zhao X J,Zhao C Y. 2017. Analysis of invasive alien species in Chinese national nature reserves[J]. Ecological Science,36(4):210-216.]
何珊,田志宏. 2020. 植物内生细菌生物学效应的研究进展[J]. 安徽农学通报,26(4):20-23. doi:10.16377/j.cnki.issn1007-7731.2020.04.008. [He S,Tian Z H. 2020. Advances in the study of the biological effects of endophytic bacteria in plant[J]. Anhui Agricultural Science Bulletin,26(4):20-23.]
候师师,李蜜,姜舒,韩敏敏,刘永宏,易湘茜. 2020. 海南西海岸四种真红树根系土壤放线菌物种多样性及其延缓衰老活性初筛[J]. 广西植物,40(3):320-326. doi:10. 11931/guihaia.gxzw201904051. [Hou S S,Li M,Jiang S,Han M M,Liu Y H,Yi X X. 2020. Species diversity and anti-aging activity of actinobacteria from four true mangrove rhizosphere soils in the west coast of Hainan[J]. Guihaia,40(3):320-326.]
侯曉杰,梁魁景,欧阳汝欣,芦站根. 2018. 入侵植物黄顶菊内生细菌对苹果轮纹病菌的拮抗筛选[J]. 中国森林病虫,37(3):38-40. doi:10.3969/j.issn.1671-0886.2018.03.010. [Hou X J,Liang K J,Ouyang R X,Lu Z G. 2018. Antago-nistic screening of endophytic bacteria of invasive plant Flaveria bidentis against Botryosphaeria dothidea[J]. Fo-rest Pest and Disease,37(3):38-40.]
李虎,廖丹,苏建强,黄福义,洪有为. 2014. 外来种互花米草根内细菌多样性及功能[J]. 应用与环境生物学报,20(5):856-862. doi:10.3724/SP.J.1145.2014.03027. [Li H,Liao D,Su J Q,Huang F Y,Hong Y W. 2014. Diversity and function of endophytic bacteria in roots of exotic plant Spartina alterniflora[J]. Chinese Journal of Applied and Environmental Biology,20(5):856-862.]
刘鲁峰,寸海春,何鹏飞,狄义宁,吴毅歆,何丽莲,李富生,何月秋. 2019. 甘蔗内生菌分离鉴定及功能多样性研究[J]. 热带作物学报,40(6):1144-1152. doi:10.3969/j.issn. 1000-2561.2019.06.016. [Liu L F,Cun H C,He P F,Di Y N,Wu Y X,He L L,Li F S,He Y Q. 2019. Isolation,identification and multiple function analyses of sugarcane endophytes[J]. Chinese Journal of Tropical Crops,40(6):1144-1152.]
聂唱,侯佳林,王寅炤,蹇华哗. 2020. 深海嗜冷希瓦氏菌Shewanella psychrophila WP2的基因组学分析[J]. 应用海洋学学报,39(3):319-328. doi:10.3969/J.ISSN.2095-4972.2020.03.003. [Nie C,Hou J L,Wang Y Z,Jian H H. 2020. Genomic analysis of the psychrophilic deep-sea bacterium Shewanella psychrophila WP2[J]. Journal of Applied Oceanography,39(3):319-328.]
庞发虎,徐鸽,李敏,谢涵珠,陈兆进. 2020. 芒草根际、内生可培养细菌多样性及促生潜力研究[J]. 河南农业科学,49(6):64-73. doi:10.15933/j.cnki.1004-3268.2020.06.009. [Pang F H,Xu G,Li M,Xie H Z,Chen Z J. 2020. Research on diversity and plant growth promoting activities of the cultivable rhizosphere and endophytic bacteria of Miscanthus[J]. Journal of Henan Agricultural Scien-ces,49(6):64-73.]
孙静,王素英,张德超. 2014. 海南红树林根系土壤中可培养细菌的多样性分析[J]. 海洋科学,38(7):27-33. doi:10. 11759/hykx20130608001. [Sun J,Wang S Y,Zhang D C. 2014. Diversity of culturable bacteria from the soil of root system of mangrove forest of Beigang island in Hainan Province[J]. Marine Sciences,38(7):27-33.]
谢宝华,路峰,韩广轩. 2019. 入侵植物互花米草的资源化利用研究进展[J]. 中国生态农业学报(中英文),27(12):1870-1879. doi:10.13930/j.cnki.cjea.190339. [Xie B H,Lu F,Han G X. 2019. Resource utilization of invasive Spartina alterniflora:A review[J]. Chinese Journal of Eco-Agriculture,27(12):1870-1879.]
徐亚军,赵龙飞,陈普,蒋晓瑞,韦革宏. 2013. 植物病原菌拮抗性野生艾蒿内生菌的分离、筛选和鉴定[J]. 生态学报,33(12):3697-3705. doi:10.5846/stxb201212061754. [Xu Y J,Zhao L F,Chen P,Jiang X R,Wei G H. 2013. Isolation,screening and characterization of phytopathogen antagonistic endophytes from wild Artemisia argyi[J]. Acta Ecologica Sinica ,33(12):3697-3705.]
徐亚军. 2011. 植物内生菌资源多样性研究进展[J]. 广东农业科学,38(24):149-152. doi:10.3969/j.issn.1004-874X. 2011.24.049. [Xu Y J. 2011. Research progress on pesources diversity of plant endophytes[J]. Guangdong Agricultural Sciences,38(24):149-152.]
杨东,万福绪. 2014. 外来入侵种互花米草的研究进展[J]. 植物保护,40(2):5-10. doi:10.3969/j.issn.0529-1542.2014. 02.002. [Yang D,Wan F X. 2014. Research progress on invasive alien species Spartina alterniflora[J]. Plant Protection,40(2):5-10.]
姚玉玲,王穎,王玉琴,杨成德. 2014. 矮生嵩草内生细菌溶磷、抑菌和产IAA能力的测定及鉴定[J]. 草地学报,22(6):1252-1257. doi:10.11733/j.issn.1007-0435.2014.06. 016. [Yao Y L,Wang Y,Wang Y Q,Yang C D. 2014. Identification of endophytic bacteria from Kobresia humilis and determination of phosphate-solubilizing,IAA secretion and antagonistic abilities[J]. Acta Agrestia Sinica,22(6):1252-1257.]
阳湖荣,陈飘雪,戴传超. 2019. 白术内生细菌分离与促生活性[J]. 生态学杂志,38(12):3680-3688. doi:10.13292/j.1000-4890.201912.003. [Yang H R,Chen P X,Dai C C. 2019. Isolation and plant-growth-promoting ability of endophytic bacteria in Atractylodes macrocephala Koidz[J]. Chinese Journal of Ecology,38(12):3680-3688.]
赵龙飞,徐亚军,曹冬建,李源,厉静杰,吕佳萌,朱自亿,秦珊珊,贺学礼. 2015. 溶磷性大豆根瘤内生菌的筛选、抗性及系统发育和促生[J]. 生态学报,35(13):4425-4435. doi:10.5846/stxb201406171262. [Zhao L F,Xu Y J,Cao D J,Li Y,Li J J,Lü J M,Zhu Z Y,Qin S S,He X L. 2015. Screening,resistance,phylogeny and growth promoting of phosphorus solubilizing bacteria isolated from soybean root nodules[J]. Acta Ecologica Sinica,35(13):4425-4435.]
周双清,黄小龙,黄东益,胡新文,陈吉良. 2010. Chelex-100快速提取放线菌DNA作为PCR扩增模板[J]. 生物技术通报,24(2):123-125. doi:10.13560/j.cnki.biotech.bull. 1985.2010.02.024. [Zhou S Q,Huang X L,Huang D Y,Hu X W,Chen J L. 2010. A rapid method for extracting DNA from actinomycetes by Chelex-100[J]. Biotechno-logy Bulletin,24(2):123-125.]
Baldan E,Nigris S,Populin F,Zottini M,Squartini A,Baldan B. 2014. Identification of culturable bacterial endophyte community isolated from tissues of Vitisvinifera “Glera”[J]. Plant Biosystems-An International Journal Dealing with all Aspects of Plant Biology,148(3):508-516. doi:10.1080/11263504.2014.916364.
Borah A,Das R,Mazumdar R,Thakur D. 2019. Culturable endophytic bacteria of Camellia species endowed with plant growth promoting characteristics[J]. Journal of Applied Microbiology,127(3):825-844. doi:10.1111/jam.14356.
Charlie E F,Ria S,Yekti A P,Tri R N,Donny W. 2018. Diversity of endophytic bacteria in sweet sorghum(Sorghum bicolor(L.) Moench.) and their potential for promoting plant growth[J]. Indian Journal of Science and Technology,11(11):1-10. doi:10.17485/ijst/2018/v11i11/120283.
Cheng D D,Tian Z S,Feng L,Xu L,Wang H M. 2019. Diversity analysis of the rhizospheric and endophytic bacterial communities of Senecio vulgaris L.(Asteraceae) in an invasive range[J]. PeerJ,6:e6162. doi:10.7717/peerj.6162.
Dai Z C,Fu W,Wan L Y,Cai,H H,Wang N,Qi S S,Du D L. 2016. Different growth promoting effects of endophytic bacteria on invasive and native clonal plants[J]. Frontiers in Plant Science,7:706. doi:10.3389/fpls.2016.00706
Glickmann E,Dessaux Y. 1995. A critical examination of the specificity of the salkowski reagent for indolic compounds produced by phytopathogenic bacteria[J]. Applied and Environmental Microbiology,61(2):793-796. doi:10. 1002/bit.260450314.
Khan M A,Asaf S,Khan A L,Adhikari A,Jan R,Ali S,Imran M,Kim K M,Lee I J. 2020. Plant growth-promoting endophytic bacteria augment growth and salinity tolerance in rice plants[J]. Plant Biology,22(5):850-862. doi:10. 1111/plb.13124.
Kim M,Oh H S,Park S C,Chun J. 2014. Towards a taxonomic coherence between average nucleotide identity and 16S rRNA gene sequence similarity for species demarcation of prokaryotes[J]. International Journal of Systematic and Evolutionary Microbiology,64(2):346-351. doi:10.1099/ijs.0.059774-0.
Li B,Liao C Z,Zhang X D,Chen H L,Wang Q,Chen Z Y,Gan X J,Wu J H,Zhao B,Ma Z J,Cheng X L,Jiang L F,Chen J K. 2008. Spartina alterniflora invasions in the Yangtze River estuary,China:An overview of current status and ecosystem effects[J]. Ecological Engineering,35(4):511-520. doi:10.1016/j.ecoleng.2008.05.013.
Maxim S K,Alexandra S K,Lyudmila A R,Irina V C,Oleg V C. 2020. Structure and in vitro bioactivity against cancer cells of the capsular polysaccharide from the marine bacterium Psychrobacter marincola[J]. Marine Drugs,18(5):268. doi:10.3390/md18050268
Prasanta K S,Niranjan B. 2011. Spartina alterniflora Loisel.,a halophyte grass model to dissect salt stress tolerance[J]. In Vitro Cellular & Developmental Biology-Plant,47(4):441-457. doi:10.1007/s11627-011-9361-8.
Rout M E,Chrzanowski T H,Westlie T K,DeLuca T H,Calla-way R M,Holben W E. 2013. Bacterial endophytes enhance competition by invasive plants[J]. American Journal of Botany,100(9):1726-1737. doi:10.3732/ajb.1200 577
Raheem S,Abdul L K,Saqib B,Muhammad W,Kang S M,Lee I J. 2017. Inoculation of abscisic acid-producing endophytic bacteria enhances salinity stress tolerance in Oryza sativa[J]. Environmental and Experimental Botany,136:68-77. doi:10.1016/j.envexpbot.2017.01.010.
Wang J N,Lai Q L,Duan X,Fu Y Y,Wang L P,Wang W P,Shao Z Z. 2013. Gallaecimonas xiamenensis sp. nov.,isolated from seawater[J]. International Journal of Systema-tic and Evolutionary Microbiology,63(3):930-933. doi:10.1099/ijs.0.042283-0.
Xu W F,Wang F,Zhang M,Ou T,Wang R L,Strobel,G,Xiang Z H,Zhou Z,Xie J. 2019. Diversity of cultivable endophytic bacteria in mulberry and their potential for antimicrobial and plant growth-promoting activities[J]. Microbiological Research,229:126328. doi:10.1016/j.micres.2019.126328.
Zeynab S S,Fereshteh J K,Zohreh Z. 2020. Isolation,characterization,and decolorization of Disperse Blue 60 by newly isolated bacterial strains from Kashan textile wastewater[J]. Water Environment Research,92(6):873-879. doi:10.1002/wer.1282.
Zhang W Y,Yuan Y,Su D Q,He X P,Han S B,Epstein S S,He S,Wu M. 2018. Gallaecimonas mangrovi sp. nov.,a novel bacterium isolated from mangrove sediment[J]. An-tonie van Leeuwenhoek,111(10):1855-1862. doi:10. 1007/s10482-018-1076-y(0123456789).
(責任编辑 麻小燕)
