CuO修饰的Cu1.5Mn1.5O4尖晶石型复合氧化物对CO氧化的协同催化
2021-07-29孙若琳张斯然宋鹏飞
孙若琳 ,张斯然,* ,安 康 ,宋鹏飞 ,刘 源,*
(1. 天津大学化学工程学院 天津市应用催化科学与工程重点实验室,天津 300072;2. 天津化学化工协同创新中心,天津 300072)
CO氧化反应的研究兼具学术价值和现实意义。一氧化碳完全氧化反应比较简单而且对于气固相多相氧化反应具有代表性,将其作为探针反应来揭示催化剂的性能与组成、结构的关系,对其他氧化反应具有指导作用[1,2]。另外,日常生活和工业生产的很多方面都需要去除CO,而去除CO最有效的途径之一就是利用催化剂把CO氧化为CO2[3-5]。这些催化剂广泛应用于汽车尾气、防毒面具、燃料电池(PEMFC)等中[6-8]。
已被报道的用于CO氧化的催化剂主要有贵金属催化剂和非贵金属催化剂两大类。贵金属主要有Pt[9]、Au[10]、Pd[11]、Ru[12]等,资源稀缺限制了贵金属催化剂的广泛应用。非贵金属催化剂的研究主要集中在呈现混合价态的CuOx、MnOx、FeOx、CoOx、CeOx上[13,14],近年来,众多科研工作者想从这些过渡族金属氧化物中寻求低成本和稳定性好的催化剂,对过渡金属Cu和Mn作为反应活性相的研究越来越多[15-18]。
对于催化CO的铜锰基催化剂,研究较早的是CuOx和MnOx氧化物及其混合物,MnOx、CuOx单独用于CO氧化反应也有研究[19,20],研究较多的一般是由活性CuO和MnO2按一定比例制成的颗粒状催化剂。Buciuman等[21]发现物质的量比为1∶1的CuO和Mn2O3混合物对CO氧化有最好的活性,作者认为铜锰氧化物之间存在溢流协同效应,锰中心吸附氧,铜中心吸附CO,吸附氧从氧化锰表面传递到氧化铜表面,把CO氧化形成CO2。张纪领等[22]认为CuO/MnOx上CO氧化的过程为:气相中的O2在MnOx上吸附活化,CuO吸附CO,活性位可能存在于MnOx和CuO之间的界面上,在活性位上CO被氧化成CO2并传递到氧化锰表面,以双齿碳酸盐的形式存在,然后把CO2释放到空气中。Qian等[23]采用等体积浸渍法合成了一系列不同CuO负载量的CuO/MnO2催化剂。CuO负载量为1%-40%的CuO/MnO2催化剂对CO氧化催化性能相差不大,进一步表征证明在CuO/MnO2上遵循界面反应机理。铜锰氧化物催化CO影响因素较多,难以从分子级水平对反应过程进行准确定位,研究者只能针对特定反应体系得出实验数据从而推断机理。


综上所述,Cu1.5Mn1.5O4、CuOx、MnOx对CO氧化都有一定的催化作用,文献也普遍认为多相体系结构对CO氧化等反应是有利的[30-33],因此,本研究尝试通过构筑一个CuOx或MnOx修饰的Cu1.5Mn1.5O4尖晶石结构,探究氧化物和尖晶石型复合氧化物的协同作用对于CO氧化反应的影响,为构筑Cu-Mn基催化剂用于催化氧化反应提供可参考的素材。
本研究通过柠檬酸络合法制备了一系列Cu-Mn-O尖晶石复合型氧化物,考察了Cu1.5Mn1.5O4、CuO、Mn3O4及CuO修饰的Cu1.5Mn1.5O4和Mn3O4修饰的Cu1.5Mn1.5O4,发现CuO-Cu1.5Mn1.5O4样品对CO氧化表现出较优异的催化活性。CuO和Cu1.5Mn1.5O4间的协同效应为CO氧化提供了一条可能的反应路径。
1 实验部分
1.1 实验原料
Cu(NO3)2·3H2O,Mn(NO3)2(w= 50%),无水柠檬酸(C6H8O7)分析纯(AR),上海阿拉丁生化科技股份有限公司;乙二醇((HOCH2)2),无水乙醇(C2H5OH),AR,天津光复精细化工研究所;去离子水,天津大学;一氧化碳-氮气混合气(2%CO-98%N2),氧气-氮气混合气(4%-96%),高纯氮气99. 999%,氢气-氩气混合气(5%-95%),天津市贞好科技有限公司。
1.2 催化剂的制备
采用柠檬酸盐络合-溶胶凝胶法,以Cu(NO3)2·3H2O、Mn(NO3)2(w= 50%)溶液为前体,制备了一系列铜锰尖晶石型复合氧化物。制备方法如下:按照物质的量比为硝酸铜:硝酸锰:柠檬酸:乙二醇 =X∶Y∶5.25∶0.72(X∶Y= 2∶1、1.5∶1.5、1∶2、0.8∶1)的比例配置一定浓度的溶液。将该溶液放置在水浴锅中,在80 ℃、101 kPa下加热直至形成绿色凝胶。将绿色凝胶转移到120 ℃恒温干燥箱中干燥12 h,干燥后将样品在350 ℃焙烧2 h,再在Z℃焙烧4 h(Z= 350、450、550、650 ℃)得到催化剂。其中,当X∶Y= 2∶1时,得到CuO修饰的Cu1.5Mn1.5O4,即CuO-Cu1.5Mn1.5O4;当X∶Y= 1.5∶1.5或0.8∶1时,得到样品Cu1.5Mn1.5O4;当X∶Y= 1∶2时,得到Mn3O4修饰的Cu1.5Mn1.5O4,即Mn3O4-Cu1.5Mn1.5O4。不同焙烧温度制备的样品在分子式后括号中标注。以样品CuO-Cu1.5Mn1.5O4(450 ℃)的制备为例:X∶Y= 2∶1,Z= 450 ℃,即按照硝酸铜:硝酸锰:柠檬酸:乙二醇 = 2∶1∶5.25∶0.72的物质的量比配制溶液,(硝酸铜0.02 mol、硝酸锰0.01 mol、柠檬酸0.0525 mol、乙二醇0.0072 mol)。将该溶液放置在水浴锅中,在80 ℃、101 kPa下加热直至形成绿色凝胶。将绿色凝胶转移到120 ℃恒温干燥箱中干燥12 h,干燥后将样品在350 ℃焙烧2 h,450 ℃下焙烧4 h。所有样品标记为CuO-Cu1.5Mn1.5O4(350 ℃)、CuOCu1.5Mn1.5O4(450 ℃)、CuO-Cu1.5Mn1.5O4(550 ℃)、CuOCu1.5Mn1.5O4(650 ℃);Cu1.5Mn1.5O4(350 ℃)、Cu1.5Mn1.5O4(450 ℃)、Cu1.5Mn1.5O4(550 ℃)、Cu1.5Mn1.5O4(650 ℃);Mn3O4-Cu1.5Mn1.5O4(350 ℃)、Mn3O4-Cu1.5Mn1.5O4(450℃)、Mn3O4-Cu1.5Mn1.5O4(550 ℃)、Mn3O4-Cu1.5Mn1.5O4(650 ℃)。不同样品中均具有良好结晶性的Cu1.5Mn1.5O4超细纳米颗粒。作为对照,采用相同的方法制备了单一氧化物CuO和Mn3O4。
1.3 催化剂的表征
用Trwastar 3000 micromeritics设备对催化剂进行N2吸附-脱附等温线实验。测试前,为了除去样品表面的杂质将样品置于200 ℃下真空脱气4 h。在-196 ℃,相对压力为0.05-0.30,开始N2吸附。采用Brunauer-Emmett-Teller(BET)模型计算比表面积,用Barrett-Joyner-Halenda(BJH)模型计算N2吸附-脱附等温线的孔径分布。
利用Bruker D8 Focus型Cu靶X射线衍射仪对催化剂粉末进行了XRD测试。CuKα(λ=0.15406 nm)射线作为辐射源,工作电压40 kV,工作电流40 mA,以8(°)/min的扫描速率在10°-80°测试。通过与Jade 6.0软件中的ICDD-PDF数据库卡进行比较来鉴定结晶相。对主峰进行放大扫描后,根据Scherrer方程计算晶体尺寸。
采用天津大学北洋化工实验设备公司自主研制的TP-5079全自动多功能吸附仪对样品进行程序升温还原(TPR)测试。具体操作步骤如下:用电子天平称取50 mg样品装入石英管中,样品上下均装填石英棉用来固定催化剂床层。实验开始前,先在室温下用5% H2/N2平衡的混合气体以30 mL/min的体积流量进行吹扫,直至TCD输出的信号达到稳定。输出信号达到稳定后,从室温开始以10 ℃/min的升温速率匀速升温至900 ℃。这个过程中,通过TCD检测器来检测反应前后气体中的氢气变化给出不同温度的耗氢量,生成TPR谱图。
在型号为JEOL JEM-2100F的电子显微镜上获得样品的TEM和HRTEM照片,得到催化剂的微观形貌结构,通过HRTEM照片分析晶格条纹的种类。待测样品具体制备过程:取少量催化剂研磨溶解在酒精中制得低浓度溶液,装入离心管中超声30 min,使催化剂均匀分散在酒精溶液中,取此溶液的上层清液滴在具有多孔碳膜的铜网上,样品自然干燥后,在200 kV电压下进行测试。
在带有TCD检测器的天津先权TP-5080多功能自动吸附仪上进行了O2(O2-TPD)和CO(COTPD)的程序升温脱附测试。将100 mg催化剂装入石英管中,样品上下装填石英棉固定。先在氦气(30 mL/min)下于300 ℃吹扫0.5 h,然后将温度降至室温,通入纯O2(或CO)(30 mL/min)0.5 h以达到吸附饱和。达到饱和吸附后用30 mL/min的He气吹扫1 h。待TCD输出信号达到稳定后,以10 ℃/min的速率将温度从50 ℃升高到900 ℃。
1.4 催化剂的性能测试
催化剂性能测试在固定床CO氧化反应装置上进行,该装置由固定床反应器、加热装置、流量测量、控制设备、温度测量和在线气相色谱等组成。气相色谱仪为SP-3420型,色谱柱为5A分子筛,检测器为热导池检测器,用来测量分析反应前后原料气中的CO和O2的浓度。100 mg催化剂(40-60目)在以CO∶O2∶N2= 1∶1∶98组成的反应气中反应。总流量为40 mL/min,重量时空速度(WHSV)为24000 mL/(gcat·h),体积空速为9600 h-1。催化剂的活性由反应中CO的转化率进行评价,其计算公式如下:

式中,[CO]in、[CO]out分别为单位时间内进入反应器和流出反应器的CO的体积分数。
2 结果与讨论
2.1 催化剂的性能评价
通过2.2节所述的制备方法得到不同铜锰摩尔比及不同焙烧温度的12个样品:CuO-Cu1.5Mn1.5O4(350 ℃)、CuO-Cu1.5Mn1.5O4(450 ℃)、CuO-Cu1.5Mn1.5O4(550 ℃)、 CuO-Cu1.5Mn1.5O4(650 ℃)、 Cu1.5Mn1.5O4(350 ℃)、Cu1.5Mn1.5O4(450 ℃)、Cu1.5Mn1.5O4(550 ℃)、Cu1.5Mn1.5O4(650 ℃)、 Mn3O4-Cu1.5Mn1.5O4(350 ℃)、Mn3O4-Cu1.5Mn1.5O4(450 ℃)、 Mn3O4-Cu1.5Mn1.5O4(550 ℃)、Mn3O4-Cu1.5Mn1.5O4(650 ℃),并测试其CO氧化活性,活性图见图1。由图1可知,在采集的7个不同反应温度点下,相同制备条件的CuOCu1.5Mn1.5O4样品的CO转化率均高于Cu1.5Mn1.5O4、Mn3O4-Cu1.5Mn1.5O4样品。这12个样品的性能测试显示:CuO修饰的Cu1.5Mn1.5O4性能最好。由以上可初步得出这样的结论:CuO和Cu1.5Mn1.5O4之间存在协同作用,有益于CO氧化反应。鉴于450 ℃的样品活性较好且结构理想,因此,选择450 ℃焙烧后的样品进行进一步的分析。后文中所研究催化剂均为450 ℃焙烧后的样品,为了简便标记,后文中催化剂不再标注焙烧温度450 ℃。
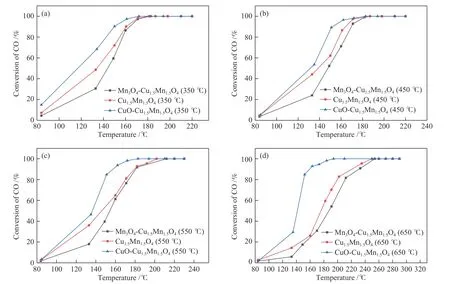
图1 12种不同煅烧温度催化剂的低温CO氧化活性 (a)350 ℃、(b) 450 ℃、(c) 550 ℃、(d) 650 ℃Figure 1 Low-temperature CO oxidation activity of 12 different catalysts with different calcined temperature at (a) 350 ℃, (b) 450 ℃,(c) 550 ℃ and (d) 650 ℃. reaction conditions: catalyst weight 0.10 g; CO 1%, O2 1%, N2 balance; WHSV = 24000 mL/(gcat·h)
图2是450 ℃焙烧的样品在不同温度下(80-250 ℃)的CO氧化测试结果。活性对反应温度的依赖性因化学成分的不同而有很大差异。如图2所示,CuO-Cu1.5Mn1.5O4177 ℃完全转化,Cu1.5Mn1.5O4、Mn3O4-Cu1.5Mn1.5O4次之,CuO对CO氧化的活性较差,但当温度升高到150 ℃之后,CuO的活性急剧增加。Mn3O4活性最差,CO在245 ℃时才能完全转化。表1是在低温下(80 ℃)Cu-Mn复合氧化物单位面积CO氧化的本征活性数据。CO氧化在Cu-Mn复合氧化物上的单位表面的本征速率由高到低依次为:CuO-Cu1.5Mn1.5O4> Mn3O4-Cu1.5Mn1.5O4>Cu1.5Mn1.5O4。由以上数据可得,CuO-Cu1.5Mn1.5O4样品单位表面上的CO转化率最高,说明CuO和Cu1.5Mn1.5O4之间存在协同效应,表面分散的CuO和Cu1.5Mn1.5O4尖晶石的协同作用有利于CO氧化反应的进行。

表1 低温下(80 ℃)Cu-Mn复合氧化物单位面积CO氧化的本征活性Table 1 The unit surface activity of samples at low temperature (80 ℃)

图2 不同催化剂的CO氧化性能Figure 2 Catalytic oxidation of CO over the Cu-Mn catalysts with various Cu/Mn molar ratio. catalyst weight 0.10 g;CO 1%, O2 1%, N2 balance; WHSV = 24000 mL/(gcat·h)
2.2 催化剂的表征
2.2.1 N2吸附-脱附表征
图3(a)为以不同Cu/Mn物质的量比制备的催化剂的N2吸附-脱附曲线。由图3可知,根据文献中IUPAC的分类,显示该系列催化剂具有IV型等温线,H3型回滞环(p/p0≥ 0.6),对应于N2气体的毛细管缩合,表明形成了介孔结构[34]。H3型磁滞回线被认为与平行粒子堆积形成的狭缝孔有关[35]。与BJH孔径分布曲线的表征结果一致。从图3(a)中可以观察到相对压力(p/p0)在0.8-1.0时氮气的吸附量迅速增加,说明样品的孔径分布相对集中、分布较均匀[34]。图3(b)为图3(a)中对应催化剂的孔径分布。可以看出,催化剂孔径集中分布在10-30 nm。表2中列出了不同样品的比表面积和孔容孔径。

表2 不同样品的物理性质Table 2 Physical properties of the studied samples

图3 不同催化剂的N2吸附-脱附曲线(a)和孔径分布(b)Figure 3 N2 adsorption-desorption isotherms (a) and pore size distribution curves (b) of the studied samples
2.2.2 XRD表征
图4为以不同Cu/Mn物质的量比制备的催化剂的XRD谱图。以金属硝酸盐为前体,在溶胶凝胶法中使用柠檬酸作为络合剂,可以在原子水平上均匀地混合铜锰基前驱体,与文献中Cu1.5Mn1.5O4的合成相比,所有的催化剂颗粒尺寸比较小且都具有良好的Cu1.5Mn1.5O4晶型[36,37]。在之后的煅烧过程中,所有的有机成分均被热解成CO2和H2O。图4的XRD谱图显示,煅烧后获得了氧化物CuO、Mn3O4、Cu1.5Mn1.5O4和混合氧化物CuO-Cu1.5Mn1.5O4、Mn3O4-Cu1.5Mn1.5O4。

图4 不同样品的XRD谱图Figure 4 XRD patterns of samples
由图4可知,CuO-Cu1.5Mn1.5O4中同时含有CuO(ICDD-PDF no.48-1548)和Cu1.5Mn1.5O4(ICDDPDF no. 35-1172)的衍射峰。Mn3O4-Cu1.5Mn1.5O4样品中同时含有Mn3O4(ICDD-PDF no.18-0803)和Cu1.5Mn1.5O4(ICDD-PDF no. 35-1172)的衍射峰。当Cu/Mn为1.5/1.5、0.8/1时,获得的催化剂具有单一的Cu1.5Mn1.5O4(ICDD-PDF no. 35-1172)结构。具有非化学计量立方尖晶石CuxMn3-xO4结构的Cu1.5Mn1.5O4相(ICDD-PDF no. 35-1172)出现的2θ值为18.53°、30.45°、35.98°、37.60°、43.82°、54.25°、57.81°、63.60°、75.22°和76.37°的衍射峰,可分别归因于立方Cu1.5Mn1.5O4尖晶石结构的(111)、(220)、(311)、(222)、(400)、(422)、(333)、(440)、(533)和(622)晶面[36]。CuO呈现CuO的单斜相(ICDD-PDF no.48-1548),而Mn3O4衍射峰与标准卡片中氧化锰(ICDD-PDF no.18-0803)一致[38]。
表3列出了通过Scherrer方程计算的不同催化剂的晶粒尺寸。值得注意的是,Cu1.5Mn1.5O4的晶粒尺寸最大,其次是Mn3O4-Cu1.5Mn1.5O4,CuOCu1.5Mn1.5O4样品晶粒尺寸最小。这可能是由于Mn3O4和CuO的存在抑制了Cu1.5Mn1.5O4晶粒的长大。通过X射线衍射分析发现,当Cu/Mn比为0-3时有利于Cu1.5Mn1.5O4尖晶石的形成。有文章报道,适量的尖晶石相有利于催化反应[38]。如图5所示,反应后的催化剂也进行了XRD分析,发现催化剂的相组成、结晶度和晶粒尺寸基本没有改变,表明通过这种简单的合成工艺合成的尖晶石型混合氧化物结构稳定。

表3 不同催化剂的晶粒尺寸Table 3 Grain size of different catalysts

图5 催化反应后不同样品的XRD谱图Figure 5 XRD patterns of prepared samples after catalytic reaction
2.2.3 H2-TPR表征
图6为CuO、Mn3O4-Cu1.5Mn1.5O4、Cu1.5Mn1.5O4、CuO-Cu1.5Mn1.5O4、Mn3O4的TPR谱图。由图6和表4可知,CuO-Cu1.5Mn1.5O4样品具有较其他样品更大的还原峰面积,且还原峰温度更低,说明CuO相与Cu1.5Mn1.5O4相共存提高了催化剂的还原能力[39]。

图6 不同样品的H2-TPR谱图Figure 6 H2-TPR profiles of the prepared catalysts

表4 Mn3O4-Cu1.5Mn1.5O4、Cu1.5Mn1.5O4和CuO-Cu1.5Mn1.5O4样品的还原峰面积Table 4 Reduction peak area of the Mn3O4-Cu1.5Mn1.5O4,Cu1.5Mn1.5O4 and CuO-Cu1.5Mn1.5O4 catalysts
具体而言,根据文献报道[28,40,41],因为在Cu1.5Mn1.5O4中还原Cu2+离子比在CuO中还原Cu2+要困难得多[42],CuO-Cu1.5Mn1.5O4样品在260 ℃的还原峰可能归因于催化剂表面分散的CuO的还原(Cu2+还原为Cu0),CuO还原后的0价Cu可作为H2的活性中心,促进Cu1.5Mn1.5O4的还原,降低了锰离子的还原温度[43-45]。因此,CuO-Cu1.5Mn1.5O4样品在310 ℃附近的峰可能归因于Cu1.5Mn1.5O4中的Cu2+还原为Cu0和Mn3+还原为Mn2+。Mn3O4-Cu1.5Mn1.5O4样品在280 ℃的峰可能为表面分散的锰氧化物的还原,在340 ℃附近的峰可能为Cu1.5Mn1.5O4中的Cu2+还原为Cu0和Mn3+还原为Mn2+。Cu1.5Mn1.5O4样品和CuO-Cu1.5Mn1.5O4样品、Mn3O4-Cu1.5Mn1.5O4样品的还原峰不一样,Cu1.5Mn1.5O4样品只在340 ℃左右有一个较宽的还原峰,此还原峰可能为Cu2+还原为Cu0和Mn3+还原为Mn2+[42]。TPR表征的结果证明作者得到了CuO-Cu1.5Mn1.5O4、Mn3O4-Cu1.5Mn1.5O4物质,与XRD测试结果相一致。
锰氧化物有230和450 ℃两个还原峰,低温下230 ℃的还原峰对应于Mn4+到Mn3+的还原,450 ℃的还原峰对应于Mn3+到Mn2+的还原[39]。Mn3O4单氧化物的XRD中没有MnO2的衍射峰,但TPR曲线中却出现了Mn4+到Mn3+的还原峰,可能是由于样品中MnO2量太少又高分散的缘故。
2.2.4 TEM表征
为了研究Cu-Mn-O尖晶石型催化剂的微观结构、组成和粒径,分别对CuO-Cu1.5Mn1.5O4、Mn3O4-Cu1.5Mn1.5O4、Cu1.5Mn1.5O4样品进行了TEM和HRTEM测试,得到的结果见图7。
图7(a)为CuO-Cu1.5Mn1.5O4样品的TEM照片,CuO和Cu1.5Mn1.5O4尖晶石紧密接触,没有明显的边界区别。如图7(a),CuO-Cu1.5Mn1.5O4样品由10 nm左右的纳米小颗粒堆积而成,与Scherrer方程的XRD数据分析结果吻合较好。图7(a')、(a'')为CuOCu1.5Mn1.5O4样品的HRTEM图,从图中可以找到对应于CuO和Cu1.5Mn1.5O4的晶格条纹。具体而言,计算出晶格间距,能够分别找到晶格间距对应的CuO暴露的(111)晶面和Cu1.5Mn1.5O4暴露的(111)晶面,表明CuO和Cu1.5Mn1.5O4尖晶石是紧密结合在一起的,形成了CuO-Cu1.5Mn1.5O4结构。图7(b)为Mn3O4-Cu1.5Mn1.5O4样品的TEM照片,Mn3O4-Cu1.5Mn1.5O4样品是由截面呈椭圆形的20 nm的小颗粒堆积形成,与XRD测试的计算结果相一致。图7(b')、(b'')为Mn3O4-Cu1.5Mn1.5O4样品的HRTEM照片。图7(b'')为(b')的局部放大图,由快速傅里叶逆变换分析结果,可以证明Mn3O4和Cu1.5Mn1.5O4尖晶石紧密结合,形成了Mn3O4-Cu1.5Mn1.5O4结构。图 7(c)为Cu1.5Mn1.5O4样品的TEM照片,表明Cu1.5Mn1.5O4样品是由截面呈圆形的纳米小颗粒堆积形成,图7(c')为Cu1.5Mn1.5O4样品的HRTEM照片,仅显示出Cu1.5Mn1.5O4尖晶石(311)晶面,形成Cu1.5Mn1.5O4。
2.2.5 CO-TPD和O2-TPD表征
为了研究样品上CO和O2的吸附情况,分别对CuO-Cu1.5Mn1.5O4、Cu1.5Mn1.5O4、Mn3O4-Cu1.5Mn1.5O4、CuO、Mn3O4样品做了TPD测试,CO-TPD曲线见图8,O2-TPD见图9。由图8(a)和图9(a),对于Mn3O4、Cu1.5Mn1.5O4样品,CO和O2在低温、中温、高温处的脱附位相近,推测CO分子和O2分子在Cu1.5Mn1.5O4、Mn3O4上具有相似的吸附位,推测CO和O2在Cu1.5Mn1.5O4、Mn3O4上是竞争吸附的[46]。CuO样品上几乎不存在CO的脱附峰,CuO样品在120、260、400 ℃有O2的弱脱附峰,推测CuO上只存在O2的吸附位,不吸附CO。
如图8所示,对于CO的吸附,中等吸附强度(350-500 ℃)的CO对反应是最有利的,若CO吸附太强即使CO2生成,CO2也不易脱附[47]。图8(b)显示,CuO-Cu1.5Mn1.5O4样品的中等吸附强度的峰较Cu1.5Mn1.5O4、Mn3O4-Cu1.5Mn1.5O4样品温度更低,吸附强度更弱,这可能是由于表面的CuO和Cu1.5Mn1.5O4相互影响产生了协同作用。
如图9所示,对于O2的吸附,CuO-Cu1.5Mn1.5O4样品50-250 ℃时(此温度范围正是CO氧化反应发生的温度)弱吸附氧气最多,CuO-Cu1.5Mn1.5O4样品能够改善表面O物种的迁移率和提高表面对氧的吸附能力,表明CuO和Cu1.5Mn1.5O4之间存在着协同效应,这种配合使催化剂中的氧物种更活泼,可以明显改善催化剂的催化性能。分散在Cu1.5Mn1.5O4上的CuO可以起到对O2的富集活化作用[48],在CuO上富集的氧物种和Cu1.5Mn1.5O4上吸附的CO反应生成CO2然后脱附,如示意图10(b)中(2)所示。如图10,Cu1.5Mn1.5O4样品中的(1)途径、CuO-Cu1.5Mn1.5O4样品中的(3)途径、Mn3O4-Cu1.5Mn1.5O4样品中的(4)、(5)途径生成CO2的方式类似,而Mn3O4-Cu1.5Mn1.5O4、Cu1.5Mn1.5O4样品生成CO2缺少(b)图中(2)这条效率高的路径,因此,单位表面的本征活性比CuO-Cu1.5Mn1.5O4样品差。

图10 反应路径示意图Figure 10 Proposed schematic illustrations of reaction paths
3 结 论
采用简单的柠檬酸络合法制备了一系列不同Cu/Mn物质的量比的铜锰尖晶石型纳米晶催化剂。XRD和TEM研究表明,以Cu/Mn物质的量比为2/1的催化剂形成了CuO-Cu1.5Mn1.5O4结构。对于CO氧化反应,CuO修饰的Cu1.5Mn1.5O4具有最高的单位表面活性,这表明表面的CuO和Cu1.5Mn1.5O4相互协同,协同作用源自CuO活化的氧物种和Cu1.5Mn1.5O4活化的CO共同提高了CO氧化的催化活性。
