环糊精促进Burkholderia cepacia 转化胆固醇生成胆甾-4-烯-3,6-二酮
2021-07-28吴梦棋孙柳青杨海麟
武 迪, 张 玲, 吴梦棋, 孙柳青, 王 武, 杨海麟
(江南大学 工业生物技术教育部重点实验室,江苏 无锡214122)
胆固醇是一种重要的甾醇化合物,可以作为甾体类药物的原料[1]。 有些微生物可以切除胆固醇饱和侧链、氧化甾核特定部位,从而得到多种有药用价值的衍生物[2-4]。 利用Mycobacteriumsp.将胆固醇转化为睾酮(TS)[5];利用 Arthrobacter simplex 降解胆固醇成功生产了雄甾-1,4-二烯-3,17-二酮(ADD)[6];利用Rhodococcussp.将胆固醇转化为胆甾-4-烯-3-酮[7]。除上述衍生物外,胆固醇还可被微生物转化为胆甾-4-烯-3,6-二酮[8]。
胆甾-4-烯-3,6-二酮可应用于制备治疗或预防神经元损伤药物[9],亦可用于制造脂质代谢改善剂、饮食品和动物饲料[10],比胆甾-4-烯-3-酮具有更高的医药用价值。胆甾-4-烯-3,6-二酮可通过化学方法合成[11],但化学合成法需使用大量强氧化剂且反应条件剧烈,也可通过微生物的甾体转化获得胆甾-4-烯-3,6-二酮。目前微生物转化甾醇获得胆甾-4-烯-3-酮的报道较多[12-14],但获得胆甾-4-烯-3,6-二酮的报道较少。
底物胆固醇为疏水性有机化合物,不利于与转化体系中细胞的接触和反应, 降低了产物的得率。可将胆固醇用有机溶剂溶解后加入转化体系来解决这一问题[8],但有机溶剂易挥发、易燃易爆、污染环境、对菌体的生长毒害较大,且操作者长时间暴露于有机溶剂环境中,会对其神经系统及呼吸系统造成损伤。 因此,可探索选取更环保廉价的促溶剂。
环糊精(cyclodextrin,简称CD)具有截顶圆锥状空腔结构,内腔疏水,外壁亲水。 对其进行适当的化学修饰,可以得到一系列具有修饰基团的环糊精衍生物,它们可与疏水性物质形成包结络合物,促进反应的进行。 在甾体的转化反应中应用环糊精及其衍生物具有成功的案例[15-18]。向Saccharomyces cerevisiae转化雄烯二酮 (AD) 的体系中添加 α-环糊精(α-CD) 可使其转化率提高 44.44%[19]; 利用Nocardioides simplex转化 AD 生成 ADD 的过程中,添加 β-环糊精(β-CD)使产物转化率达 25%[20];在β-CD 存在下,Rhizopus nigricans对孕酮的生物转化反应速度几乎提高了两倍[21]。然而,在甾体生物转化体系中应用环糊精促溶获得胆甾-4-烯-3,6-二酮的研究目前尚未有报道。
作者前期筛选鉴定获得了一株能够转化胆固醇的Burkholderia cepaciaZWS15(B. cepacia,保藏编号为 CCTCC NO:M2017661), 从B.cepacia转化胆固醇的体系中分离并鉴定出胆甾-4-烯-3,6-二酮, 考察环糊精种类和添加摩尔比对细胞生长、产物转化率的影响。 选取最优的环糊精种类,考察其对胆固醇官能团的包埋效果,以期为环糊精在生物转化胆固醇合成胆甾-4-烯-3,6-二酮的工业应用提供参考和借鉴。
1 材料与方法
1.1 材料与试剂
Burkholderia cepaciaZWS15(CCTCC M2017661)由作者所在实验室前期筛选并鉴定。 固体培养基(g/L):蛋白胨 10,酵母粉 5,NaCl 10,琼脂粉 20;种子培养基(LB 培养基,g/L):蛋白胨 10,酵母粉 5,NaCl 10; 发酵培养基 (g/L): 蔗糖 5, 酵母粉 15,NaNO32,K2HPO4·3H2O 2,KCl 0.5,MgCl21.35,MnCl20.01,CaCl20.055,MgSO41,胆固醇 2(即 5.18 mmol/L);转化培养基(g/L):环糊精具体添加量不同,其余同发酵培养基。 α-环糊精、β-环糊精、γ-环糊精、 甲基-β-环糊精、 羟乙基-β-环糊精、2-羟丙基-β-环糊精、胆固醇、乙酸乙酯、异丙醇、乙腈:均购于国药公司;硅胶板(GF254):购于烟台新诺化工有限公司。
1.2 实验方法
1.2.1 菌种活化 取在-40 ℃甘油管保存的B.cepaciaZWS15,于固体培养基划线分离,在37 ℃恒温培养箱倒置培养24~26 h, 挑取单菌落接种于50 mL LB 液体培养基中,于 37 ℃、200 r/min 摇床培养12 h,即为处于对数生长期的种子液[22]。
1.2.2 羟乙基-β-环糊精-胆固醇包合物的制备称取羟乙基-β-环糊精与胆固醇,使其摩尔比为2∶1。 将羟乙基-β-环糊精与胆固醇置于盛有 10 mL转化培养基的50 mL 离心管中,使用超声细胞破碎仪进行超声乳化,功率400 W,工作时间2 s,间歇时间 2 s,超声乳化15 min。
1.2.3Burkholderia cepacia生长细胞转化胆固醇将处于对数生长期的种子液按体积分数5%接种到装有10 mL 转化培养基的50 mL 摇瓶中。转化培养基中含2 g/L 胆固醇, 环糊精与胆固醇的摩尔比为1∶1。将摇瓶置于 30 ℃、200 r/min 全温摇床柜中培养2 d,通过煮沸或直接用乙酸乙酯萃取终止转化。
1.2.4 薄层层析分离提取转化产物 采用萃取法提取产物。用2 倍体积乙酸乙酯与转化液混合,200 r/min 摇床中振荡 10 min,6 000 r/min 离心 10 min,取上层乙酸乙酯。重复上述步骤,合并有机相。经真空旋转蒸发仪浓缩有机相,用GF254 硅胶板(20 cm×20 cm,1.5~2 mm)分离产物,以V正己烷∶V无水乙醚=2∶3 作为展开剂。
1.2.5 质谱、核磁和红外光谱鉴定产物结构 质谱分析(LC-MS)检测产物的相对分子质量(沃特世质谱仪 MALDI SYNAPT MS); 核磁共振碳谱 (13CNMR)、核磁共振氢谱(1H-NMR)测定产物碳和质子的信号 (布鲁克核磁共振波谱仪Aduance Ⅲ 400 MHZ), 温度 25 ℃, 溶剂 CDCl3, 以四甲基硅烷(TMS)作为内标;傅立叶变换红外光谱仪(FT-IR)检测产物的官能团 (赛默飞红外光谱仪Nicolet is10)。 为进一步确认产物结构,除对测得的数据进行分析外, 还将获得的数据与相关文献和National Institute of Advanced Industrial Science and Technology 数据库中的信息进行比对。
1.2.6 高效液相对产物定量分析 用高效液相色谱法 (HPLC) 定量分析产物。 色谱柱为 ZORBAX Eclipse XDB-C18(4.6 mm×250 mm,5 μm),V乙腈∶V异丙醇=90∶10 作为流动相,流量 0.8 mL/min,进样量 10 μL,检测波长249 nm,柱温30 ℃,每批次做3 个平行实验。
取分离鉴定后的纯产物作为标准品。 用异丙醇溶解产物,配制成不同浓度梯度的溶液,0.45 μm 有机膜过滤后进行HPLC 测定。 以产物质量浓度为横坐标、峰面积为纵坐标做曲线,所得即为产物标准曲线。
根据上述标准曲线计算产物产量,根据下式计算产物的转化率[23]:
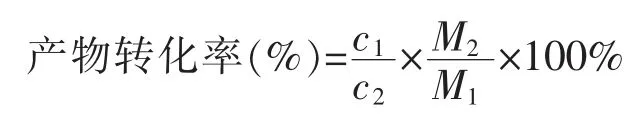
式中:c1为产物质量浓度,mg/mL;c2为底物初始质量浓度,mg/mL;M1为产物摩尔质量,g/mol;M2为底物摩尔质量,g/mol。
2 结果与讨论
2.1 B. cepacia 转化胆固醇的产物结构鉴定
菌株在LB 培养基活化后接种于发酵培养基,在200 r/min、30 ℃全温摇瓶柜中培养2 d, 按1.2.4中方法分离纯化其中一种转化产物。
利用 LC-MS、FT-IR、NMR 等技术对该物质的相对分子质量、官能团、C 及质子信号等结构信息进行了鉴定。 经LC-MS 检测该产物相对分子质量为398.4。
图 1 为该物质的红外光谱图,1 700.32 和1 682.67 cm-1、1 603.52 cm-1的吸收峰分别是—C=O、—C=C—的伸缩振动吸收峰,表明该物质中含有两个—C=O 和一个—C=C—, 推测其分子式为C27H42O2。 在误差范围内,这与 Hunter AC 等报道的胆甾-4-烯-3,6-二酮红外光谱信息一致[24]。
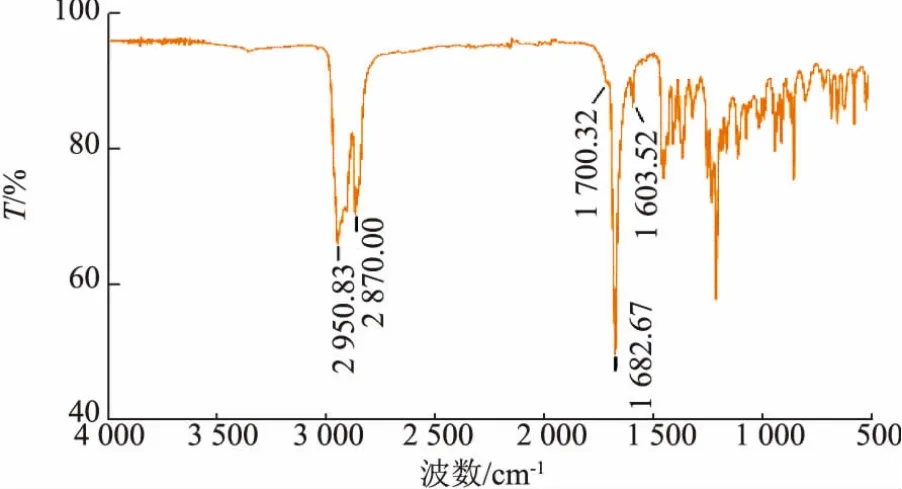
图1 胆固醇转化产物红外光谱分析Fig. 1 FT-IR analysis of cholesterol conversion product
通过13C-NMR 测定不同位碳的化学位移(δ),确认该产物酮基的数量和位置, 见图 2(a),13C-NMR(101 MHz,Chloroform-d)信息详见表 1。 其中δ 202.31 与δ 199.69 是酮基的特征吸收峰,表示C6 和 C3 位为酮基。 δ 161.07 和 δ 125.44 是碳碳双键的特征吸收峰, 双键位于C4 和C5 之间。 这与Hunter AC 等报道的胆甾-4-烯-3,6-二酮核磁共振碳谱信息一致[24]。
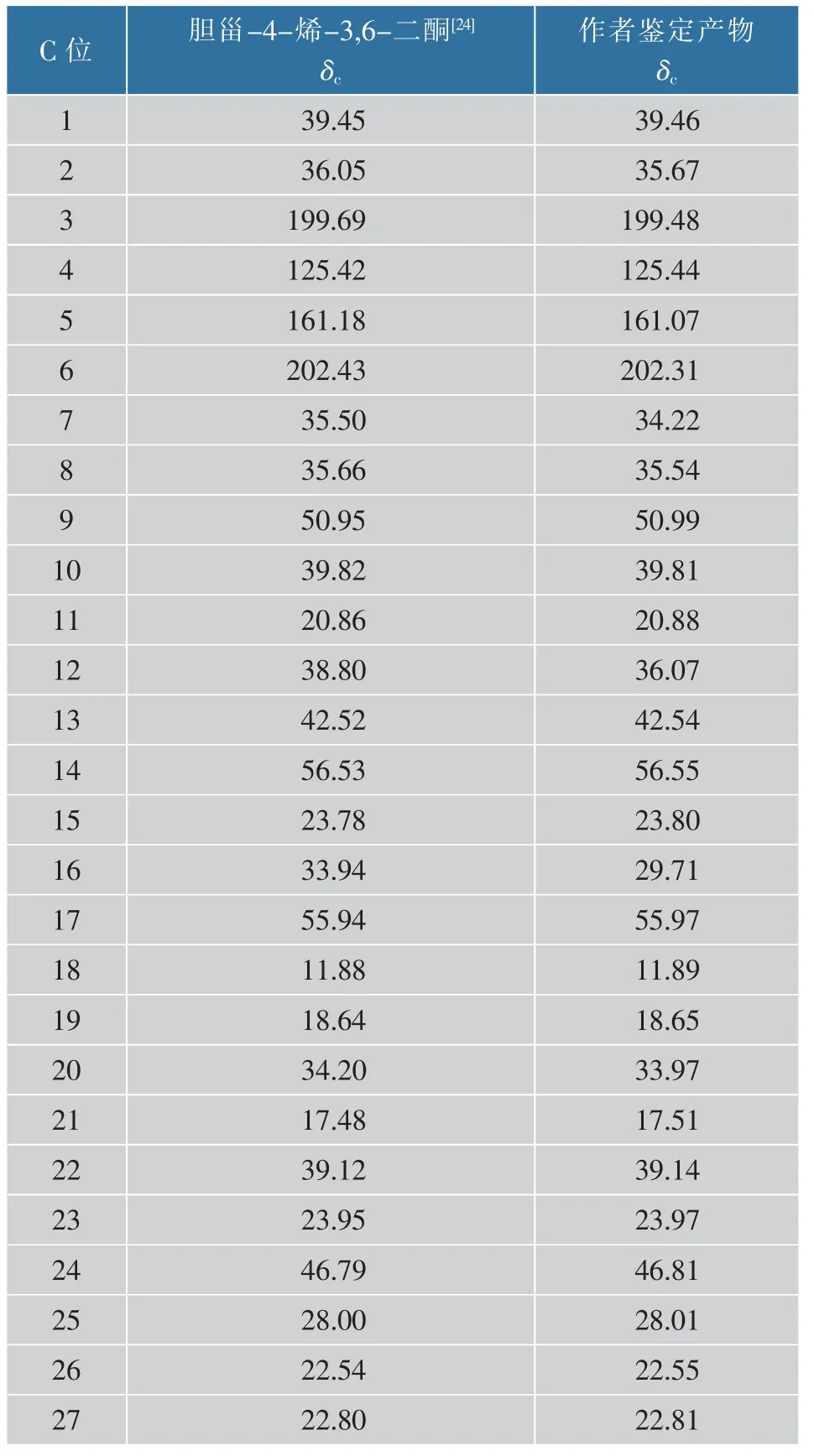
表1 鉴定产物与胆甾-4-烯-3,6-二酮13C-NMR 谱对比Table 1 Comparison of 13C-NMR spectrum of the product identified here with that of cholest-4-ene-3,6-dione
通过1H-NMR 谱测定该产物氢原子总数及特定位的质子信号,见图 2(b)。 δ 7.07 为 CDCl3特征吸收峰。δ 6.17 为单峰,是C4 位上的一个H,以该峰为标峰, 对谱图积分, 氢原子总数为42。1H-NMR(400 MHz,Chloroform-d) 信息见表 2。 在误差范围内, 与 CUI JG 等报道的胆甾-4-烯-3,6-二酮核磁共振氢谱一致[25]。
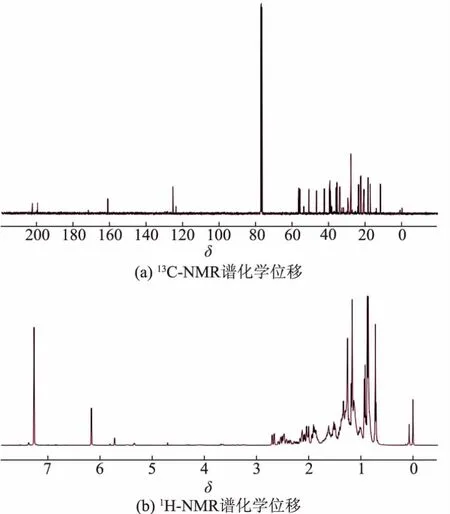
图2 胆固醇转化产物核磁共振波谱Fig. 2 NMR spectra of cholesterol conversion product
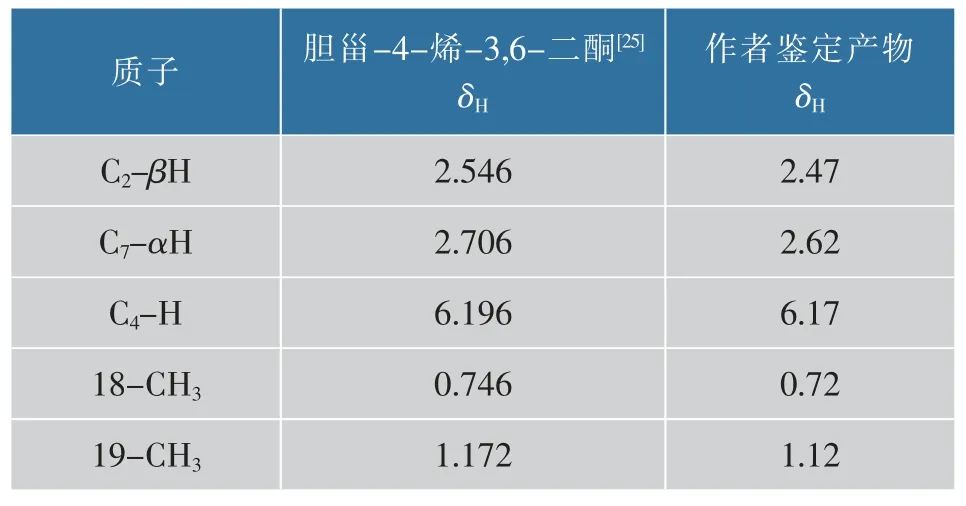
表2 鉴定产物与胆甾-4-烯-3,6-二酮1H-NMR 谱的对比Table 2 Comparison of 1H-NMR spectrum of the product identified here with that of cholest-4-ene-3,6-dione
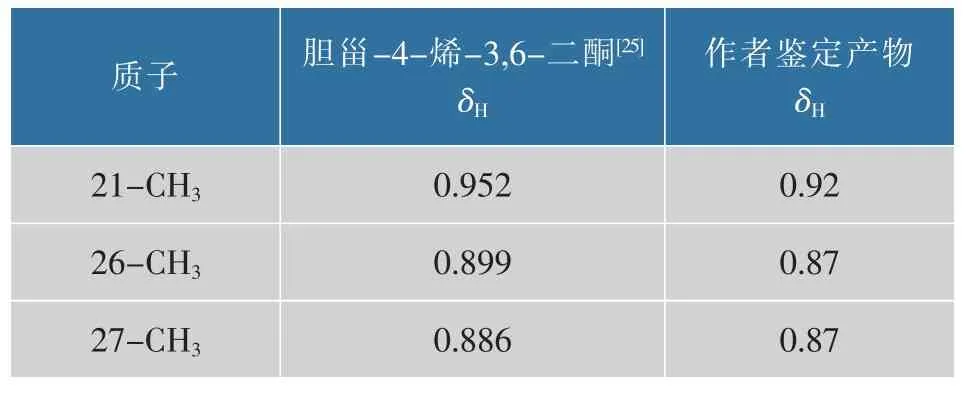
续表2
综上所述,在误差范围内,该产物质谱、红外光谱、 核磁共振波谱信息鉴定该物质为胆甾-4-烯-3,6-二酮,见图 3。
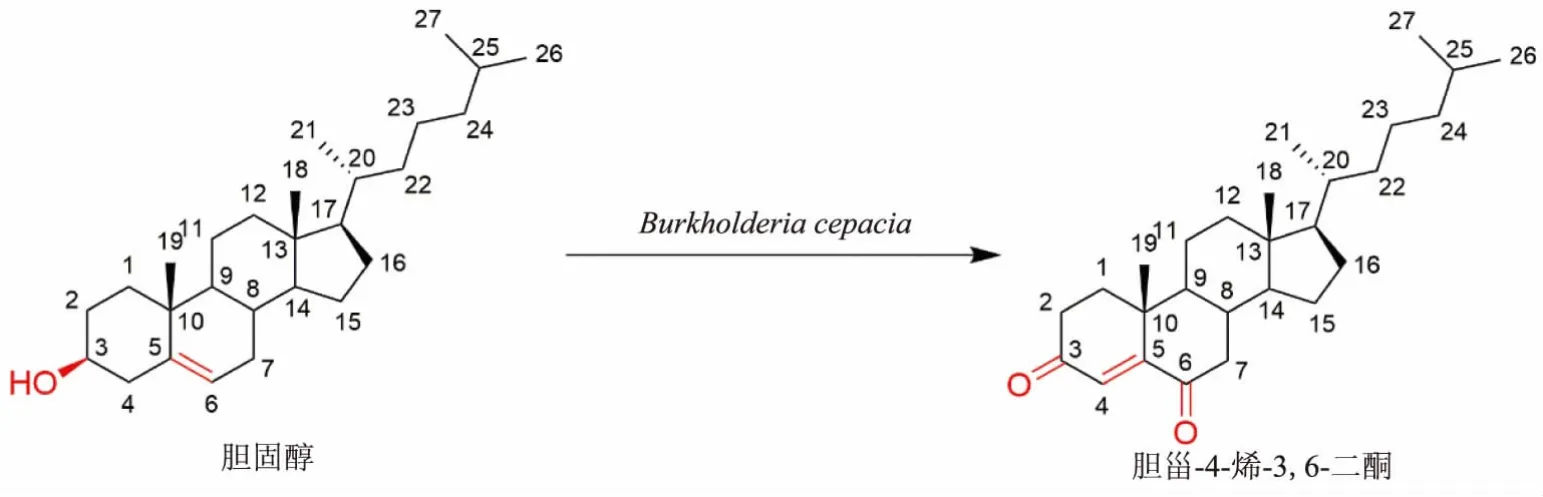
图3 B. cepacia 转化胆固醇生成胆甾-4-烯-3,6-二酮Fig. 3 Biotransfomation of cholesterol to cholest-4-ene-3,6-dione by B. cepacia
对比类似酮基产物的基本结构信息见表3,进一步确定Burkholderia cepaciaZWS15 转化胆固醇的产物为胆甾-4-烯-3,6-二酮,而不是目前报道较多的胆甾-4-烯-3-酮。
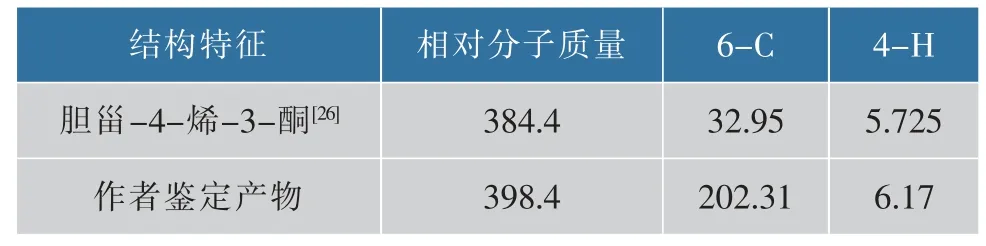
表3 分离产物与胆甾-4-烯-3-酮的结构信息对比Table 3 Comparison of structural information between the isolated product of this study and cholest-4-en-3-one
2.2 不同种类环糊精对胆甾-4-烯-3,6-二酮产率的影响
由于环糊精及其衍生物具有内腔疏水,外壁亲水的特性,且在生物转化过程中环糊精仅对细胞的形态造成小幅度影响而不至于使其凋亡,提高了菌体细胞的通透性,有助于生物转化的进行[27]。故选取α-环糊精(α-CD)、β-环糊精(β-CD)、γ-环糊精(γ-CD)、甲基-β-环糊精(M-β-CD)、羟乙基-β-环糊精(HE-β-CD)、羟丙基-β-环糊精(HP-β-CD)分别加入B. cepacia转化胆固醇的体系中,考察对胆甾-4-烯-3,6-二酮产率的影响。
在转化过程中恒定胆固醇的初始添加量为2 g/L(即 5.18 mmol/L)。 按环糊精与胆固醇摩尔比 1∶1 向转化培养基中添加环糊精并转化2 d, 环糊精及胆固醇预先使用60 W 超声波乳化15 min。
不同种类环糊精及衍生物对胆甾-4-烯-3,6-二酮转化率的影响见图4(a)。由于胆固醇的低水溶度,不添加任何环糊精时,胆甾-4-烯-3,6-二酮的转化率仅为 0.2%。添加 M-β-CD、HE-β-CD 的实验组,胆甾-4-烯-3,6-二酮转化率大幅提高,分别为对照组的 27.55 倍和 37.95 倍。 在 α-CD、β-CD、γ-CD、HP-β-CD 存在下,胆甾-4-烯-3,6-二酮的转化率约为对照组的1.75~3.95 倍。
进一步考察了HE-β-CD 添加量对转化率的影响,结果见图 4(b)。 当 HE-β-CD 与胆固醇摩尔比为 2∶1 时,胆甾-4-烯-3,6-二酮转化率为 12.1%,比HE-β-CD 与胆固醇摩尔比为1∶1 的转化率提高了59.42%。
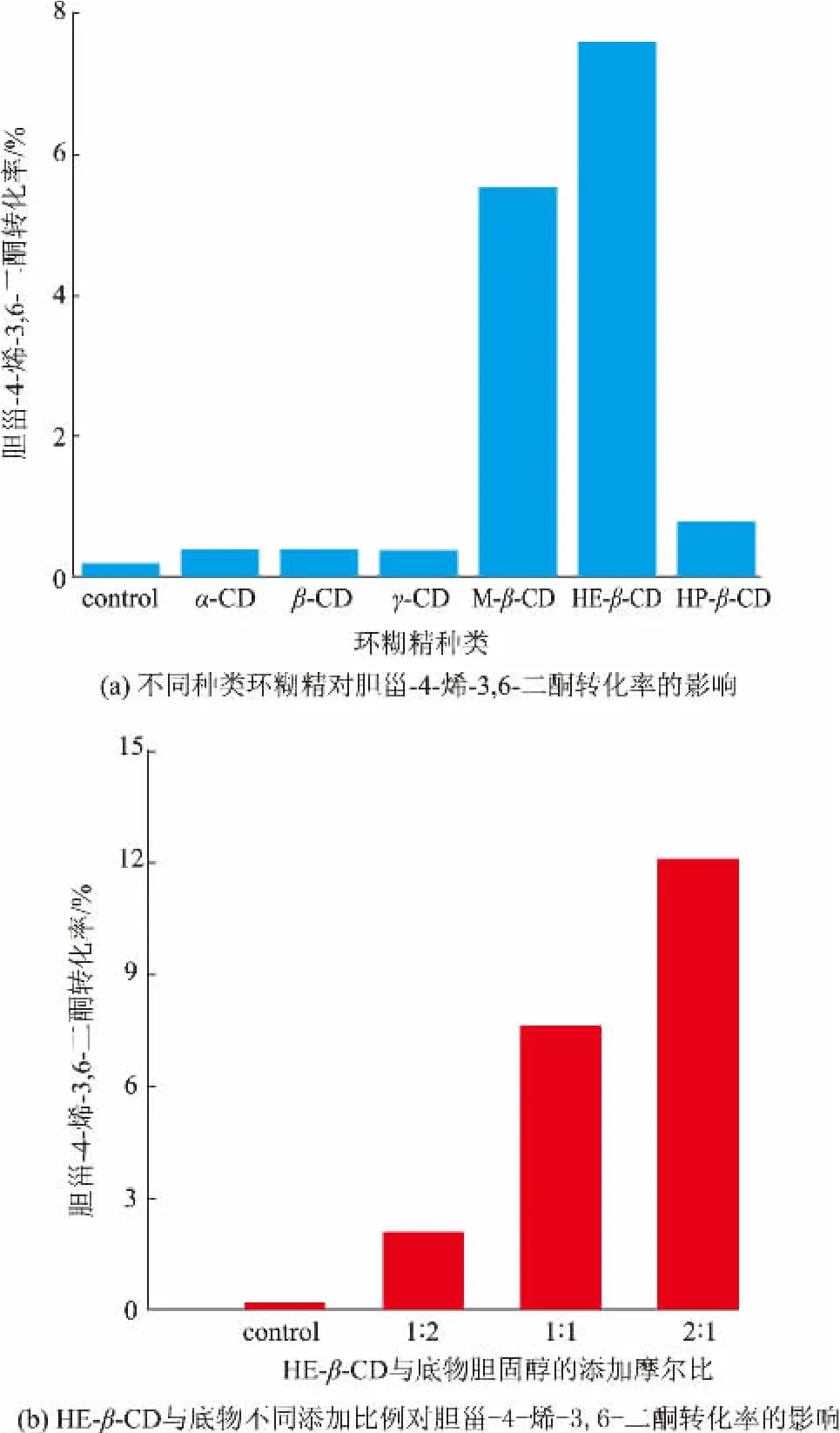
图4 环糊精对胆甾-4-烯-3,6-二酮转化率的影响Fig. 4 Effect of cyclodextrin on the yield of cholest-4-ene-3,6-dione
与对照组(不添加环糊精)相比,所选的环糊精均能促进胆甾-4-烯-3,6-二酮的生成,表明这几种环糊精对胆固醇都有不同程度的包被[28-29]。 产物转化率最高的为添加羟乙基-β-环糊精 (HE-β-CD)组。 当 HE-β-CD 与胆固醇的摩尔比为 2∶1 时,产物的转化率不仅是对照组(不添加环糊精)的60 倍,还比HE-β-CD 与胆固醇的摩尔比为1∶1 组的转化率提高了59.42%。 与其他环糊精相比,羟乙基-β-环糊精(HE-β-CD)可能更有效包被了胆固醇的官能团,提高了与细菌细胞的接触效率,从而提高了产物的转化率。
2.3 红外光谱检测羟乙基-β-环糊精对胆固醇官能团的包埋
为了进一步表征HE-β-CD 对胆固醇官能团或部位的包埋情况,分别对胆固醇、HE-β-CD-胆固醇包合物(摩尔比为 2∶1)和 HE-β-CD 进行红外光谱分析,结果见图5。
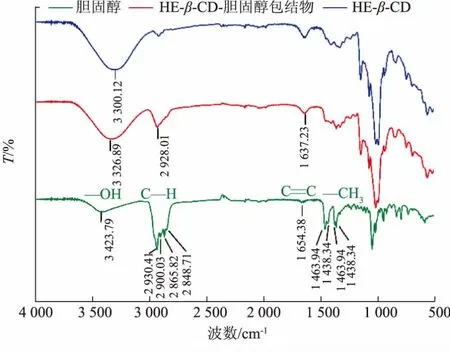
图5 红外光谱分析羟乙基-β-环糊精包埋胆固醇效果Fig. 5 FT-IR spectra of HE-β-CD-embedded cholesterol
3 423.79 cm-1为胆固醇C3 位羟基伸缩振动吸收峰,在HE-β-CD/胆固醇包合物的红外谱图中,羟基伸缩振动吸收峰依然存在, 这说明羟基没有被HE-β-CD 包埋; 而羟基伸缩振动频率向低频位移至 3 326.89 cm-1, 表明胆固醇与 HE-β-CD 的羟基之间可能形成了氢键。2 930.41、2 900.03、2 865.82、2 848.71 cm-1为饱和烃的C—H 伸缩振动吸收峰,在HE-β-CD/胆固醇包合物中, 这些吸收峰的强度明显减弱,说明胆固醇该处基团被HE-β-CD 包结。胆固醇1 654.38 cm-1碳碳双键吸收峰在HE-β-CD/胆固醇包合物中依然存在, 表明 C5 和C6 间的—C=C—没有被包埋, 根据胆固醇的结构式分析,HE-β-CD 将胆固醇甾核 A 环包埋。
胆固醇 C26、27 位偕二甲基于 1 463.94、1 376.34 cm-1裂分为双峰 (1 463.94、1 438.34 cm-1为一个甲基吸收峰;1 376.34、1 364.71 cm-1为另一个甲基吸收峰),双峰信号在HE-β-CD/胆固醇包合物中几乎消失, 表明侧链的C26、27 位甲基均被HE-β-CD 包埋。
综合上述,HE-β-CD 与胆固醇的摩尔比为 2∶1时之所以能够提高胆甾-4-烯-3,6-二酮的转化率,可能是因为HE-β-CD 通过分子间的非极性共价键对底物胆固醇甾核的A 环、侧链的C26 和C27 进行包被,形成稳定的包结物(见图6),进而提高了胆固醇与菌体的接触效率[30]。
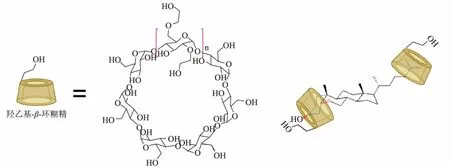
图6 羟乙基-β-环糊精与胆固醇包结物构象示意图Fig. 6 Schematic diagram of the conformation of hydroxyethyl-β-cyclodextrin and cholesterol inclusion complex
3 结 语
作者对Burkholderia cepaciaZWS15 转化胆固醇的产物进行分离纯化,通过LC-MS、FT-IR、NMR等技术进行结构鉴定,获得了一种产物胆甾-4-烯-3,6-二酮。
通过考察 6 种环糊精 (α-CD、β-CD、γ-CD、M-β-CD、HE-β-CD、HP-β-CD)对菌体的影响,这几种环糊精的添加几乎不影响菌体的生长。
向转化培养基中添加与胆固醇摩尔比为1∶1 的环糊精,发现添加 α-CD、β-CD、γ-CD、HP-β-CD 的体系中,胆甾-4-烯-3,6-二酮的转化率约为对照组的1.75~3.95 倍;添加β-CD 种类的转化体系中,M-β-CD 和HE-β-CD 的效果较好,转化率分别为对照组的27.55 倍和37.95 倍。
进一步考察了HE-β-CD 与底物胆固醇摩尔比对产物转化得率的影响, 发现当二者摩尔比为2∶1时, 胆甾-4-烯-3,6-二酮摩尔转化率为 12.1%,比HE-β-CD 与胆固醇摩尔比为1∶1 的转化率提高了59.42%。
对 2 mol HE-β-CD 与 1 mol 胆固醇的包合物进行红外光谱分析,结果表明,胆固醇甾核的A 环及侧链的C26、C27 信号在包合物中消失,推测可能是因为2 mol HE-β-CD 可通过分子间的非极性共价键与1 mol 胆固醇形成了稳定的包结物, 这为HE-β-CD 在生物转化合成胆甾-4-烯-3,6-二酮的工业应用提供了借鉴。
