巨噬细胞识别酿酒酵母孢子的研究
2021-07-28中西秀树高晓冬
汪 沁, 中西秀树, 高晓冬
(江南大学 生物工程学院,江苏 无锡 214122)
酿酒酵母是公认的有益于人类的真菌[1],在营养条件充足的情况下它进行有丝分裂,此时的酵母以营养态细胞状态存在。 但是,在碳源或氮源等营养条件匮乏的情况下, 酿酒酵母为了传宗接代,会进行减数分裂,产4 个孢子包裹于子囊中[2-3]。 营养态酵母细胞壁有两层,分别是内层葡聚糖层和外层的甘露糖蛋白层[4-5]。 酵母孢子壁有4 层,从内到外依次是甘露糖层、葡聚糖层、壳聚糖层和二酪氨酸层[6]。 二酪氨酸层是酵母孢子壁特有的结构,其单体是由两个甲基酪氨酸分子构成[7]。 这种特殊的孢子壁结构能帮助减数分裂后的细胞核抵御严酷的大自然环境,等待适宜的生长环境,从而发芽成长,再次成为营养细胞形态,维持酵母的繁衍[4]。
巨噬细胞属于免疫细胞的一种,能够吞噬和降解外源颗粒以及微生物并激活免疫反应。 巨噬细胞的吞噬过程依赖于细胞表面的模式识别受体(pattern recognition receptor,PRR), 该受体能够识别微生物表面保守的分子模式 (microbe associated molecular pattern,MAMP)并且激活受体上酪氨酸基序 (immunoreceptor tyrosine-based activation motif,ITAM)[8-9]。 被激活的ITAM 序列进一步招募脾酪氨酸激酶(spleen tyrosine kinase,Syk)启动巨噬细胞的吞噬过程[10-11]。 Syk 信号能够激活诸如磷脂酶Cγ(PLCγ) 和磷脂酰肌醇 3-激酶(Phosphoinositide 3-kinase,PI3K)等下游信号,从而增加吞噬效率[11-13]。吞噬过程中,较大颗粒(>2 μm)吞噬依赖于 PI3K的活性[14]。 巨噬细胞对微生物表面分子模式的识别是启动直接吞噬的第一步[15]。 微生物表面的糖链结构的特殊性使其被巨噬细胞所识别从而引起吞噬[16-17]。
自然条件下,多数酵母处于营养细胞态。 营养态酵母壁的葡聚糖成分能够被巨噬细胞表面葡聚糖受体识别从而引起吞噬,促进巨噬细胞炎症因子TNF-α、IL-1、IL-2、IL-6 和 IL-12 的释放[18-20],葡聚糖也能够与细菌结合从而抑制细菌在胃肠道增殖从而达到抑菌的作用[21]。 营养态酵母壁的几丁质成分也能刺激巨噬细胞分泌细胞因子TNF-α 和IL-6,并且增强巨噬细胞对假丝酵母的杀伤作用[22]。 营养态酵母壁上这些免疫活性物质的存在使得营养态酵母作为饲料添加物能够增强牛和猪的免疫力[23-25]。
酿酒酵母虽为与人类共生的真菌,但目前其子囊孢子形态对免疫系统的作用很大程度上未知,酵母孢子的葡聚糖层被壳聚糖层和二酪氨酸层严密包裹,其免疫活性物质未知。作者以小鼠RAW264.7细胞作为巨噬细胞模型,研究了巨噬细胞识别和吞噬酵母孢子的作用机制,为后续探究野生型酵母孢子免疫作用提供参考。
1 材料与方法
1.1 实验菌株
作者使用高效产孢率的AN120二倍体酿酒酵母菌株,以及dit1Δ 和chs3Δ 突变体菌株,均来自作者所在实验室保藏菌株,相关信息见表1。
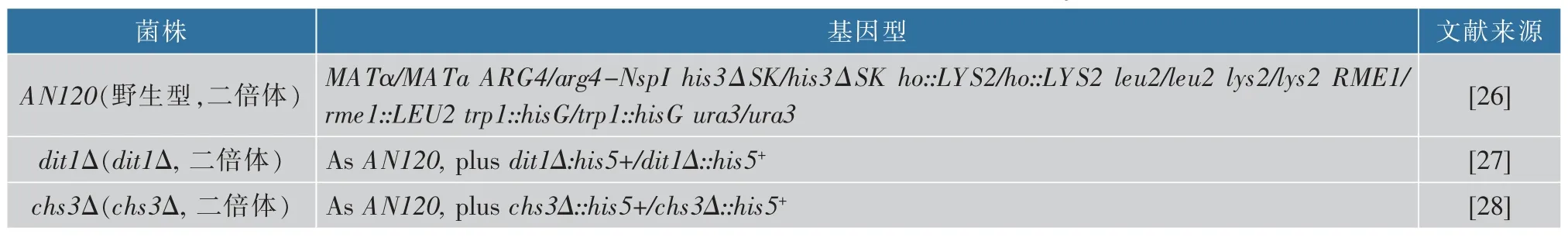
表1 本研究中所用的酵母菌株Table 1 S. cerevisiae strains used in this study
1.2 细胞及培养
RAW264.7 小鼠巨噬细胞, 购自中科院菌种保藏库,用含有 10% 胎牛血清(FBS)的 DMEM 培养基培养,条件为 5% CO2,37 ℃。
1.3 培养基
YPAD 培养基:蛋白胨A 10 g,酵母提取物5 g,腺嘌呤15 mg 溶解于450 mL 去离子水中, 灭菌后加入50 mL 质量浓度为20 g/dL 的葡萄糖混匀。 固体培养基则加入琼脂(Agar)10 g 一起灭菌,之后加入葡萄糖混匀,倒平板。
YPAce 培养基:蛋白胨A 20 g,酵母提取物10 g,腺嘌呤30 mg, 醋酸钾10 g 溶解于1 L 去离子水中,高压湿热灭菌。
KAc 培养基:称取20 g KAc 溶于1 L 去离子水中,固体培养基加入20 g 的琼脂粉,高压灭菌,倒平板。
1.4 主要试剂和仪器
主要试剂有:DMEM 高糖培养基(Gibco),胎牛血清(Gibco),昆布糖(Sigma),葡聚糖微球(Sigma),PBS(生工),胰蛋白酶(生工),蛋白酶 K(Sigma),溶菌酶(Sigma);主要仪器有:细胞培养箱(Thermo),离心机(Takara),显微镜(日立)等。
1.5 酵母培养
酵母菌株于固体YPAD 平板划线培养3 d 后,用粗头牙签接种于5 mL YPAD 液体培养基, 转接于100 mL 液体YPAD 培养基培养3~5 h,使酵母处于对数生长期并且OD660为0.6~0.8, 此时收集营养态酵母, 用0.5% 吐温-20 洗3 次后再用去离子水洗 3 次,3 000 r/min 离心,称质量备用。 酵母孢子的制备: 营养态酵母过夜培养后, 取10 mL 转接到200 mL 的YPAce 培养基中,培养12 h 后离心转移到2% KAc 培养基后续培养2 d; 离心收集子囊酵母,当产孢率大于95% 时,离心收集菌体,PBS 洗2次, 加入 5 mL 原生质体溶液 (1.2 mol/L 山梨醇,0.1 mol/L PBS)和 50 μL(10 000 U/mL)溶菌酶,于25 ℃ 摇床处理3 h;原生质体溶液洗2 次,去离子水洗2 次,加入5 mL 去离子水超声20 min(45%功率,超声 5 s,停 2 s),用 0.5%吐温-20 洗 3 次后再用去离子水洗3 次, 显微镜观察孢子纯化效果,将纯化后孢子制备成100 mg/mL 的孢子悬液。
1.6 巨噬细胞培养和吞噬实验
RAW264.7 小鼠巨噬细胞置于含10% 灭活牛血清的DMEM 高糖培养基培养,用含EDTA 的胰酶消化后传代。 12 孔板每孔接种5×105个细胞,培养24 h 后,每孔加入相同质量的营养态酵母或者酵母孢子, 每组设置 5 个平行,1 300 r/min 离心 3 min,使酵母落到细胞表面, 后续培养30 min,PBS 洗3次,胰酶消化收集细胞于离心管,4% 多聚甲醛固定10 min,PBS 洗 3 次。显微镜镜检并统计每 100 个巨噬细胞吞噬营养态酵母或孢子的个数。
1.7 药物抑制实验
用培养基将母液浓度为10 mmol/L 的Syk 抑制剂白皮杉醇稀释为 25 μmol/L 或 50 μmol/L 的工作浓度;用培养基将母液质量浓度为1 mg/mL 的PI3K抑制剂渥曼青霉素稀释为100 ng/mL 或200 ng/mL。进行抑制实验时,细胞接种于12 孔板培养24 h,更换为含有白皮杉醇或渥曼青霉素的培养基并于37 ℃孵育30 min,加入1 mg 营养态酵母或1 mg 酵母孢子或200 μg 葡聚糖微球,离心并后续培养30 min,统计相对吞噬效率。

1.8 无血清吞噬实验
营养态酵母或孢子与巨噬细胞共培养前,更换不含血清的DMEM 高糖培养基或含有10% 血清的培养基处理2 h, 随后更换为处理组对应的培养基并分别加入1 mg 的营养态酵母或酵母孢子,1 300 r/min 离心 2 min 后共培养 30 min, 统计吞噬效率。
1.9 高盐以及蛋白酶处理对孢子吞噬效率的影响
野生型酵母孢子经高盐 (0.6 mol/L NaCl 或1 mol/L PBS)洗涤后,去离子水洗3 次,离心称质量。 蛋白酶处理野生型酵母孢子时,取野生型酵母孢子100 mg, 按照以下反应进行:50 mmol/L Tris-HCl(pH 7.5),5 mmol/L CaCl2,加入 200 μL 蛋白酶K (600 U/mL), 于 37 ℃ 处理 1 h, 之后用 0.5%吐温-20 洗涤 3 次,去离子水洗涤 3 次,超声 30 s,制备成100 mg/mL 的孢子悬液。 比较处理组与未处理组吞噬效率。
1.10 单糖或者多糖抑制实验
用培养基配制终质量浓度为1 mg/mL 的昆布糖培养液以及5 mg/mL 的甘露糖、甘露聚糖、半乳糖、乳糖以及盐藻糖培养液,取1 mL 上述含糖培养液和细胞共孵育30 min 之后, 加入1 mg 的营养态酵母或1 mg 酵母孢子或200 μg 葡聚糖微球,离心后进行吞噬实验并且统计相对吞噬效率。
1.11 野生型孢子和突变体孢子吞噬实验
取 1 mg 的野生型酵母孢子、dit1Δ 孢子和chs3Δ 孢子,按照1.6 方法进行吞噬实验。
1.12 统计分析
采用Graphprism 软件对数据进行分析作图,所有数据以平均值+标准差表示。 用单因素或双因素方差分析(One-Way or Two-Way ANOVA)检验组间的差异。 检验标准P<0.05 表示差异有统计学意义,每次实验重复5 次。 对于本实验统计结果,标记如下:P≥0.05 标记为 ns;0.01<P<0.05 标记为 *;0.001<P≤0.01 标记为 **;P≤0.001 标记为 ***;P≤0.000 1 标记为 ****。
2 结果与分析
2.1 巨噬细胞内吞野生型酵母孢子效率高于营养态酵母
营养态酵母壁和野生型酵母孢子壁的结构有所不同,比较巨噬细胞对营养态酵母和野生型酵母孢子的响应,结果见图1(a)。 随着营养态酵母或野生型酵母孢子质量浓度的增加,巨噬细胞吞噬营养态酵母和野生型孢子的数目呈上升趋势。 当营养态酵母和孢子质量均为1 mg 时, 巨噬细胞吞噬营养态酵母和孢子的情形见图1(b)。 统计分析表明,此时每100 个巨噬细胞吞噬酵母或孢子的个数分别为35 个和320 个。 质量为1 mg 时,酵母孢子个数约为营养态酵母个数的3.7 倍, 此时孢子被吞噬个数约为营养态酵母个数的9 倍。 这表明巨噬细胞对酵母孢子内吞效率显著高于营养态酵母。
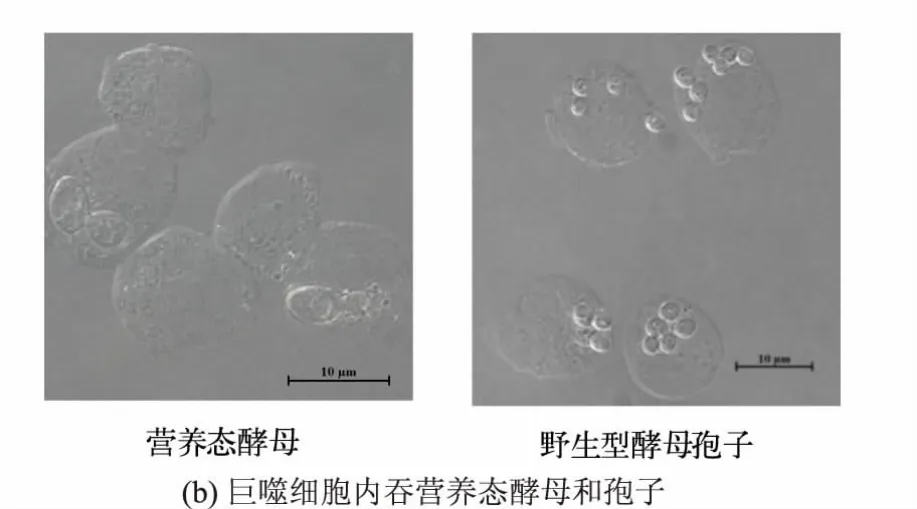
图1 巨噬细胞对营养态酵母和野生型酵母孢子吞噬效率比较(± SD,n=5)Fig. 1 Phagocytosis efficiency of vegetative yeast and wild type spores(± SD,n=5)
2.2 巨噬细胞对酵母孢子的内吞是依赖于Syk 和PI3K 的吞噬过程
巨噬细胞对大颗粒微生物的内吞主要是通过巨胞饮和吞噬过程[29]。 巨胞饮指的是细胞依赖于细胞膜流动性的非特异内吞大颗粒过程[30];吞噬过程指的是免疫细胞膜上受体介导的并且依赖于Syk途径的内吞过程[10,31]。 已有的研究表明,巨噬细胞吞噬葡聚糖微球依赖于Syk, 通过白皮杉醇抑制Syk能够抑制巨噬细胞对葡聚糖微球的吞噬[32]。 利用Syk 抑制剂白皮杉醇阻断Syk 所介导的信号通路见图2(a)。 与对照组相比,增加白皮杉醇的浓度会增强抑制巨噬细胞对葡聚糖微球、营养态酵母和野生型孢子的吞噬作用,这表明巨噬细胞对野生型酵母孢子和酵母的内吞途径是依赖于Syk 受体介导的吞噬过程。 有研究表明,巨噬细胞吞噬较大颗粒依赖于PI3K[33],配制不同浓度的渥曼青霉素测定其对巨噬细胞吞噬营养态酵母和野生型酵母孢子的影响。如图2(b)所示,与对照组相比,渥曼青霉素对巨噬细胞吞噬酵母和葡聚糖微球无显著影响;随着渥曼青霉素质量浓度的增加,其对巨噬细胞吞噬野生型酵母孢子的抑制作用增强。 这表明尽管野生型孢子直径小于营养态酵母,其吞噬途径是极其依赖于PI3K 的过程,而营养态酵母的吞噬过程不是显著依赖于PI3K 的过程。 因此,巨噬细胞对营养态酵母和野生型酵母孢子的吞噬依赖Syk 下游不同激酶,表明巨噬细胞吞噬营养态酵母和孢子所依赖的信号途径不同。
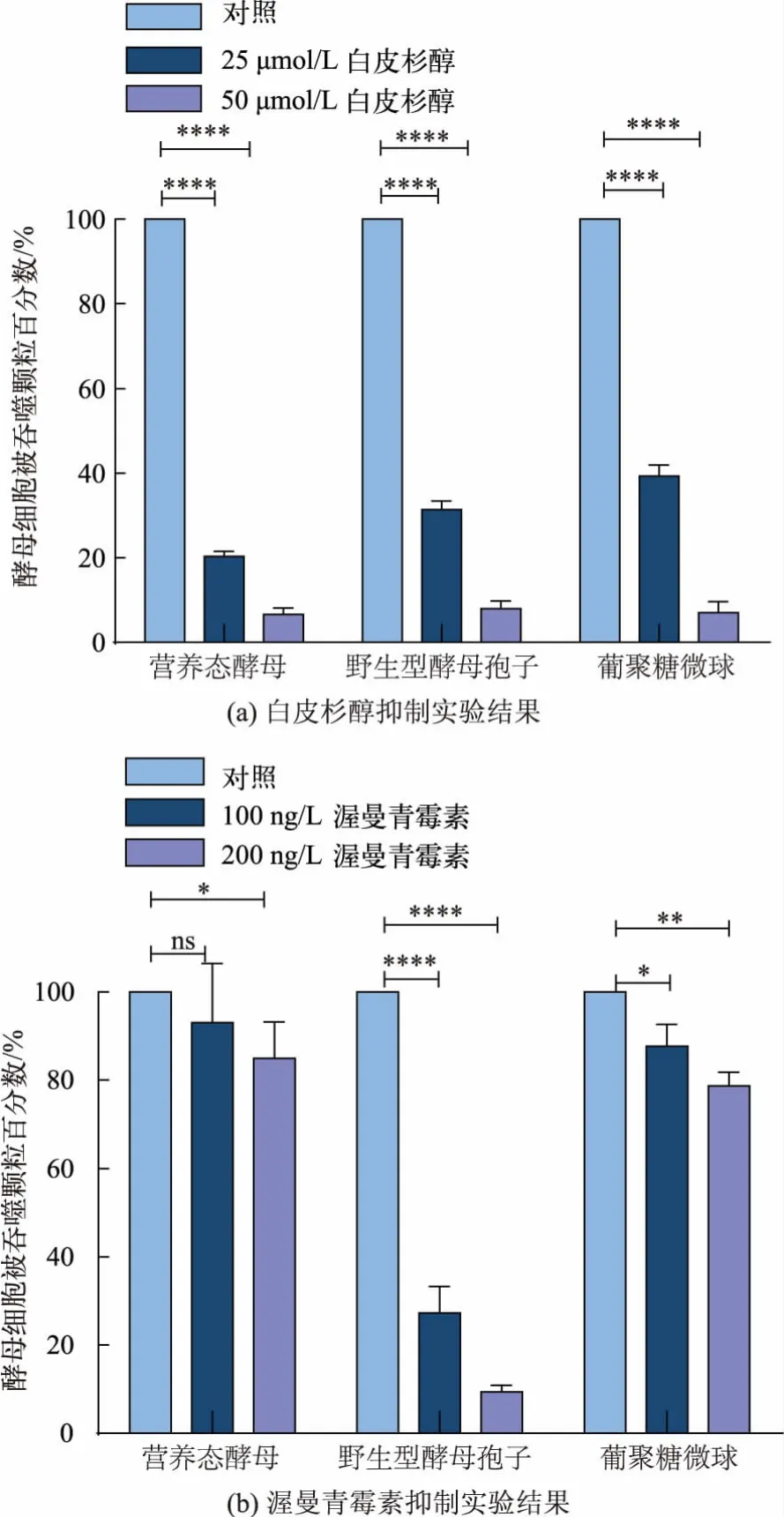
图 2 Sky 抑制剂白皮杉醇或PI3K 抑制剂渥曼青霉素对巨噬细胞内吞营养态酵母、野生型酵母孢子和葡聚糖微球的影响(± SD,n=5)Fig. 2 Sky inhibitor picetannol or PI3K inhibitor wortmannin effect on the phagocytosis efficiency of vegetative yeasts,wild type yeast spores and glucan microspheres(± SD,n=5)
2.3 巨噬细胞对野生型酵母孢子的吞噬不依赖于血清调理
为了探究巨噬细胞对酵母孢子识别是否依赖于血清中补体或抗体成分,检测无血清培养基对吞噬野生型孢子效率的影响。 如图3(a) 所示,每100个巨噬细胞于有、无血清情况下吞噬营养态酵母和野生型酵母孢子的个数分别为 42、38 和338、322,统计分析无显著性差异,这表明巨噬细胞对营养态酵母或野生型酵母孢子的吞噬不依赖于血清中补体和免疫球蛋白成分。 图3(b)显示,无血清条件下摄入营养态酵母或野生型孢子的巨噬细胞占总细胞的比率分别为18%和83%,这表明巨噬细胞对野生型孢子有更高效的内吞作用。 因此,巨噬细胞对野生型孢子的吞噬不是依赖于血清中补体和抗体调理导致的间接吞噬,这种吞噬极有可能是孢子表面存在的物质被巨噬细胞识别从而引起吞噬。
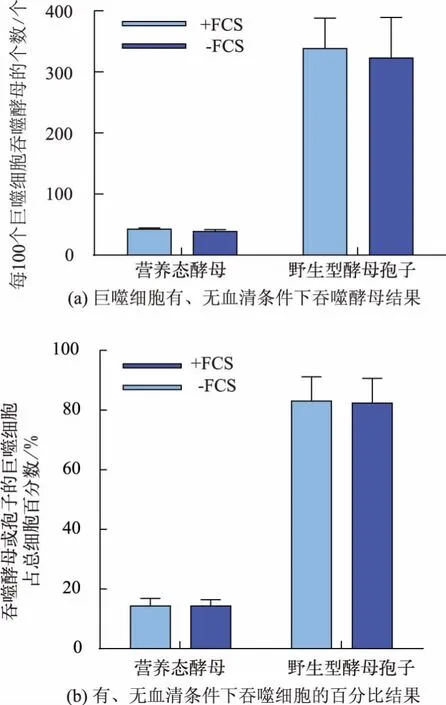
图 3 血清对吞噬的影响(± SD,n=5)Fig. 3 Effect of serum on phagocytosis efficiency of vegetative yeast and spores(± SD,n=5)
2.4 巨噬细胞吞噬酵母孢子的配体为共价结合到孢子壁的非蛋白质成分
为了进一步探究孢子壁上何种物质作为分子配体导致野生型酵母孢子的高效吞噬,通过高盐洗涤除去吸附在野生型酵母孢子壁上的分子,利用蛋白酶处理孢子壁并比较其吞噬效率。 如图4 所示,处理后的酵母孢子吞噬效率与对照组吞噬效率无显著差异,这表明野生型孢子表面被巨噬细胞识别的主要配体不是吸附于二酪氨酸层的物质,而是共价结合到二酪氨酸层的物质,并且这种分子配体物质不是蛋白质。

图4 高盐洗脱和蛋白酶处理对巨噬细胞吞噬野生型酵母孢子的影响(± SD,n=5)Fig. 4 Effect of high salt treatment and proteinase K treatment on the phagocytosis efficiency of wild type spores(± SD,n=5)
2.5 巨噬细胞吞噬营养态酵母依赖于葡聚糖配体,而酵母孢子不依赖
微生物表面的糖链能够被巨噬细胞所识别,从而引起吞噬[34]。 为了探究巨噬细胞吞噬营养态酵母和野生型酵母孢子与糖链配体是否有关,通过一系列糖链作为配体竞争抑制剂。 昆布糖(直链的葡聚糖)能够抑制由于酵母葡聚糖配体引起的吞噬[35-36],因此选取昆布糖作为对照组。 从图5 可知,昆布糖能够显著地抑制巨噬细胞对营养态酵母和葡聚糖微球的吞噬,但对野生型酵母孢子的吞噬无显著影响。 图5 表明,甘露糖、甘露聚糖、半乳糖、乳糖以及岩藻糖对营养态酵母以及野生型酵母孢子的吞噬均无显著影响。 因此巨噬细胞通过识别营养态酵母和葡聚糖微球上葡聚糖配体介导吞噬,但野生型酵母孢子表面被巨噬细胞识别的配体不是葡聚糖或甘露聚糖等糖链,巨噬细胞识别营养态酵母和野生型酵母孢子的配体不同。
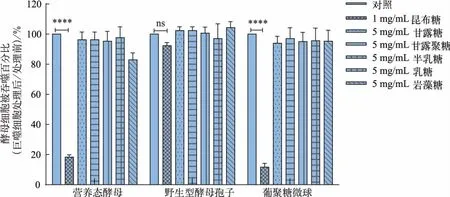
图 5 不同糖链对巨噬细胞吞噬营养态酵母和野生型酵母孢子的影响(± SD,n=5)Fig. 5 Effect of different sugars on the phagocytosis efficiency of vegetative yeast,wild type spores and glucan microspheres(± SD,n=5)
2.6 巨噬细胞对野生型酵母孢子的识别依赖于二酪氨酸层结构
为了探究野生型孢子表面被识别的配体,比较巨噬细胞吞噬野生型酵母孢子(AN120孢子)、dit1Δ孢子和chs3Δ 孢子的效率。dit1Δ 菌株是野生型酵母敲除二酪氨酸层合成基因DIT1后得到的菌株,因此dit1Δ 孢子无二酪氨酸层[37]。chs3Δ 菌株是野生型酵母敲除酵母孢子壳聚糖层合成基因CHS3后得到的菌株,因此chs3Δ 孢子无壳聚糖层。 由于二酪氨酸层的合成是依赖于壳聚糖层的存在, 因此chs3Δ孢子也无二酪氨酸层的存在[3]。 统计每100 个巨噬细胞吞噬野生型酵母孢子、dit1Δ 孢子和chs3Δ 孢子的个数,从图6 可知,巨噬细胞对野生型酵母孢子的吞噬效率显著高于dit1Δ 孢子和chs3Δ 孢子。 如图 6(b)所示,酵母dit1Δ 孢子和chs3Δ 孢子与野生型酵母孢子大小相似,但巨噬细胞对野生型孢子的吞噬更为高效,这表明巨噬细胞对野生型酵母孢子的高效吞噬不是因为其直径小于营养态酵母,而是因为野生型酵母孢子壁最外层二酪氨酸层的存在使其能被巨噬细胞识别,从而介导吞噬的发生。
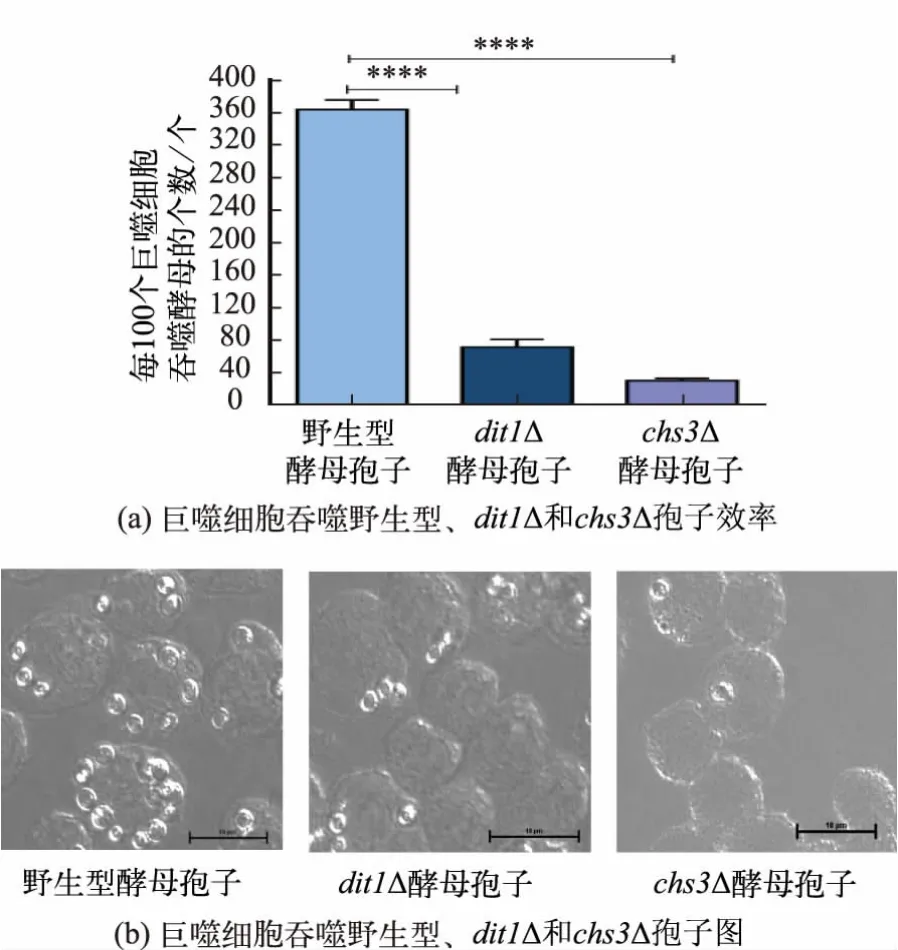
图 6 巨噬细胞对野生型酵母孢子、dit1Δ 和 chs3Δ 突变体孢子的吞噬(± SD,n=5)Fig. 6 Phagocytosis efficiency of wild type spores,dit1Δ spores and chs3Δ spores(± SD,n=5)
3 结 语
酿酒酵母孢子形态对免疫细胞的作用未被详细研究,作者通过比较巨噬细胞对营养态酵母和野生型酵母孢子的内吞效率,发现野生型酵母孢子能够更高效地被巨噬细胞内吞。 进一步研究表明:野生型酵母孢子和营养态酵母的内吞是依赖于Syk的受体介导的吞噬作用,但野生型酵母孢子的吞噬相对于营养态酵母而言极其依赖PI3K,这表明巨噬细胞吞噬野生型孢子和营养态酵母的吞噬信号途径也有所不同。 营养态酵母的吞噬配体是葡聚糖,但野生型酵母孢子的吞噬不依赖于葡聚糖配体,其高效吞噬与野生型孢子壁二酪氨酸层有关。
本研究表明,巨噬细胞高效吞噬野生型酵母孢子是依赖于二酪氨酸层,对这种配体的分子研究让我们能够找到一种可利用的、作为载体的生物分子配体, 可将外源物质高效传递到巨噬细胞体内,为日后开发一种无毒、高效的靶向巨噬细胞的生物介质提供理论依据。
