钒铬还原渣酸浸液中钒铬初步分离工艺
2021-07-28邓孝伯韦林森申长帅李千文汪超范兵强张贺东张洋
邓孝伯,韦林森,申长帅,李千文,汪超,范兵强,张贺东,张洋
(1 攀钢集团钒钛资源股份有限公司,四川攀枝花 617023;2 郑州中科新兴产业技术研究院,河南郑州 450000;3 中国科学院过程工程研究所,北京 100190)
钒和铬皆是重要的战略资源,广泛应用于航空、航天、冶金、材料、电镀、制革、印染、颜料、木材防腐和超导体等领域[1-3]。钒和铬物理化学性质相似,在许多矿物中常伴生共存,如钒钛磁铁矿、铬铁矿[4]。攀西地区有丰富的钒钛磁铁矿资源,钒、钛资源分别占全国储量的50%和90%以上,占世界储量的18%和35%以上,是中国第二大铁矿区,被称为“富甲天下的聚宝盆”。其中,红格矿储量36 亿吨,是攀西四大矿区中最大的一个。红格原矿中Cr2O3品位为0.25%,为其他矿区的8~10 倍,是最大的铬资源矿床[5-6]。钒钛磁铁矿在高炉冶炼提钒的过程中,钒和铬一起被氧化进入到钒渣中,红格矿冶炼得到钒渣中铬含量较高,被称为高铬型钒渣,该钒渣含8%~12%的V2O5和10%~20%的Cr2O3[7]。
钒是钒铬渣中最有价值的元素,工业通常采用钠化焙烧-水浸法提取。提钒过程中,钒、铬同时进入溶液,经沉钒工艺处理后,大部分钒资源得以有效回收利用[8]。但沉钒过程产生大量的含Cr(Ⅵ)和V(Ⅴ)废水,沉钒废水净化过程包括还原、中和、过滤,该过程得到大量的钒铬还原渣。钒铬还原渣为钒冶金行业典型固体废弃物,一般由钒、铬及水溶性盐等组成,国内氧化钒生产企业每年产生的钒铬还原渣总量超过5万吨。铬的附加值不及钒,同时现有提钒方法无法实现铬的综合利用,造成高毒性的钒铬废渣大量堆存,废渣在空气中被氧化产生六价铬及五价钒污染物,易与水溶性盐类一同渗入土壤及地下水系,对环境造成严重污染。废渣资源化利用的难点是钒、铬、铁等离子的深度分离技术[9],研究钒铬还原渣中V、Cr 等元素的深度分离提取技术,规避重金属废渣对环境的重大威胁,实现提钒过程钒铬渣的同步处理,具有重要的经济和环境效益。
目前,分离提取钒铬的方法主要有化学沉淀法、离子交换法、萃取法、结晶法、吸附法和膜分离等[4]。铵盐沉钒是化学沉淀法分离溶液中的钒和铬的代表工艺,该方法具有成本低、流程短、沉钒效果好等优点,常用来生产偏钒酸铵和多钒酸铵。但铵盐沉钒产生大量难处理的氨氮废水,耗能大,脱氨成本高,且难以实现钒、铬的深度分离,无法实现铬的利用。水解沉钒因不产生氨氮废水,且沉钒率高,已成功应用于钒提取工业中,但该工艺也无法获得合格的铬产品。市场上出售的Cr2O3产品要求钒质量分数小于0.15%,而V2O5产品要求铬质量分数小于0.1%。采用萃取的方式可以获得高纯度的钒、铬产品,但萃取分离对溶液中目标离子浓度及其他杂质的含量要求高,前处理成本高,处理能力小,萃取剂易污染且价格昂贵,无法大规模工业化生产[3]。离子交换[10]、膜过滤[11]和吸附法[12]等方法都有应用的局限性,如树脂循环性能不佳、吸附选择性差等,尚处于研究开发阶段。
本文以钒铬还原渣经硫酸浸出得到的高浓度钒铬溶液为研究对象,提出了在酸性溶液中氧化法初步沉钒及络合法深度分离钒铬的联合分离工艺,最终制备了合格的Cr2O3产品,并实现了钒资源的循环利用,钒铬分离工艺流程如图1。本研究主要探索氧化法初步分离钒铬的工艺条件,通过实验研究了不同氧化剂、溶液初始pH、反应温度、反应时间、氧化剂/沉淀剂用量等因素对沉钒效果的影响,获得最佳的工艺条件,对钒铬资源化提供参考依据。

图1 钒铬分离及回收工艺流程
1 材料和方法
1.1 实验原料
钒铬还原渣由攀枝花钒制品厂提供,经硫酸酸解高温浸出预处理后,得到的酸浸液组成见表1。

表1 钒铬还原渣的酸浸液组成(攀枝花钒制品厂)
1.2 试剂和仪器
所用试剂浓硫酸、氢氧化钠、双氧水(质量分数30%)、过硫酸钠均为分析纯。
所用设备有高压反应釜、双层玻璃反应釜、马弗炉、集热式恒温加热搅拌器、pH 计、电热鼓风干燥箱、循环水真空泵、ThermoFisher 7200电感耦合等离子体发射光谱仪(ICP-OES)、SHIMADZU MXF-2400 多道X 射线荧光光谱仪(XRF)、荷兰PANalytical B.V. 公司Empyrean X 射线衍射仪(XRD)、日本电子株式会社JSM-7610F 热场发射扫描电子显微镜(SEM)。
1.3 实验步骤
量取一定体积的酸浸液置于烧杯中,在机械搅拌下用氢氧化钠调节溶液的pH 至设定值,分一定时间匀速加入氧化剂,充分混合后继续搅拌一段时间,将溶液转移至对应的反应釜中(实验温度超过100℃采用高压反应釜,100℃以下使用玻璃反应釜),设定实验温度及保温时间,待实验完成后,用布氏漏斗进行固液分离。实验完成后,分析滤液中的钒、铬含量,计算沉钒率及铬损率,滤饼经洗涤干燥后分析其主要成分含量。沉钒率及铬损率采用式(1)、式(2)计算。
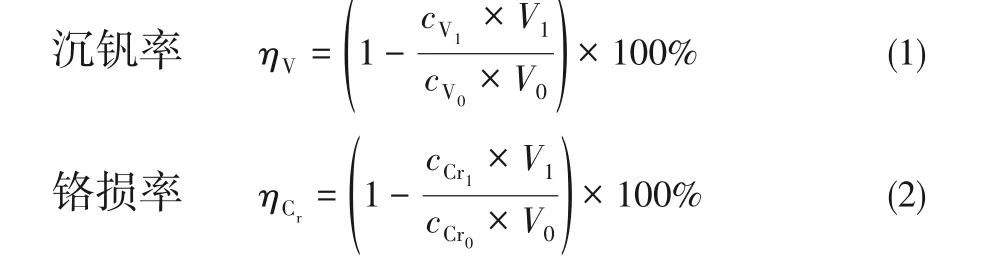
式中,V0为沉钒前溶液的体积,L;V1为沉钒后滤液的体积,L;cV0、cV1分别为沉钒前后溶液的钒浓度,g/L;cCr0、cCr1分别为沉钒前后溶液的铬浓度,g/L。
1.4 样品分析
溶液中钒、铬浓度的测定采用硫酸亚铁铵滴定法,分别参考行业标准YB/T 547.1—2014和国家标准GB/T 4702.1—2016,初步沉钒沉淀物各离子含量及滤液中其他杂质金属离子含量测定采用ICPOES和XRF测定。
2 结果与讨论
2.1 沉钒工艺
钒铬还原渣经硫酸在pH=1.0~1.5 条件下直接浸出,钒、铬浸出率均达到90%以上,浸出率高,适合工业应用。钒铬还原渣经硫酸浸出后,钒主要以V(Ⅳ)存在,铬以Cr(Ⅲ)存在溶液中。在酸性溶液中,利用V(Ⅳ)和Cr(Ⅲ)还原性的差异,常规氧化剂如H2O2、MnO2、过硫酸盐系等氧化剂可以选择性氧化V(Ⅳ)为V(Ⅴ),Cr(Ⅲ)几乎不被氧化,进而可以利用V(Ⅴ)在pH为2左右的水解沉钒,实现大部分钒的回收利用[13]。
H2O2作为清洁氧化剂,在工业上被大规模使用。但H2O2易分解,储存运输困难,氧化效率低,且在酸性钒铬液中分解产生刺激性气味污染环境。铵盐沉钒是钒行业常用的沉钒工艺,(NH4)2S2O8作为强氧化剂可氧化V(Ⅳ),进而被还原成硫酸铵进行铵盐沉钒,经预实验验证(NH4)2S2O8是可行的。但铵盐沉钒产生大量难处理的氨氮废水,易造成水体富营养化。为规避铵盐带来的不良后果,采用Na2S2O8作为替代氧化剂。本文系统研究了H2O2和Na2S2O8的沉钒效果,确定适合工业推广的最佳氧化剂及工艺条件。
本研究采用选择性氧化V(Ⅳ)-水热水解联合沉淀工艺,理论上可实现上述酸浸液中钒、铬的有效分离。制约沉钒的因素主要有氧化效果及水解效率,将从氧化剂加入量、氧化温度、初始溶液pH、氧化时间、水解温度、水解时间等因素研究其对沉钒效果的影响。
2.1.1 氧化剂加入量对沉钒效果的影响
V(Ⅳ)与H2O2发生氧化还原反应的方程式为式(3)。

V(Ⅳ)与Na2S2O8发生氧化还原反应的方程式为式(4)。

固定反应条件:氧化温度为60℃,初始溶液pH为2.0,氧化时间为1h,水解温度为95℃,水解时间为3h。分别考察两种氧化剂加入量对沉钒效果影响的单因素实验,实验结果见图2。

图2 氧化剂加入量对沉钒效果的影响
从图2 可以看出,当H2O2与钒摩尔比从0.5 增加到0.8 时,沉钒率从49.1%增加到84.7%。再增加摩尔比,沉钒率与铬损率基本不变,摩尔比为0.75 和0.8 时,沉钒率相差很小,兼顾经济性,最佳的H2O2与钒摩尔比为0.75。当Na2S2O8与钒摩尔比从0.5 增加到0.65 时,沉钒率从75.3%升高到91.2%,此时铬损率为8.1%,再增加摩尔比,沉钒率与铬损率基本不变,因此最佳的Na2S2O8与钒摩尔比为0.65。图2 中,采用Na2S2O8作为氧化剂时,沉钒率均大于H2O2,铬损率均小于H2O2,且Na2S2O8的摩尔用量小于H2O2。
2.1.2 氧化温度对沉钒效果的影响
氧化还原过程受化学反应控制,溶液温度较低时,氧化还原反应速率低,反应时间长。溶液温度较高时,不稳定氧化剂大量分解。钒铬还原渣酸浸液初始温度在90℃左右,降低温度能耗增加。因此,合适的氧化温度对生产成本影响很大。为考察氧化温度对沉钒效果的影响,固定反应条件:H2O2与钒摩尔比为0.75,Na2S2O8与钒摩尔比为0.65,初始溶液pH 为2.0,氧化时间为1h,水解温度为95℃,水解时间为3h。在40~90℃之间进行了氧化温度对沉钒效果影响的单因素实验,实验结果见图3。
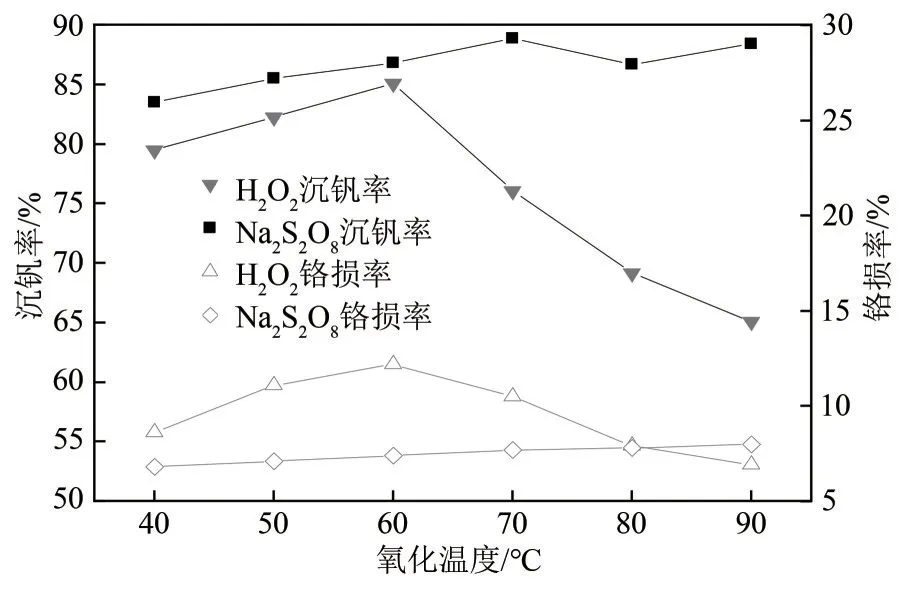
图3 氧化温度对沉钒效果的影响
从图3可以看出,以H2O2为氧化剂时,当氧化温度为60℃时,沉钒率达到最大值,氧化温度继续增加,沉钒率急剧下降。以Na2S2O8为氧化剂时,沉钒率呈递增趋势但幅度较小。两者铬损率趋势均与沉钒率一致。图3 说明H2O2比Na2S2O8受温度影响大,因此,以H2O2为氧化剂时的最佳氧化温度为60℃,以Na2S2O8为氧化剂时,最佳氧化温度选择初始酸浸液温度90℃节约能耗。
2.1.3 氧化时间对沉钒效果的影响
从加氧化剂到开始升温的时间定义为氧化时间(用t表示,min),由两部分构成:一是加料时间(t1),二是充分反应时间(t2),t=t1+t2。预实验表明,加完H2O2持续搅拌30min能保证充分氧化,再延长时间未反应的H2O2基本分解完全,因此固定t2=30min,即t=t1+30,用滴定管均匀控制t1,考察加料时间t1对沉钒效果影响。Na2S2O8为固体氧化剂,分解程度小,可一次投料,不考虑加料时间,即t1=0,t=t2,主要考察反应时间t2对沉钒效果的影响。为研究氧化时间t对沉钒的影响,固定反应条件:H2O2与钒摩尔比为0.75,H2O2氧化温度60℃,Na2S2O8与钒摩尔比为0.65,Na2S2O8氧化温度90℃,初始溶液pH均为2.0,水解温度均为95℃,水解时间均为3h。考察氧化时间对沉钒效果的影响,实验结果见图4。

图4 氧化时间对沉钒效果的影响
从图4可以看出,以H2O2为氧化剂时,当氧化时间从35min 增加到60min 时,沉钒率迅速上升,继续增加氧化时间,沉钒率基本趋于稳定。以Na2S2O8为氧化剂时,沉钒率在氧化时间为45min时达到最大值90.5%。因此,以H2O2为氧化剂的最佳氧化时间为60min,以Na2S2O8为氧化剂的最佳氧化时间为45min。H2O2氧化时间长增加操作时间,进而影响产能。
2.1.4 初始溶液pH对沉钒效果的影响
溶液pH 不仅影响氧化效果,还影响水解沉钒反应。氧化剂发生氧化反应后,生成的H+使溶液的pH降低。为探索合适的初始溶液pH,固定反应条件:H2O2与钒摩尔比为0.75,H2O2氧化温度为60℃,H2O2氧化时间为60min,Na2S2O8与钒摩尔比为0.65,Na2S2O8氧化温度为90℃,Na2S2O8氧化时间为45min,水解温度均为95℃,水解时间均为3h。考察初始溶液pH 对沉钒效果的影响,实验结果见图5。
从图5可以看出,以H2O2为氧化剂,溶液初始pH=2.0 沉钒率最大,以Na2S2O8为氧化剂,初始溶液pH=2.5 沉钒率最大。Na2S2O8为氧化剂沉钒率波动幅度较H2O2大,表明Na2S2O8的沉钒效果受溶液pH 影响大,这可能与Na2S2O8发生氧化还原反应后,溶液中生成H+较多使溶液pH 下降幅度大有关,所以Na2S2O8反应需要的溶液初始pH 要高于H2O2。图5表明,H2O2为氧化剂的最佳溶液初始pH为2.0,Na2S2O8为氧化剂最佳溶液初始pH为2.5。
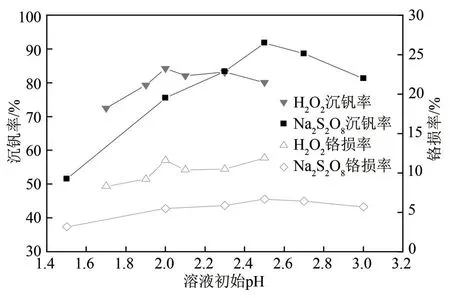
图5 溶液初始pH对沉钒效果的影响
2.1.5 水解温度对沉钒效果的影响
水解沉钒受化学反应控制,理论上提高反应温度有助于沉钒进行。高温高压反应必然造成设备及运行费用增加。为考察水解温度对沉钒效果的影响,固定如下实验条件:H2O2与钒摩尔比为0.75,H2O2氧化温度为60℃,H2O2氧化时间为60min,H2O2初始溶液pH 为2.0,Na2S2O8与钒摩尔比为0.65,Na2S2O8氧化温度为90℃,Na2S2O8氧化时间为45min,Na2S2O8初始pH 为2.5,水解时间两者均为3h。考察水解温度对沉钒效果影响,实验结果见图6。

图6 水解温度对沉钒效果的影响
从图6可以看出,以H2O2为氧化剂,在常压下水解温度从75℃增加到95℃,沉钒率从75.3%升高到87.2%。当反应转移至高压反应釜,继续升高温度,沉钒率出现下降的趋势。以Na2S2O8为氧化剂,沉钒温度从70℃增加到90℃,沉钒率从80.1%增加到92.1%,当沉钒温度继续增加时,沉钒率基本保持不变。两种氧化剂在不同水解温度下,铬损失均变化不大。因此,H2O2水解沉钒的最佳反应温度为95℃,Na2S2O8水解沉钒的最佳反应温度为90℃。
2.1.6 水解时间对沉钒效果的影响
水解反应时间是生产运行费用的重要参考指标之一,为考察水解时间对沉钒效果的影响,在以上得到的最佳工艺参数下,进行水解温度对沉钒效果影响的单因素实验,实验结果见图7。
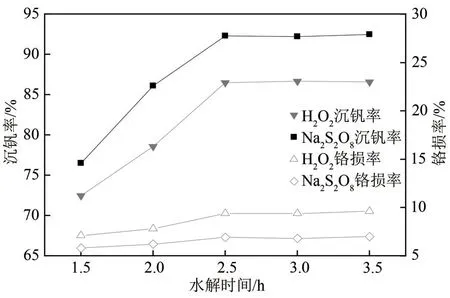
图7 水解时间对沉钒效果的影响
从图7可以看出,两种氧化剂当水解时间增加时,沉钒率均呈现先上升后稳定趋势,铬损率趋势相当且变化幅度小。因此,综合考虑操作时间成本等因素,两种氧化剂的最佳水解沉淀时间均选择2.5h。
以单因素分析分别确定了H2O2和Na2S2O8两种氧化剂的水解沉钒效率,得到了各自的最佳操作工艺参数。综合实验结果来看,Na2S2O8的沉钒效果均优于H2O2,铬损率均低于H2O2,且H2O2易分解,对储运及投料要求较高,因此Na2S2O8更适合工业推广应用。
2.2 沉淀产物及形貌特征
2.2.1 沉淀产物组成
以H2O2和Na2S2O8为氧化剂,经单因素实验研究,得出了两种不同氧化剂氧化沉钒的最佳工艺参数。为验证最佳工艺条件下沉钒稳定性,采用同一批0#酸浸液,在最佳工艺参数下分别用两种氧化剂各进行3组沉钒实验,得到的沉钒液各元素质量浓度见表2。高铬钒液氧化沉钒得到的钒氧化产物中夹带较多的Cr、Na+等离子,采用纯水经二级逆流洗涤得到相对纯净的钒氧化产物,其组成见表3。
从表2 可以看出,在最佳工艺条件下,采用H2O2为氧化剂时,平均沉钒率为84.2%,平均铬损率为11.9%。采用Na2S2O8为氧化剂时,平均沉钒率为93.1%,平均铬损率为7.6%。综合以上研究,Na2S2O8的沉钒效果均优于H2O2,铬损率均低于H2O2,且H2O2易分解,对储运及投料要求较高,因此,Na2S2O8更适合工业推广应用。

表2 两种不同氧化剂对应的沉钒液元素质量浓度
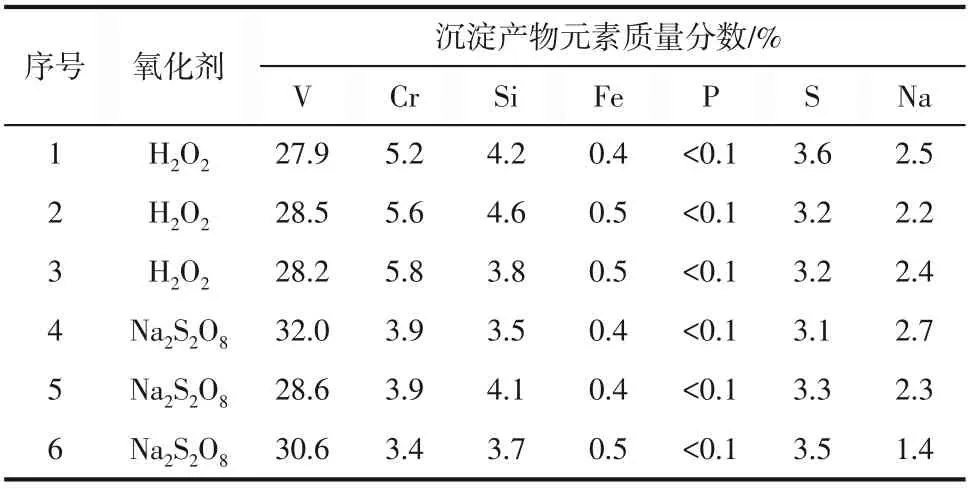
表3 沉淀产物中各元素质量分数
从表3可以看出,采用两种氧化剂进行沉钒分离时,液固分离得到的沉淀物经纯水二级逆流洗涤后,固体中还含有Si、Fe、P、S、Na 等杂质,其中Si 跟S 的质量分数在3%以上。采用H2O2为氧化剂时,得到的沉淀物中平均铬质量分数为5.5%,Na2S2O8为氧化剂时,得到的沉淀物中平均铬质量分数为3.7%。该部分铬经水洗并不能有效去除,表明在沉钒过程中,少量的铬可能发生了共沉淀。从铬含量来分析,Na2S2O8为氧化剂沉钒效果要优于H2O2。
2.2.2 沉淀产物形貌分析
采用场发射扫描电子显微镜对得到的沉淀物粉末进行形貌分析,分析结果如图8所示。
从图8(a)的SEM 图可以看出,以H2O2为氧化剂,得到的钒氧化产物的微观形貌呈现多孔的中空网状结构。结合该氧化物组成分析,这可能是由于酸浸液中含一定量的硅,在酸性条件下形成多聚硅酸盐进入到钒氧化产物中形成中空网状结构。从图8(b)可以看出,采用Na2S2O8为氧化剂,得到的沉淀产物的微观结构呈现类蒲公英似的绒簇状分散结构,根据氧化物成分分析,附着在氧化物上的可能为洗涤过程中残留的硫酸钠等盐类化合物。
2.3 五氧化二钒产品制备及表征
2.3.1 五氧化二钒产品制备
将分别采用H2O2和过硫酸钠氧化沉钒得到的沉淀物置于马弗炉中550℃煅烧4h,将煅烧后的产品用稀盐酸洗涤干燥后得到V2O5产品。采用XRF进行全组分分析,分析结果如表4所示。

表4 V2O5产品中各组分质量分数
2.3.2 五氧化二钒产品表征
将煅烧后的V2O5产品进行X射线衍射分析,得到的结果如图9所示。
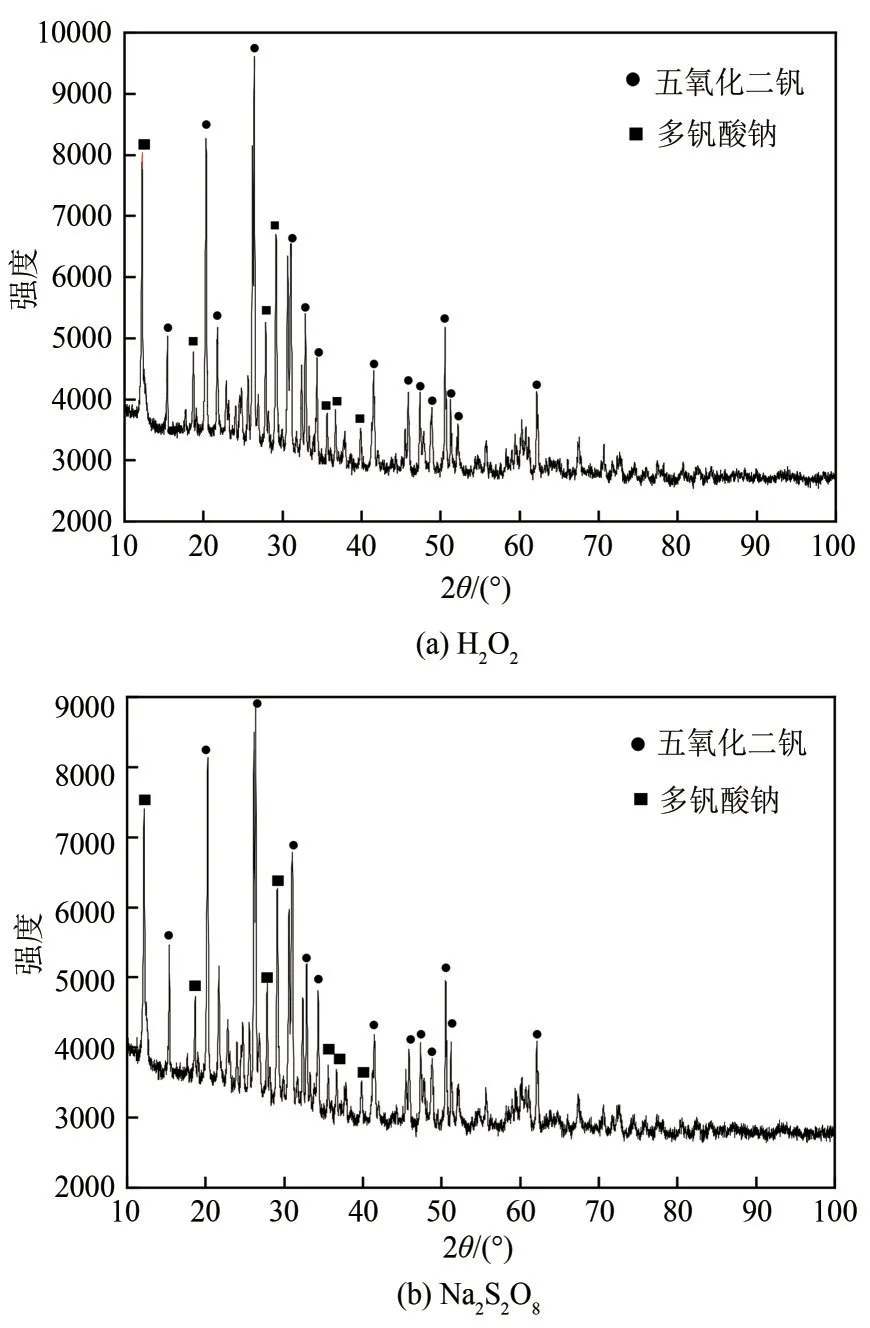
图9 采用H2O2和Na2S2O8制备的五氧化二钒产品XRD图
从图9可以看出,得到的两种V2O5产品的XRD图谱基本重合,说明采用H2O2和Na2S2O8两种氧化剂得到的沉淀产物经煅烧得到的V2O5产品基本一致。XRD 图谱中的主要峰强且尖锐,半高宽窄,表明样品结晶度好[14]。2θ为15.4°、20.3°、21.7°、26.3°、31.0°、32.4°和34.3°处的特征衍射峰与V2O5标准图谱的强特征谱线重合,晶格常数a=1.151nm,b=0.3565nm,c=0.4372nm,α、β和γ角均为90°,说明得到的V2O5产品为正交晶型。2θ在12.2°、18.6°、27.7°、29.2°出现了多钒酸钠的特征衍射峰,表明部分多钒酸钠未完全转化成V2O5产品,煅烧工艺待进一步优化。XRD 图谱中还出现了微弱的SiO2和铬钒氧化物的特征峰,与XRF 结果相对应,表明该部分铬可能与钒发生共沉淀形成了稳定的铬钒氧化物。
3 结论
(1)钒铬还原渣酸浸得到的高浓度钒铬溶液,采用H2O2或Na2S2O8氧化后进行沉钒,可以获得较高的沉钒率,实现钒、铬的高效分离。
(2)H2O2为氧化剂的最佳水解沉钒工艺参数为:H2O2与钒摩尔比为0.75,氧化温度为60℃,氧化时间60min,初始溶液pH 为2.0,水解温度为95℃,水解时间为2.5h。该条件下可获得84.2%的沉钒率,铬损率为11.9%。
(3)以Na2S2O8为氧化剂得到的最佳沉钒工艺参数为:Na2S2O8与钒摩尔比为0.65,氧化温度90℃,氧化时间45min,初始溶液pH 为2.5,沉钒温度90℃,沉钒时间2.5h。该条件下可获得93.1%的沉钒率,铬损率为7.6%。
(4)Na2S2O8与H2O2相比,氧化效率高,氧化过程温和,沉钒率高,铬损失较小,适合工业推广。
(5)通过SEM 获得了沉淀产物的微观形貌,将沉淀物煅烧得到V2O5产品,采用XRF 获得了产品组成,通过X射线衍射确定得到的V2O5产品为正交晶型。
