Gli1对TGF-β1诱导的肾小管上皮细胞间质转分化和胶原合成的影响
2021-07-26李红微王志奇
李红微,王志奇,张 菊,郭 鑫
糖尿病肾病作为临床上十分常见的糖尿病并发症之一,是终末期肾病发生的重要诱因,以肾脏纤维化为主要病理变化[1]。肾小管上皮细胞间质转分化和胶原合成是肾脏纤维化发生的机制之一,受到细胞内多种基因和信号的共同调控作用[2]。转化生长因子-β1(transforming growth factor-β1, TGF-β1)是公认的促进肾脏纤维化发生的诱导因子,能够诱导肾小管上皮细胞发生间质转分化,这也是其诱导肾组织纤维化的重要途径之一[3-4]。锌指转录因子1(glioma associate oncogene homolog 1, Gli1)是广泛存在于人类组织和器官中的调控因子,在细胞分化、间质转分化和运动等过程中具有关键作用[5]。有研究显示,Gli1参与部分疾病的发生和发展,在心肌纤维化和肾组织纤维化等纤维化疾病中发现Gli1过度表达,并且Gli1表达水平还与组织纤维化程度密切相关[6-7]。本研究探讨Gli1对TGF-β1诱导的肾小管上皮细胞间质转分化和胶原合成的影响,以期为肾小管纤维化机制研究提供依据。
1 材料与方法
1.1材料 qRT-PCR试剂购自大连宝生物工程有限公司;引物由上海生工生物工程有限公司合成;Gli1抗体购自美国Abcam;纤维连接蛋白(fibronectin, FN)和Ⅰ型胶原酶(collagen type Ⅰ, Col Ⅰ)含量检测试剂盒均购自上海瑞齐生物科技有限公司;α-SMA抗体和Ras相关C3肉毒素底物1(Ras-related C3 botulinum toxin substrate 1, Rac1)抗体购自美国Proteintech;慢病毒介导的Gli1干扰载体(Gli1 shRNA)及其阴性对照(shRNA)由上海生博生物医药科技有限公司合成;肾小管上皮细胞NRK-52E购于美国ATCC,细胞培养于10%胎牛血清的DMEM中。
1.2TGF-β1诱导后肾小管上皮细胞中Gli1表达水平检测 肾小管上皮细胞在实验0 h时用0 μg/L的TGF-β1细胞培养液和5 μg/L的TGF-β1细胞培养液处理,分别记为Control组和TGF-β1组,培养24 h以后,采用qRT-PCR和Western blot分别检测细胞中Gli1表达水平。
qRT-PCR检测:取Control组和TGF-β1组细胞,利用Trizol试剂提取细胞总RNA。RNA浓度和纯度测定采用紫外分光光度计。配制逆转录体系,包含4 μl的5×Prime Script Buffer,1 μl的Prime Script RT Enzyme Mix,1 μl的Oligo dT primer,1 μl的Random 6 mers,1 μg的总RNA,12 μl的RNase Free dH2O,逆转录条件为37℃ 15 min,85℃ 5 s,逆转录产物保存在-20℃。PCR体系包含12.5 μl的SYBR Premix Ex Taq Ⅱ,1 μl的上下游引物,2 μl的cDNA,8.5 μl的dH2O。PCR反应程序为95℃反应30 s,95℃反应5 s,60℃反应30 s,共循环40次。待测基因的mRNA表达水平根据2-ΔΔCt法计算。引物序列为Gli1上游引物为5'-CTGGACCTGCAGACGGTTATC-3',下游引物为5'-AGCCCTCCTGGAGATGTGCAT-3'。GAPDH上游引物为5'-GGTCGGAGTCAACGGATTTG-3',下游引物为5'-GGAAGATGGTGATGGGATTTC-3'。
Western blot检测:分别取Control和TGF-β1组细胞,在细胞中添加蛋白裂解液,提取细胞中的总蛋白。根据说明书用BCA蛋白含量检测试剂盒分别检测蛋白样品的浓度。SDS-PAGE凝胶按照每个泳道50 μg蛋白样品进行上样,Marker添加3 μl。首先设置80 V的电压进行电泳,直到溴酚蓝马上要进入分离胶以后,把电压调整到100 V,观察溴酚蓝进入到玻璃板的底端以后,把电源关闭。取出凝胶,在250 mA恒流条件下转膜1 h。将电转之后的NC膜置于提前配制好的封闭液(5%牛血清白蛋白)中,置于室温条件下结合2 h;再将NC膜置于已经配制好的一抗溶液内,置于4℃密封过夜;取出NC膜,放在二抗反应液中,室温孵育1 h。添加电化学发光试剂,凝胶成像仪拍照以后,根据Quantity One分析目的条带灰度值与内参GAPDH灰度值的比值,对目的蛋白进行半定量分析。
1.3慢病毒感染 将肾小管上皮细胞接种到12孔板中,细胞密度达到30%~40%,在细胞内加入慢病毒溶液,感染复数为30,培养12 h以后,把孔内的溶液倒掉,然后加入新的培养液,72 h以后,分别观察细胞的荧光情况,干扰效率高于85%。以5 μg/L的TGF-β1细胞培养液培养感染慢病毒介导的Gli1 shRNA及shRNA细胞,分别记为sh-Gli1+TGF-β1和sh-NC+TGF-β1组。取TGF-β1、sh-NC+TGF-β1和sh-Gli1+TGF-β1组细胞,采用1.2中qRT-PCR和Western blot分别检测Gli1水平以确定干扰效果。
1.4ELISA检测细胞培养液上清中FN和ColⅠ水平 取Control、TGF-β1、sh-NC+TGF-β1和sh-Gli1+TGF-β1组细胞,分别培养24 h以后,吸取培养液上清,用ELISA试剂盒检测FN和ColⅠ水平,操作步骤均按照试剂盒说明书进行。
1.5Western blot检测细胞中α-平滑肌肌动蛋白(α-SMA)和Rac1蛋白表达水平 取Control、TGF-β1、sh-NC+TGF-β1和sh-Gli1+TGF-β1组细胞,分别培养24 h以后,采用Western blot检测细胞中α-SMA和Rac1蛋白表达水平,步骤同1.2。

2 结果
2.1TGF-β1诱导后肾小管上皮细胞中Gli1表达 TGF-β1组肾小管上皮细胞中Gli1 mRNA和蛋白表达量均高于Control组,差异有统计学意义(P<0.01),见图1和表1。

图1 TGF-β1诱导后肾小管上皮细胞中Gli1蛋白表达
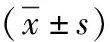
表1 Control组和TGF-β1组肾小管上皮细胞中Gli1 mRNA和蛋白表达
2.2Gli1 shRNA下调TGF-β1条件下肾小管上皮细胞中Gli1表达 肾小管上皮细胞中Gli1 mRNA和蛋白表达量,TGF-β1、sh-NC+TGF-β1和sh-Gli1+TGF-β1 3组总体比较差异有统计学意义(P<0.01);TGF-β1组与sh-NC+TGF-β1组比较差异无统计学意义(P>0.05);TGF-β1和sh-NC+TGF-β1组均高于sh-Gli1+TGF-β1组,差异有统计学意义(P<0.05),见图2和表2。
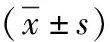
表2 采用不同处理方式3组肾小管上皮细胞中Gli1 mRNA和蛋白表达

图2 Gli1 shRNA下调TGF-β1条件下肾小管上皮细胞中Gli1蛋白表达
2.3下调Gli1减弱TGF-β1条件下肾小管上皮细胞中FN和ColⅠ水平 FN和ColⅠ水平,Control、TGF-β1、sh-NC+TGF-β1和sh-Gli1+TGF-β1 4组总体比较差异有统计学意义(P<0.01);Control组均低于TGF-β1、sh-NC+TGF-β1和sh-Gli1+TGF-β1组,TGF-β1和sh-NC+TGF-β1组均高于sh-Gli1+TGF-β1组,差异有统计学意义(P<0.05),见表3。

表3 采用不同处理方式4组肾小管上皮细胞中FN和ColⅠ水平
2.4下调Gli1减弱TGF-β1条件下肾小管上皮细胞中α-SMA和Rac1蛋白表达 α-SMA和Rac1蛋白表达,Control、TGF-β1、sh-NC+TGF-β1和sh-Gli1+TGF-β1 4组总体比较差异有统计学意义(P<0.01);Control组均低于TGF-β1、sh-NC+TGF-β1和sh-Gli1+TGF-β1组,TGF-β1和sh-NC+TGF-β1组均高于sh-Gli1+TGF-β1组,差异有统计学意义(P<0.05),见图3和表4。

图3 下调Gli1减弱TGF-β1条件下肾小管上皮细胞中α-SMA和Rac1蛋白表达
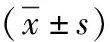
表4 采用不同处理方式4组肾小管上皮细胞中α-SMA和Rac1蛋白表达
3 讨论
有研究报道,糖尿病肾病发病时,成纤维细胞在肾组织纤维化进程中发挥关键作用,而肾小管上皮细胞发生间质转分化,肾小管上皮细胞转化为成纤维细胞是糖尿病肾病发生主要原因之一[8]。TGF-β1是最常见的一种肾组织纤维化发生诱导因子,在肾组织纤维化发生时表达上调,有促进肾小管上皮细胞间质转分化和胶原合成作用[9]。本研究结果显示,肾小管上皮细胞经过TGF-β1处理,细胞中的间质细胞标志物表达上调,细胞分泌的细胞外基质和胶原水平升高,这与上述研究报道一致,说明TGF-β1能够促进肾小管上皮细胞纤维化进程。
上皮间质转分化是上皮细胞向间质细胞转变的标志,生理状态下上皮间质转分化对胚胎发育等有重要意义,病理状态下上皮间质转分化能诱导纤维化等疾病发生[10]。肾小管上皮细胞间质转分化发生与间质特性出现有关,α-SMA是间质细胞特异性标志物,在正常组织和器官中表达水平较低,而在组织或细胞上皮间质转分化过程中表达上调[11-12]。有研究表明,α-SMA阳性表达水平高低与组织纤维化程度呈正相关,细胞大量表达α-SMA是上皮细胞和间质细胞转化的标志[13]。Rac1有调控细胞动力、周期及细胞黏附等作用,属于小G蛋白家族成员之一,Rac1水平升高后能够激活细胞游走,促进上皮细胞去极性进程,进而诱导细胞发生上皮间质转分化[14]。肾组织纤维化发生直接原因是细胞外基质过量合成,肾小管上皮细胞在肾组织纤维化过程中能够合成大量FN和ColⅠ,诱导纤维化发生[15]。本研究结果显示,下调Gli1以后的肾小管上皮细胞合成FN和ColⅠ减少,α-SMA和Rac1表达水平降低,提示下调Gli1能够抑制肾小管上皮细胞间质转分化和胶原合成。
本研究结果显示,TGF-β1诱导后肾小管上皮细胞中Gli1表达上调,并且下调Gli1能够减慢肾小管上皮细胞的纤维化进程。Gli1是Hh信号通路的关键调控因子,具有多种生物学功能,现发现其在组织内环境稳定和器官形成等过程中发挥作用[16]。Gli1参与炎症和组织增生等病理学过程,在慢性瘙痒等疾病发生中扮演关键角色[17]。已有研究报道,肾组织纤维化进程中Gli1高表达,Gli1可促进肾组织纤维化[7]。本研究结果阐明了Gli1在肾小管上皮细胞间质纤维化过程中的作用,为今后肾组织纤维化机制研究提供了参考。
总而言之,TGF-β1诱导后肾小管上皮细胞中Gli1表达上调,下调Gli1表达具有抗肾小管上皮细胞纤维化进程的功能,Gli1可能具有诱导肾组织纤维化的作用,这为临床研究Gli1调控肾组织纤维化进程的具体机制提供了参考。
