多肽药物制备工艺研究进展
2021-07-24郑龙田佳鑫张泽鹏郭建朱晖谢慧翔何润泽洪文晶
郑龙,田佳鑫,张泽鹏,郭建,朱晖,谢慧翔,何润泽,洪文晶,2,
(1 厦门大学化学化工学院,福建厦门361000; 2 固体表面物理化学国家重点实验室,福建厦门361000;3厦门大学胜泽泰多肽制药工程与智能设备研发中心,福建厦门361000)
引 言
多肽是由氨基酸缩合连接而成的,具有一定生物活性的化合物分子。相对于蛋白质物质,空间结构较为简单、稳定性较高,且具有较低的免疫原性。可作用于皮肤系统、肌肉骨骼系统、血液系统、心血管系统、内分泌系统、免疫系统等。随着生物技术、合成技术及分析技术的快速发展,多肽已成为一个重要的生命科学研究领域。如今多肽产品已在医疗、保健食品、化妆品、新材料等众多领域得到广泛应用,尤其是在医药领域,多肽药物正发挥越来越重要的作用[1]。
多肽药物是指通过生物合成法或者化学合成法获得的具有特定治疗作用的多肽,广泛应用于疫苗[2]、抗肿瘤[3]、抗菌[4]、内分泌、心血管等医疗领域,具有副作用小、特异性强、效果显著、生物活性高、用药剂量少、不易产生耐药性等诸多优点,但也存在半衰期短[5]、不稳定、易降解、口服吸收率低等不足。虽然多肽作为药物的开发史较短,但相对于小分子药物及蛋白质药物有其独特的优势,低毒性、原料易得、较易合成、产业化优势明显,因此发展十分迅速,目前已成为市场开发的全新增长点,具有重要的社会价值和经济价值。目前已上市的多肽药物达到近100 种[6],例如用于多发性硬化的格拉替雷[7];用于糖尿病的利拉鲁肽、艾塞那肽[8];用于前列腺癌的亮丙瑞林[9]、曲普瑞林[10];用于骨质疏松的鲑降钙素、特立帕肽[11];用于胰腺炎的奥曲肽[12];用于冠心病的依替巴肽、比伐卢定[13]。其中不少是年销售超过数亿美元甚至数十亿美元的产品[1]。而正在开展临床试验研究的多肽药物约140 种[14]。
由于多肽药物的生物活性和独特的优势,多肽药物制备工艺的研究已经成为当前研究的前沿与热点。而多肽的合成及纯化方法是多肽制药工艺的重要组成部分,本文主要从合成、纯化两个方面对多肽制药工艺的研究进展进行综述。多肽合成方法主要有生物合成法和化学合成法,本文重点介绍了固相多肽合成法的工艺研究进展。对于多肽分离纯化工艺研究进展,则从反相高效液相色谱法、毛细管电泳法、离子交换色谱法、凝胶过滤色谱法、亲和层析法等几个方面进行简要介绍。最后从专业出发结合环境友好对多肽药物制备技术未来发展进行一些思考与展望。
1 多肽合成方法
20 世纪初肽类物质首次被合成[15]。20 世纪50年代美国科学家du Vigneaud 等[16]合成第一种多肽——催产素[16]。几十年来多肽合成发展迅速,目前多肽合成方法(表1、图1)可分为生物合成法及化学合成法。随着基因重组技术的发展,多肽生物合成法除了传统的天然提取法,常用的酶解法、发酵法外,基因重组法也在多肽合成中得到了逐步应用。多肽化学合成法利用保护基团保护原料氨基酸中暂不反应的基团,保证反应按照设计方向进行,通过氨基酸之间的缩合反应来实现氨基酸连接延长,以获得特定序列的多肽。多肽化学合成法有液相合成法与固相合成法,两者主要的区别源于是否使用固相载体。
1.1 生物合成法
生物合成法可分为天然提取法、酶解法、发酵法、基因重组法等。
1.1.1 天然提取法 天然提取法是从生物组织中提取多肽物质。先将组织细胞破碎,再通过超声提取、化学试剂提取等物理化学方法进行提取。Wang等[18]先将中国林蛙干皮在固液比1∶15 的6%乙酸溶液中15℃下浸泡5 min,超声提取1 h,后经过旋蒸、离心获得多肽提取物RCP,测得样品蛋白质含量6.313 g/L。Gasu 等[19]利用物理、化学方法从海洋软体动物Olivancillaria Hiatula中提取重组多肽。所得多肽提取物具有广谱抗菌活性,对革兰阳性菌和革兰阴性菌均有抑制作用。然而,这一技术受限于天然原料,产量有限,且仅有天然多肽体系,存在纯化难度较高、在临床运用中可能导致病人产生过敏反应[20]等问题。此外部分物理化学法可能会导致多肽降解或造成后续研究的不便,因此研究者们不断探索尝试更温和高效的方法。

表1 多肽合成方法[17]Table 1 Methods of peptide synthesis[17]
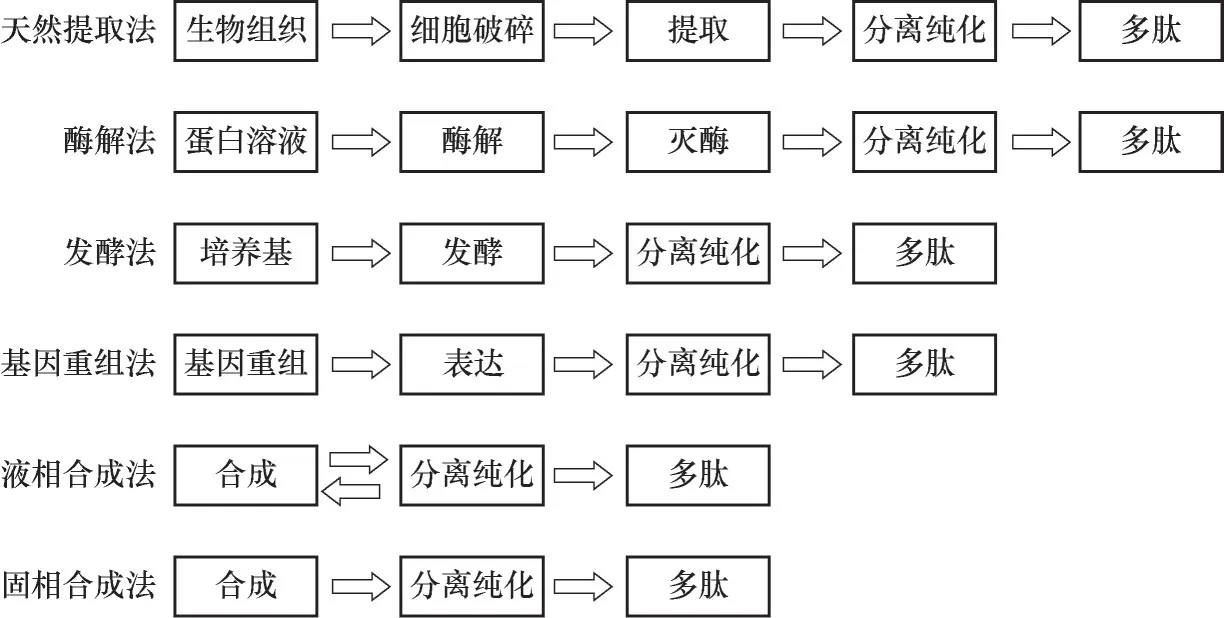
图1 多肽合成方法示意图Fig.1 Schematic diagram of peptide synthesis approaches
1.1.2 酶解法 酶解法利用生物酶将蛋白质降解获得多肽。Wu 等[21]利用碱性蛋白酶水解甜高粱籽粒蛋白,得到一种新型ACE 抑制肽,并建立了酶解过程的动力学模型。相对于物理或化学提取方法,酶解法具有反应条件温和、选择性高等优势,但也存在投入大产量低、酶解得到的一系列多肽分离纯化难度大等不足[22],此外特定酶解位点的蛋白酶也需要进行筛选。庞大的蛋白质加工行业产生了大量的下脚料及废弃物,蕴含丰富的蛋白质资源,如何提高这些资源的利用效率值得思考。Wang 等[23]利用7 种蛋白酶从海参废液中提取多肽,发现复合蛋白酶效果最佳。并对酶解条件进行了优化,最佳酶解条件为:酶用量647 u/g,pH6.48,温度52.5℃,酶解时间3.44 h,最佳条件下蛋白质水解度25.9%。利用酶解法进行蛋白质深加工提供了一个可能的提高蛋白质利用率和价值的思路,而进一步提高产率决定了能否将其推向产业化。由于多肽药物对质量控制有严格要求,对起始物料亦有规定,而酶解法主要得到多肽混合物,故现阶段更适用于食品、化妆品、饲料等行业的多肽需求。
1.1.3 发酵法 发酵法是利用微生物代谢发酵生产多肽,成本低,但分离纯化难度较大。尹乐斌等[24]通过乳酸菌发酵豆清液制备大豆活性多肽,并进行工艺优化调整,获得多肽产率57.33% ± 0.32%。Jemil等[25]通过枯草芽孢杆菌A26和解淀粉芽孢杆菌An6发酵沙丁鱼蛋白水解物生产抗氧化肽和ACE抑制肽。发酵法能直接生产的特定多肽药物产品仍然较少,目前在食品、化妆品、饲料等行业应用较多。但发酵法原料易得,生产成本低,产业化优势明显,是基因重组法的基础,与之结合具有更为广泛的应用前景。
1.1.4 基因重组法 基因重组法利用基因技术将基因片段转移到原核或真核细胞中进行重组表达,发酵生产合成所需多肽,适合长肽的制备。基因重组法中常用的工程菌为酵母菌及大肠杆菌。林静莲等[26]将带有Brevinin-2GUb 基因的pET32a 载体转化至大肠杆菌中,通过优化表达温度,成功获得不带标签的Brevinin-2GUb 多肽。Herbel 等[27]以番茄为原料,从中提取了抗菌肽Snakin-2(SN2),将其与融合蛋白(thioredoxin A)连接,掩盖抗菌活性,在大肠杆菌中重组表达并优化。经过亲和层析去除融合蛋白,获得重组SN2,收率约为1 mg/L,对细菌和真菌具有较强的杀菌活性。基因重组法表达定向强、生产成本低。不足之处在于开发周期长、提取纯化困难、产率低、基因表达研发难度大。
1.2 化学合成法
化学合成法具有研发周期短、可快速生产等优点,分为液相合成法(liquid-phase peptide synthesis,LPPS)及固相合成法(solid-phase peptide synthesis,SPPS)。
1.2.1 液相合成法 液相合成法发展较早,一般可分为两种:逐步合成及片段缩合。逐步合成通常是从多肽链的C端逐步添加连接氨基酸直至整个多肽链完成(图2)。片段缩合一般先合成各个所需片段,再将各片段缩合,合成目标多肽。液相合成法优势在于成本低、保护基选择多、合成规模易放大、中间产物可以纯化并获得理化常数,适合短肽的合成[28]。有研究者[29]通过液相合成水溶性三肽硒谷硫酮,收率高达98%。液相合成法每步反应后需要进行分离和纯化,当合成长肽链时,产率低,过程烦琐、费时费力。部分研究者对液相合成法做了优化和创新,并取得一定的成效。李士杰等[30]采用微通道连续流动合成亮丙瑞林,通过水洗萃取除杂,方便快捷,减少了溶剂和原料消耗。
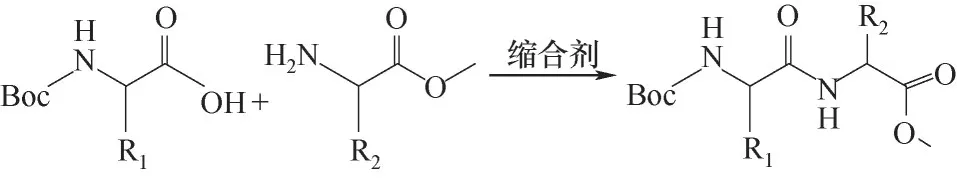
图2 液相合成法一般原理Fig.2 General principles of liquid-phase peptide synthesis
1.2.2 固相合成法 美国生物化学家Merrifield[31]于1963 年提出了固相合成法,并于1984 年获得诺贝尔化学奖。固相合成法中第一个氨基酸的C 端预先固定在不溶性载体树脂上,通过缩合反应将该氨基酸脱保护的N 端与羧基已活化的第二个氨基酸进行连接,重复操作(缩合→洗涤→脱保护→洗涤→下一轮缩合),达到所要合成的肽链长度,逐步连接氨基酸,延长肽链,直到多肽链完成。接着进行切肽、修饰(若需要)、分离纯化,最终获得目标多肽(图3)。根据α-氨基保护基不同,固相合成法可分为叔丁氧羰基(Boc)法和9-芴甲基氧羰基(Fmoc)法。相比液相合成法,固相合成法操作方便,重复进行的偶合操作易于实现自动化处理[33],产品收率和纯度较高[32],极大地促进了多肽药物的研究发展[34],下文也将对此技术着重进行相关进展综述。
2 固相合成方法的研究现状
2.1 固相合成方法和工艺
多肽固相合成法经过几十年的发展,目前主要可分为两类:Boc固相合成法与Fmoc固相合成法。
2.1.1 Boc 固相合成法 在Boc 法中α-氨基用Boc保护基(图4)进行保护,侧链则采用苄醇类作为保护基。合成时使用三氟乙酸(TFA)脱除预先接在树脂上的氨基酸α-氨基的Boc保护基,用N,N-二异丙基乙胺(DIEA)中和N 端,利用二环己基碳二亚胺(DCC)进行活化、偶联下一个氨基酸,重复操作直至完成目标多肽,最后以氢氟酸(HF)或三氟甲磺酸(TFMSA)进行裂解[35]。Boc 法的不足之处在于反复使用强酸脱除保护来进行下一步偶联,肽链容易受到酸类影响而从树脂上切除,而且在酸性条件下氨基酸侧链易发生副反应。Boc 法在多肽合成中得到广泛应用,Alexander 等[36]将Boc 法应用于牛胰蛋白酶抑制剂合成,采用Boc 固相合成法制备片段肽反应物,以天然化学连接法连接,后将多肽链在半胱氨酸/胱氨酸氧化还原缓冲液中进行折叠获得蛋白质分子。
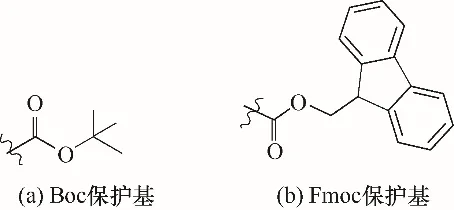
图4 Boc保护基与Fmoc保护基Fig.4 Boc and Fmoc
2.1.2 Fmoc 固相合成法 20 世纪70 年代固相合成法得到了进一步发展,Fmoc 保护基(图4)开始被用于保护α-氨基[37]。Fmoc 保护基对酸稳定,不与TFA反应,易与碱发生作用,可用碱脱除。侧链采用Boc作为保护基,而Boc 对碱稳定。最终采用TFA 或者二氯甲烷(DCM)的TFA溶液进行裂解切肽(图5)。
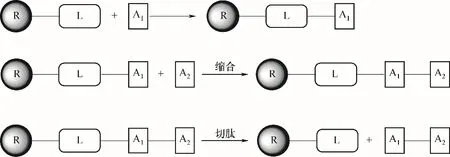
图3 固相合成法示意图[32]Fig.3 Schematic diagram of solid-phase peptide synthesis[32]
相比于Boc 法,Fmoc 法避免了使用危害性较大的强酸HF 进行切肽,副产物少,收率高。代涛等[38]同样采用Fmoc法合成布舍瑞林,通过优化投料质量比,粗品纯度达到80%,粗品经纯化纯度大于98%,总收率为30%。瑙甘等[39]以Fmoc 固相合成法合成亮氨酸脑啡肽及甲硫氨酸脑啡肽,采用LC-UV-MS联用分析,计算得到粗产物含量分别为85.2%和79.8%。Liang 等[40]研究了不同Fmoc 法反应条件下,苯甘氨酸(Phg)的外消旋化情况。发现Fmoc-Phg的碱催化偶联是外消旋化的关键,碱性条件下树脂结合肽具有显著的抗异构化能力,若使用DEPBT 或COMU 与TMP 或DMP 相结合,则消旋化可降至可忽略的水平。此外Fmoc法还可通过监测Fmoc基团的紫外特征峰监控反应的进展,方便生产过程控制。因此Fmoc法得到快速推广普及,是目前最常用的多肽药物制备方法[41]。
但是Fmoc法仍然存在一定的不足,通常合成中需要使用过量的氨基酸、缩合剂和大量溶剂。实现合成绿色化是科学家们亟待解决的问题。Kumar 等[42]开发了一种绿色高效固相多肽合成方法,采用聚苯乙烯和聚乙二醇树脂,以γ-戊酸内酯(GVL)代替溶剂DMF,使用微波辅助合成多肽,纯度高,可合成长肽链。该方法每次循环约5 min 仅消耗溶剂15 ml。极大地提高了反应效率,减少了溶剂消耗。
2.2 固相合成载体
固相合成法要求所用的树脂化学稳定不与试剂、氨基酸发生反应,不溶于试剂,空间位阻小、具有溶胀性、有足够的氨基酸延长空间,有一定的机械强度,可以提供足够的连接点。常用树脂为聚苯乙烯-二乙烯苯、聚丙烯酰胺、聚乙烯-乙二醇类树脂及衍生物[32]。连接分子(活性官能团)连接树脂与氨基酸,要求连接分子在合成过程中稳定,后续易切除且不易发生副反应。根据连接分子不同,载体可分为:羟基树脂、氯甲基树脂、氨基树脂等(表2)。
2.3 缩合剂及缩合机理
氨基酸脱水缩合形成肽键,因而缩合试剂在多肽合成中必不可少[43]。缩合剂主要可分成两类(表3):碳二亚胺型及盐型缩合剂。前者包括:DIC、DCC、EDC·HCl 等,价格经济,但该类型缩合剂单独使用时副反应较多,需通过添加HOBt、HOA(t表3)等试剂控制活化过程中副反应解决消旋化等问题(图6)。Oxyma Pure 也是一种用于抑制外消旋并提高偶合效率的添加剂,目前已广泛应用于多肽合成。El-Faham 等[45]以Oxyma Pure 为添加剂,采用碳二亚胺(DIC)法合成了一系列新的α-酮酰胺衍生物,结果显示使用Oxyma Pure/DIC时,产率和纯度高于HOBt/DIC 或单独使用DIC。盐型缩合剂有TBTU、HBTU、HATU、PyBOP(表3)等,反应活性高,速度快,副产物少,抑制了消旋现象的发生(图7)。

图5 Fmoc法合成机理Fig.5 Mechanism of Fmoc synthesis
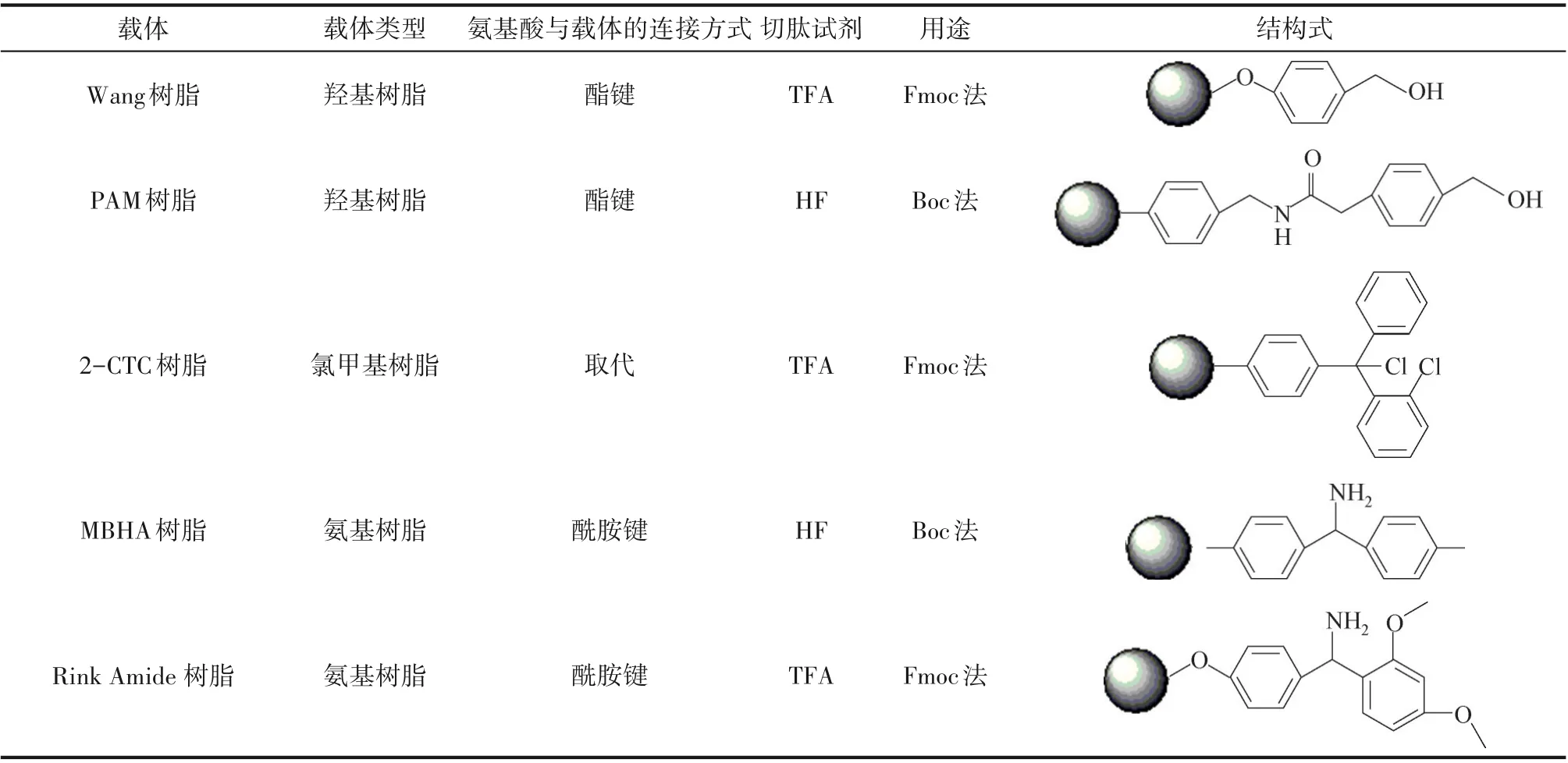
表2 常见树脂载体Table 2 Common resin carriers

表3 常见缩合剂及添加剂[44]Table 3 Common condensing agents and additives[44]
2.4 多肽药物的工业化生产
多肽药物的量产需要通过工业化生产才能实现。在进行多肽工业化生产时需要考虑多方面的问题,包括技术应用、生产工艺、过程控制、产量规模、设备需求、生产成本、质量管理、环保要求等。其主要技术挑战在于提纯难度较大且过程控制要求高[6],且还需要考虑产量规模、生产布局与设备需求,控制生产成本。同时多肽药物生产需要遵循严格的质量管理规范,符合法律法规的要求,最后要重视环保要求,提高资源利用效率,减少废弃物产生。综上考虑,在已有的多肽合成方法中,固相合成法相对较为成熟,目前已上市的多肽药物多数是通过化学合成法制备,并且固相合成工艺占主导[15]。例如采用固相合成法合成缩宫素,高效、安全、环保、质量好、自动化程度高,相比液相合成法在规模级工业化生产具有一定优势[47]。此外,化学合成法在类似物合成方面有着与生物合成法相比的独特优势。通过化学合成法合成单链胰岛素前体,可快速筛选胰岛素类似物,增加化学多样性,改善产物物理、化学特性,从而获得新的治疗特性,实现胰岛素类似物的工业制造[48]。
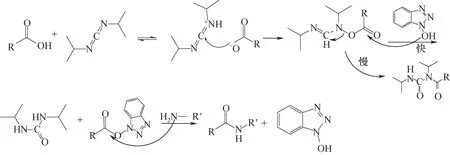
图6 DIC(碳二亚胺型)缩合机理[44]Fig.6 Condensation mechanism of DIC(carbodiimide)[44]
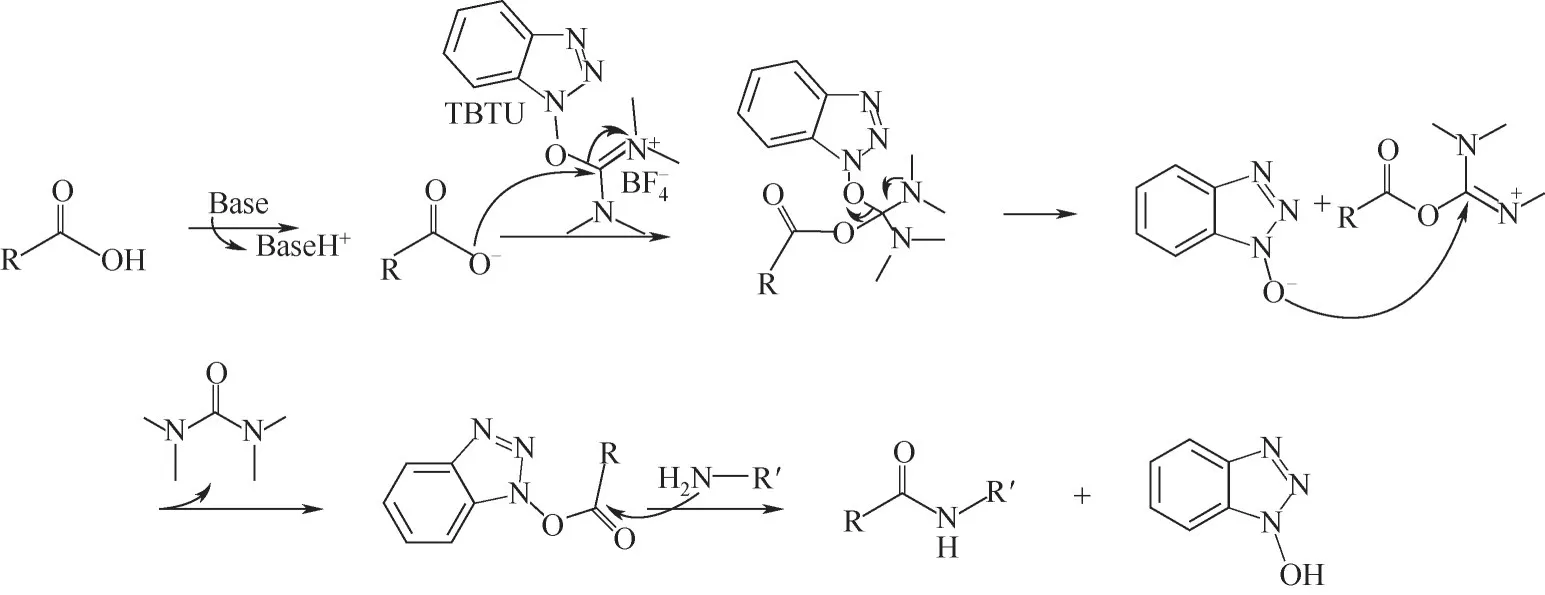
图7 TBTU(盐型)缩合机理[46]Fig.7 Condensation mechanism of TBTU(uranium)[46]
3 分离纯化方法
多肽药物对于纯度的要求较高,一般需要到达99%以上,单杂0.1%以下为佳。而合成获得的粗肽成分复杂,通常是多肽混合物,含目标多肽及结构相似的多肽,因而需要进行后续分离纯化。常用的方法有反相高效液相色谱法、毛细管电泳法、离子交换色谱法、凝胶过滤色谱法、亲和层析法等。
3.1 反相高效液相色谱法
反相高效液相色谱法(reversed-phase highperformance chromatography,RP-HPLC)由非极性固定相与极性流动相组成,利用溶质的疏水性差别进行梯度洗脱分离纯化。分离效果好、重现性强,在多肽分离纯化中得到广泛应用[22]。Ghribi 等[49]采用排阻色谱及反相高效液相色谱分离纯化鹰嘴豆浓缩蛋白酶解产物中新型抗氧化肽,组分Ⅲ中的P8表现出最高的DPPH 自由基清除活性。Girgih 等[50]发现反相高效液相色谱分离可增强cod 肽的降压作用,这可能是由于其具有较强的肾素抑制活性。反相高效液相色谱法高效、快速,但成本相对较高,适合多肽这类规模相对较小、附加值高的产品,已成为多肽主要分离纯化方法,是工业化生产的首选。工业级制备液相色谱通常包含输液系统、进样系统、色谱柱、检测系统、馏分收集、控制和数据处理系统等部分,可自动进行平衡、进样、冲洗、洗脱、收集、清洗等操作,生产符合GMP 等相关法律法规要求的产品。
3.2 毛细管电泳法
毛细管电泳(capillary electrophoresis,CE)以内径极小的毛细管为通道,采用直流高压电源驱动被分离物,根据被分离物的体积和带电荷情况不同实现分离。高效低耗、操作简便。Lamalle 等[51]利用毛细管电泳法分离鱼精蛋白肽,比较不同缓冲液和添加剂的多肽分离效率,发现采用水介质BGE 的MEKC 方法效果最好。毛细管电泳法发展迅速,是多肽分离分析的重要工具。
3.3 离子交换色谱法
离子交换色谱(ion exchange chromatography,IEC)利用流动相携带多肽样品通过离子交换柱,与柱上带有电荷的基团发生离子交换,根据所带电荷差异,实现对多肽样品的分离。适用于生物分子,因其一般带有电荷,人们开发了基于膜分离和离子交换色谱的大规模技术用于工业化生产乳源生物活性肽[52]。李诚等[53]采用离子交换色谱对猪皮胶原蛋白酶解液进行分离纯化取得了较好的效果。离子交换色谱法分辨率高、进样量大、耐酸碱、操作简便,但耗材昂贵、速度慢、范围小、受环境影响较大。
3.4 凝胶过滤色谱法
凝胶过滤色谱法(gel filtration chromatography,GFC)以网状结构凝胶为填料,利用溶质大小、形状差异进行洗脱分离。Yu 等[54]采用凝胶过滤层析、超滤、反相高效液相色谱等方法从螺旋藻酶解物中分离抗氧化肽。凝胶过滤色谱法操作条件温和,但速度较慢。
3.5 亲和层析法
亲和层析法(affinity chromatography,AC)利用固定相的特异性结合能力分离纯化目标蛋白或其他分子[55]。Burkova 等[56]通过琼脂糖亲和层析法纯化人胎盘外显体,获得抗体、多肽和小蛋白。Frolov等[57]通过结合硼酸亲和层析与其他方法分析鉴定Amadori 肽。特异性强,适合低浓度样品的分离纯化。
多肽种类繁多,合成方法不同,理化性质各不相同,应根据实际情况选择不同的分离纯化方法(表4)。研究者们为了提高分离纯化效果,常常将多种方法结合使用[58]。此外还可采用多柱系统进一步提高分离纯化的产量和收率,减少溶剂的消耗[59]。
此外,多肽制药工艺离不开质量管理,严格的质量控制促进工艺的提升。多肽原料药的质量控制包括一般化学药物项目及多肽类药物特有质控项目,前者包括性状、鉴别、酸碱度、有关物质、异构体、水分、有机溶剂及溶剂残留、微生物限度、内毒素、含量等。后者包含等电点、比旋度、溶解度、氨基酸比值、氨基酸序列、肽图分析、生物活性检查、聚合物、相关肽等[60]。其中有关物质包含:起始物料引入的杂质[61]、生产过程中产生的工艺杂质[62]、降解杂质[63],是多肽药物质量研究的重点。其主要研究内容是:分析方法的建立与验证、杂质限度确定[64]。主要采用液相色谱法、质谱法、离子交换色谱法、高效分子排阻色谱法等方法进行检测分析。质量控制的改进提高了多肽药物的质量[65]。通过采用最先进的分析方法,Staby 等[66]发现制造工艺的差异影响利拉鲁肽和索马鲁肽原料药及产品稳定性和杂质分布,并可能影响免疫原性。
4 多肽新型技术的未来发展趋势
随着多肽药物研究和发展,人们对多肽的需求不断上升,多肽行业规模在快速增长,同时也对多肽制药工艺提出了更高的安全、环保要求。在现阶段,单批次千克级的合成开始变得普遍,合成和纯化过程中使用大量有机溶剂,对环保提出了更高要求。近年来,多肽药物肽链长度和复杂度逐渐增加,有些已超过30个氨基酸,合成难度高,对过程监控和自动化合成的需求不断增加。对此,相关科研人员开展了一系列的探索和开发,探索环境友好的绿色多肽技术,应用不断发展的新技术,开发新型合成技术,推进自动化技术的普及与应用,使得多肽在线监控的自动化多肽合成工艺成为现实。
4.1 绿色化学反应和工艺
多肽合成大量使用有机溶剂[67],为进一步寻求绿色环保的多肽工艺,研究者们在溶剂替代、再循环和还原以及新方法等方面进行了探索[68]。Naganna等[69]采用可溶性聚降冰片烯衍生物作载体,减少了缩合时氨基酸和偶联试剂的使用量。利用该载体合成天然产物segatalin A 的非环状六肽前体时,仅使用了已有报道中不溶性树脂方法的八分之一偶联剂剂量,就获得了产率为41%的非环状六肽。Raz 等[70]则采用了改良的Boc-SPPS 策略,开发了一种直接合成肽硫酯的方法,避免使用无水HF。有学者对Fmoc 脱保护技术进行了优化。Jad 等[71]在评估了PS 和ChemMatrix 树脂的溶胀性以及这两种树脂在液相和固相中的Fmoc脱保护作用后,发现低毒可生物降解的γ-戊酸内酯可以代替DMF 去除Fmoc。Přibylka 等[72]开发了绿色脱Fmoc 技术,脱保护时利用NaOH 和2-MeTHF 及MeOH 结合处理,避免危险试剂哌啶、DCM 和DMF 等的使用,并通过合成亮氨酸脑啡肽验证工艺。Okada 等[73]改进了标记辅助液相多肽合成,以疏水性苯甲醇为载体的可溶性标记辅助液相肽合成(LPPS)适用于醋酸艾替班特为模型的肽生产。采用改进后的工艺,每隔一步的沉淀就足以满足整个工艺的要求,大大减少了所需的MeCN 用量。利用高效液相色谱法进行过程控制,可确定每步原料的消耗量,制备的醋酸艾替班特纯度高于99%。

表4 多肽分离纯化方法Table 4 Methods of peptide separation and purification
4.2 微流控技术
为进一步减少溶剂的使用,近年来,微流控技术开始应用于多肽合成中。其优点是多肽产物在原位即可发生裂解,反应速度快、时间短;试剂微量化,降低了处理危险化合物的风险;可精确控制时间及温度,重复性高;能实现自动化连续合成,可快速放大[74]。Wang 等[75]设计了一种多通道连续流微流控芯片,显著缩短合成时间,减少试剂用量,可实现短时间内同时获得6 个不同长度或序列的多肽,高效环保。Qiang 等[76]使用高通量微流控芯片结合绿色荧光蛋白显色法监测细菌细胞生长状况,该技术可快速准确筛选潜在药物分子,加快新药研发速度。此外还有更多技术应用于多肽工艺,例如离子液体可以提高多肽溶解度,加快偶联反应的进行,且不必使用大量的偶联剂[77]。
4.3 膜强化多肽合成法
膜强化多肽合成法(membrane-enhanced peptide synthesis,MEPS)是一种将液相多肽合成与有机溶剂纳滤(organic solvent nanofiltration,OSN)相结合的新方法。其合成基于可溶性高分子载体,每次反应后,通过能保留肽的溶剂稳定膜过滤去除副产物和多余试剂。重复循环氨基酸偶联→过滤去除多余试剂→脱保护→过滤去除脱保护副产物与多余试剂这一过程,每一循环加入一个氨基酸直到获得所需多肽序列[78]。So 等[79]使用MEPS 合成了两种五肽,在相同条件下,MEPS 合成的多肽纯度高于固相合成的多肽纯度。Castro 等[80]研发了三种新型球形可溶性聚合物载体DPEG、DNPEG 和PyPEG,截留率96%~100%,可用于膜增强多肽合成,并用PyPEG 成功合成了模型肽(Fmoc-RADA-NH2)。与固相合成法相比,膜增强多肽合成法受传质影响较小,同时减少反应溶剂的过量使用。
4.4 在线监测和智能控制
随着合成肽链的延长和复杂程度上升,合成难度升高,所需时间增加,成本上升,收率下降,对工艺过程控制与监控提出了更高的要求。研究者们开发了不同监控方法。Tang等[81]利用标记物标记氨基末端,通过拉曼信号强度确定固相上肽的负载量。Knauer等[82]则将Fmoc引入磺酰基改造成Smoc,增强水溶性,以Smoc作为保护基进行水相固相多肽合成。一方面减少有毒溶剂使用,另一方面该保护基在紫外线下呈现绿色荧光,通过荧光强度可判断循环反应的节点。Sletten 等[83]将可变床流反应器(variable bed flow reactor,VBFR)用于固相多肽合成监测,通过实时监测树脂膨胀和收缩引起的反应床压力变化监控树脂膨胀与收缩情况,确定氨基酸偶联效率,通过精确定位有问题的偶联、跟踪树脂聚集以及了解不同合成条件对肽序列的影响,可以在Fmoc 裂解之前对不完全偶合进行调整,优化多肽合成。
Mijalis 等[84]开发了自动化多肽合成法(automated flow peptide synthesis,AFPS)大大加快了固相合成速度。AFPS将标准Fmoc肽的酰胺键形成时间缩短至7 s,每个氨基酸添加周期缩短至40 s。AFPS 对于化学反应控制水平要高于手动或其他自动化方法。在连续流动条件下,通过紫外线监控每个循环Fmoc保护基清除情况,由软件程序记录每次合成过程中的温度、质量流量、压力和紫外线吸收率等数据,并由软件自动化控制反应过程,消除了人为误差,重复性高。人工智能及自动化技术普及与发展,代替人力进行重复性工作及数据收集工作,有利于药物快速发现与开发[85],未来有望在化学合成领域发挥重要作用[86]。
5 总结与展望
多肽药物疗效显著、用药剂量小、不易产生耐药性,具有极高的经济价值和社会价值,是现代医药研究的重要方向。多肽制药工艺研究已经成为当前多肽研究的前沿与热点,特别是固相合成方法的广泛使用,极大地提高了多肽药物的工业化效率。但同时也应当注意到多肽制药工艺存在试剂用量多等诸多问题与挑战,需要多肽药物研究者与从业者共同努力不断改进。随着绿色多肽工艺的开发和应用及微流控技术、膜强化多肽合成技术、在线监控与自动化技术等新技术的广泛使用,多肽制药工艺将得到进一步发展和提高。
人工智能自动化控制技术等众多高新技术与多肽合成工艺的有效融合,在线检测和智能控制系统的应用减少人力投入,提高研发效率,降低研发成本,必将有助于多肽药物的开发和应用。多肽药物的发展对多肽分离纯化提出了更高的要求,单独使用一种方法很难达到理想的效果,因而采用多种技术联合使用提高分离纯化效率将是一大趋势,与此同时,分离纯化新技术也会逐步得到应用。相信在相关领域科研人员的共同努力下,更先进的绿色多肽制药技术能够在未来几年里助推更多的多肽药物进入临床试验和获批上市,面向人民生命健康需求做出新的贡献。
