阿托伐他汀对阿霉素肾病大鼠氧化应激及klotho蛋白表达的影响
2021-07-22王呈刘丽秋
王呈,刘丽秋
(青岛大学附属医院肾病科,山东 青岛 266003)
作为一种公认的可以模拟肾病综合征的模型,阿霉素肾病具体机制尚不完全明确,其病理变化与人类肾病综合征相类似。作为一种抗肿瘤药物,由于具有多器官毒性,特别是肾脏毒性,阿霉素在临床中的应用被大大限制[1]。阿霉素诱导毒性的分子机制是多因素的,至今没有完全确定。到目前为止,最被接受的理论之一是它与氧化应激有关[2]。作为一种耐受性良好的降脂他汀类药物,阿托伐他汀具有抗炎、抗氧化等作用。已有研究表明,他汀类药物可以有效改善阿霉素引起的心脏毒性[3]。但是,阿托伐他汀对阿霉素引起的肾脏毒性的保护作用尚存在争议[4]。Klotho蛋白具有抑制细胞凋亡、抗氧化、抑制纤维化、调节离子转运等多种生物学作用,对细胞氧化应激也具有保护作用[5]。基于以上研究现状,本研究对阿霉素肾病大鼠进行不同时间的阿托伐他汀干预,检测大鼠肾病进展情况,并检测氧化应激指标丙二醛(MDA)、超氧化物歧化酶(SOD)和总抗氧化能力(T-AOC)以及klotho蛋白的变化情况,探讨阿托伐他汀对阿霉素肾病大鼠的保护作用及其对肾脏氧化应激和klotho蛋白表达的影响。
1 材料和方法
1.1 实验材料
雄性Wistar大鼠60只,8周龄,体质量(250±15)g,购自北京维通利华实验动物技术有限公司,许可证号SCXK(京)2016-0006,饲养于青岛大学医学部动物房。阿霉素购自美国Med Chem Express,阿托伐他汀钙片(立普妥,每片20 mg)购自辉瑞制药有限公司。MDA、SOD 检测试剂盒购自南京建成生物工程研究所,T-AOC试剂盒购自凯基生物公司,klotho抗体购自北京博奥森生物有限公司。
1.2 实验方法
1.2.1阿霉素肾病大鼠模型建立及实验动物分组大鼠适应性喂养2 周后,随机选取20 只作为对照组,其余40只大鼠给予尾静脉注射阿霉素10 mg/kg进行造模处理,对照组给予等量生理盐水。1周后检测大鼠24 h尿蛋白,与对照组大鼠相比,尿蛋白升高有统计学意义视为造模成功。造模过程中有4只大鼠死亡。将剩余36只大鼠随机分为模型组和干预组,每组18只。干预组大鼠每天给予阿托伐他汀10 mg/kg灌胃处理,模型组及对照组大鼠每天给予1 mL/kg的生理盐水灌胃处理,持续12周。每周称体质量1次,以调节药物剂量。
1.2.224 h尿蛋白检测 于实验第4、8、12周,从每组随机各取6 只大鼠放入清洁代谢笼中,留取24 h尿液,检测24 h尿蛋白定量。实验重复3次,取均值。
1.2.3肾脏标本的制备及血清清蛋白检测 于实验第4、8、12周,每组随机各取6只大鼠。麻醉后,切取一侧肾脏,-80 ℃保存;另一侧肾脏置于40 g/L中性甲醛溶液中固定,待制备石蜡切片后进行肾组织病理学观察。同时于心脏取血,以4 000 r/min高速离心,取血清用溴甲酚绿法检测清蛋白水平。
1.2.4肾组织病理学观察 取出固定的肾脏组织,石蜡包埋后制备3μm 厚度切片。对切片进行二甲苯脱蜡处理,乙醇水洗,苏木精染色,自来水冲洗,盐酸乙醇分化,自来水浸泡,伊红染色,常规脱水、透明、封片。用光学显微镜(奥林巴斯BX51TF)对染色切片进行观察分析。
1.2.5氧化应激指标检测 采用脂质过氧化比色试剂盒测定大鼠肾组织MDA 水平,采用黄嘌呤氧化酶法(羟胺法)测定SOD 水平,使用722分光光度计通过比色测定T-AOC。
1.2.6实时荧光定量-聚合酶链反应(qRT-PCR)检测klothom RNA 用Trizol提取总RNA,用第一链cDNA 合成试剂盒从2μg总RNA 中合成第一链cDNA。用SYBR Green PCR 试剂在ABI 7500型荧光定量PCR 仪中,以第一链cDNA 为模板进行定量PCR。引物由Primer Premier 5.0 软件设计。Klotho-F 引物序列为5'-TTTGCCCTATTTCACCGAAG-3',klotho-R 引物序列为5'-CCTGACTGGGAGAGTTGAGC-3'。
1.2.7蛋白质印迹法(Western Blot)检测klotho蛋白 从大鼠肾组织中提取蛋白质并进行Western Blot分析。制备SDS-PAGE 凝胶,电泳后转膜,加一抗和二抗进行抗体反应,曝光显影,使用Image J软件分析条带灰度值。
1.3 统计学分析
应用SPSS 23.0软件进行统计学分析。计量数据以表示,采用单因素方差分析(ANOVA)进行多组比较,然后采用LSD-t检验进行组间两两比较;相关性检验采用Spearson相关分析。
2 结果
2.1 造模后大鼠一般状况
大鼠尾静脉注射阿霉素1周后均出现不同程度腹泻、食欲减退、消瘦、活动减少等表现;2周后出现轻度水肿,以睾丸及足部最为明显。
2.2 各组大鼠24 h尿蛋白定量及血清清蛋白比较
随时间延长,模型组和干预组大鼠24 h尿蛋白定量进行性升高。实验第4、8、12周时,模型组、干预组大鼠24 h尿蛋白定量高于对照组,干预组低于模型组,差异具有显著性(F=242.285~1 412.89,P<0.05)。模型组、干预组大鼠血清清蛋白水平低于对照组,而干预组高于模型组,差异具有显著意义(F=58.265~240.54,P<0.05)。见表1、2。
表1 各组大鼠24 h尿蛋白定量比较(n=6,m/mg,)
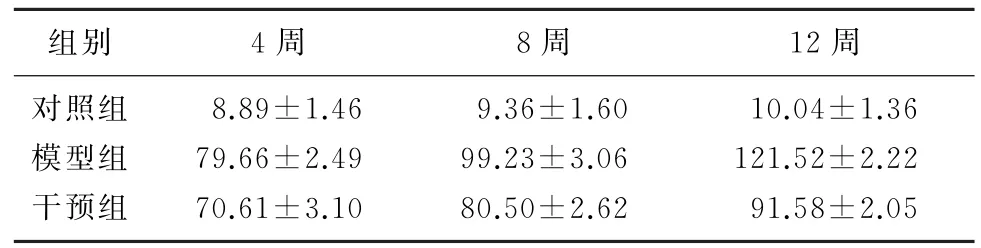
表1 各组大鼠24 h尿蛋白定量比较(n=6,m/mg,)
表2 各组大鼠不同时间血清清蛋白水平比较(n=6,ρ/g·L-1,)

表2 各组大鼠不同时间血清清蛋白水平比较(n=6,ρ/g·L-1,)
2.3 肾组织病理学观察
大体观察显示:对照组大鼠肾脏外观红润;模型组大鼠肾脏肿大,包膜紧张,外观苍白;干预组大鼠肾脏轻度肿大,颜色轻度暗淡,略有光泽。对大鼠肾脏进行苏木精-伊红(HE)染色,光镜下观察可见:模型组肾小球右侧小管区无结构、坏死,肾小管上皮细胞水肿,部分坏死、无核,管腔狭窄;干预组肾小管上皮细胞水肿减轻,坏死程度及范围均小于模型组,细胞核损伤程度低于模型组。
2.4 各组大鼠氧化应激指标比较
随时间推移,模型组大鼠肾组织MDA 水平逐渐升高,干预组则逐渐降低;而SOD 及T-AOC 的变化趋势与MDA 相反。组间比较,模型组大鼠肾组织MDA 水平较对照组明显升高,而干预组较模型组明显降低,差异有统计学意义(F=20.43~161.64,P<0.05);干预组大鼠肾组织SOD、T-AOC水平均高于模型组大鼠,差异有统计学意义(F=4.97~604.10,P<0.05)。见表3~5。
表3 各组大鼠肾组织MDA含量比较(n=6,b/μmol·g-1,)

表3 各组大鼠肾组织MDA含量比较(n=6,b/μmol·g-1,)
表4 各组大鼠肾组织SOD 含量比较(n=6,(z/m)/U·g-1,)
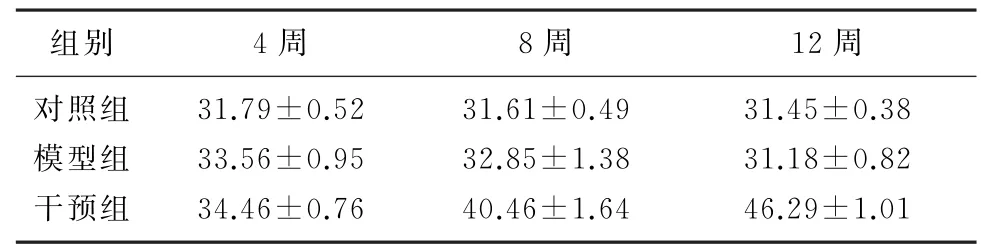
表4 各组大鼠肾组织SOD 含量比较(n=6,(z/m)/U·g-1,)
表5 各组大鼠肾组织T-AOC水平比较(n=6,z/kU·L-1,)
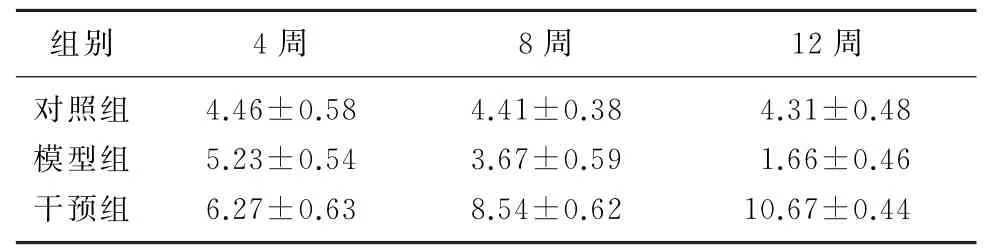
表5 各组大鼠肾组织T-AOC水平比较(n=6,z/kU·L-1,)
2.5 各组大鼠klotho m RNA 表达比较
模型组和干预组大鼠肾组织klothomRNA 表达较对照组降低,而干预组表达较模型组升高,差异有显著性(F=253.21~964.23,P<0.05)。见表6。
表6 各组大鼠肾组织klotho mRNA 表达比较(n=6,χ/%,)

表6 各组大鼠肾组织klotho mRNA 表达比较(n=6,χ/%,)
2.6 各组大鼠klotho蛋白表达比较
模型组大鼠肾组织klotho蛋白的表达随时间推移而降低,但干预组大鼠肾组织klotho蛋白的表达随时间推移而升高。组间比较,模型组和干预组大鼠肾组织klotho蛋白较对照组表达降低,而干预组较模型组表达升高,差异均具有显著意义(F=173.88~821.60,P<0.05)。见表7。
表7 各组大鼠肾组织klotho蛋白表达比较(n=6,χ/%,)
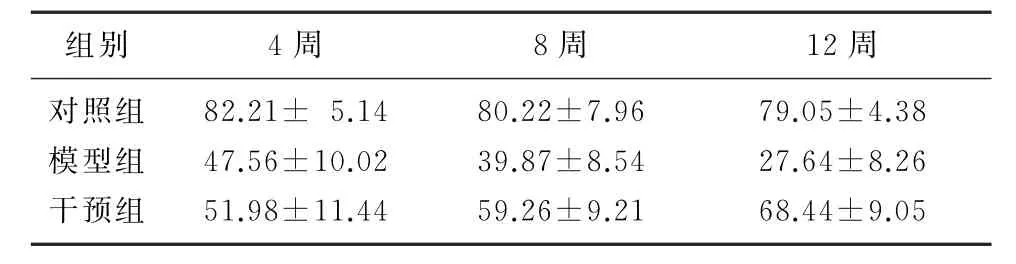
表7 各组大鼠肾组织klotho蛋白表达比较(n=6,χ/%,)
2.7 klotho蛋白表达与氧化应激指标关系
大鼠肾组织klotho蛋白表达与MDA 含量呈负相关(r=-0.728,P<0.05),与SOD 含量和TAOC水平呈正相关(r=0.323、0.539,P<0.05)。见图1。

图1 Klotho蛋白表达与氧化应激指标的相关性
3 讨 论
阿霉素肾病模型是目前公认的肾病综合征动物模型,其发生机制尚不完全明确,可能与氧化应激有关。本实验以Wistar大鼠为研究对象,应用阿霉素进行造模,通过检测大鼠24 h尿蛋白定量及血清清蛋白显示,阿托伐他汀可降低阿霉素肾病大鼠尿蛋白水平,并一定程度提高血清清蛋白水平,且HE染色显示,干预组病变较模型组减轻,这提示阿托伐他汀可改善阿霉素肾病的病理损害。
在阿霉素肾病模型中,氧化应激是常见及重要的机制之一。MDA 可间接反映体内的氧化应激水平。在本实验中,经过阿霉素造模处理后,模型组大鼠肾组织中MDA 含量明显升高,且随时间推移逐渐增高。这是因为阿霉素肾病在无药物治疗情况下,会随着时间推移而不断进展恶化,所以MDA 含量会持续升高。而经过阿托伐他汀干预后,干预组MDA 含量较模型组降低,并且随时间推移而降低,表明阿托伐他汀可抑制氧化应激。这与有关研究结果相吻合[6]。SOD 可以在分子、细胞水平防止和减轻机体组分受到过氧化损伤。Klotho蛋白可通过与胰岛素样生长因子(IGF)受体结合,增强SOD 活性[7]。在阿霉素肾病中SOD 活性受到抑制,故其清除氧自由基的作用明显降低,氧自由基含量进一步升高[8]。阿霉素降低主动脉和肾脏SOD 的表达,可能是氧化应激增强的原因之一。本实验中模型组大鼠肾组织SOD 的表达持续降低,与TAKENAKA等[9]的研究结果相一致。在抗氧化能力评估中,TAOC 测量比单个抗氧化剂浓度测量更为可靠[10]。本实验结果表明,阿霉素会影响正常大鼠的抗氧化能力,而阿托伐他汀则会改善阿霉素肾病大鼠减弱的抗氧化能力。
Klotho蛋白由肾小管分泌,从间质进入Bowman囊和足细胞[11]。Klotho蛋白在肾脏中的表达水平最高[12],它参与肾脏离子通道和转运体的调节,以及肾脏1,25-二羟维生素D3的生成调节[13]。Klotho蛋白在维持细胞内稳态方面起着重要的作用[14],它通过抗炎症、氧化应激和上皮间充质转换(EMT)[15],发挥对阿霉素肾病的保护作用。阿霉素肾病的发展可能与klotho的表达降低有关。本研究结果显示,阿托伐他汀会上调klotho蛋白在阿霉素肾病状态下表达。Klotho表达的调节可能与Rho通路有关。有研究表明,阿托伐他汀可以增强klotho基因的表达[16]。YOON 等[17]研究认为,抑制Rho及其下游靶点Rho激酶也可能是他汀类药物发挥作用的机制之一。他汀类药物可通过Rho A灭活大鼠内髓质集合管上皮细胞,从而上调klothom RNA 的表达。Klotho蛋白在肾病综合征病人体内水平的变化与氧化/抗氧化失衡有密切联系,其表达水平下降可能是肾脏氧化损伤加重的原因之一。在氧化应激情况下,klotho可通过上调热休克蛋白70(HSP70)表达来应对机体氧化应激状态[18]。所以,诱导klotho基因表达可以挽救氧化应激所造成的肾组织损伤,而阿托伐他汀可能通过增强klotho的表达发挥抗氧化作用。
目前认为免疫反应、炎症细胞浸润与肾病的发生发展密切相关,所以抗炎、抑制免疫治疗是当前许多肾病的主要治疗方法。糖皮质激素是现今应用最为广泛的免疫-炎症抑制剂,但在临床上经常会遇到糖皮质激素依赖或糖皮质激素抵抗,目前尚无好的解决方法。过去人们比较关注他汀类药物通过发挥降脂作用保护肾脏,近年来越来越多地关注他汀类药物的抗炎、免疫调节等非降脂肾脏保护作用。他汀类药物能够改善血管内皮细胞功能、抑制肾小球的增生肥大和肾小球系膜细胞增殖,并抑制系膜细胞转化生长因子-β1(TGF-β1)、血管紧张素Ⅱ的表达和分泌,从而减少病人尿蛋白排泄量,改善其肾功能[19]。但是本实验还显示,阿托伐他汀可以调节肾脏中关键基因蛋白klotho的表达,改善阿霉素肾病的病理状况,缓解其氧化应激损伤,这为临床上治疗肾病综合征提供了思路。但是本实验还存在一定的不足,如样本量小、确切机制未研究清楚,还需要进一步研究以得到更加确切的结论。
综上,本实验结果表明,阿托伐他汀可以延缓并改善阿霉素肾病大鼠肾脏病理损害。阿霉素肾病大鼠肾脏受到氧化应激损伤,氧化应激标记物MDA、SOD 及T-AOC 异常表达,阿托伐他汀可一定程度纠正氧化应激损伤,其作用机制可能与上调肾脏中klotho蛋白表达有关。
