KIF3B 基因对三阴性乳癌细胞生物学特性和阿霉素化疗敏感性的影响
2021-07-22张润泽郑艳贾惠卿迟菁华项锋钢王成勤
张润泽,郑艳,贾惠卿,2,迟菁华,项锋钢,2,王成勤,2
(青岛大学,山东 青岛 266071 1 基础医学院病理学系;2 附属医院病理科)
乳癌是全世界女性最常见的恶性肿瘤,也是第二大常见的癌症致死原因[1]。据统计,乳癌发病率占全身各种恶性肿瘤的7%~10%。三阴性乳癌(TNBC)是指雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体(HER2)表达均为阴性的乳癌,占所有乳癌病理类型的12%~17%[2]。TNBC好发于相对年轻的妇女,具有预后差、复发率高、转移率高和死亡率高等特点,已成为近年来乳癌研究和关注的焦点。已有研究证实,与Luminal型和HER2过表达型的乳癌相比,TNBC 对新辅助化疗更加敏感,其病理完全缓解(PCR)率更高[3]。
驱动蛋白超家族蛋白(KIFs)是一类分子马达,在细胞内起着运输媒介的作用,它可以依靠微管等细胞骨架结构将细胞内货物(如囊泡、细胞器、蛋白质复合物和RNA 等)运输到细胞内的指定位置[4]。KIFs有14个亚家族,由45个成员组成。KIF3B是KIF3亚家族的成员,它是一种重要的蛋白质,在有丝分裂期间,KIF3B 负责囊泡运输和膜扩张,从而调节细胞迁移。近年来,KIF3B 与疾病的发生和发展之间的关系越来越受到关注[5]。已有研究发现,KIF3B在胰腺癌、肝癌、口腔鳞癌、精原细胞瘤、胃癌、结肠直肠癌和前列腺癌中存在异常表达[5-11]。但目前尚未有关于KIF3B 与TNBC 关系的报道。本研究拟沉默乳癌细胞中KIF3B基因,以观察其对细胞增殖、迁移、侵袭、细胞周期、上皮-间质转化(EMT)相关蛋白表达和阿霉素敏感性的影响。
1 材料与方法
1.1 实验材料
人TNBC 细胞株MDA-MB-231和MDA-MB-468购自中国科学院(中国上海);KIF3B 抗体购自美国Santa Cruz公司;β-actin抗体购自武汉云克隆科技股份有限公司;E-cadherin抗体购自英国Abcam 公司;基质金属蛋白酶2(MMP-2)和MMP-9抗体均购自北京博奥森生物技术有限公司;羊抗鼠和羊抗兔二抗均购自Bioworld公司;sh-KIF3B沉默质粒及sh-NC 质粒购自上海吉凯基因化学技术有限公司;Transwell小室购自美国Corning公司;DMEM 培养基购自美国Hyclone公司;Matrigel基质胶购自美国BD 生物技术公司;胎牛血清购自美国Gibco公司;增强化学发光(ECL)试剂盒购于美国Millipore公司;LipofectamineTM2000 购于美国Invitrogen公司;碘化丙啶(PI)溶液、MTT 粉末、二甲基亚砜(DMSO)、盐酸阿霉素、结晶紫粉末均购自北京索莱宝科技有限公司;RNAse A 溶液购于天根生化科技有限公司。
1.2 实验方法
1.2.1细胞培养与转染 将MDA-MB-231细胞和MDA-MB-468细胞置于含有体积分数0.10胎牛血清的DMEM 培养基中,在37 ℃、含体积分数0.05 CO2的培养箱中常规培养。用Western blot法检测MDA-MB-231 细胞和MDA-MB-468 细胞KIF3B表达,取KIF3B 高表达细胞MDA-MB-231用于后续实验。转染前1 d 将处于对数生长期的MDAMB-231细胞接种到6孔板中,达到70%融合度时,按照说明书方法用LipofectamineTM2000把质粒转染细胞,培养72 h 用于后续实验。将未经处理的MDA-MB-231细胞作为MOCK 组,将转染sh-NC质粒的MDA-MB-231 细胞作为sh-NC 组,将转染sh-KIF3B沉默质粒的MDA-MB-231细胞作为sh-KIF3B组。
1.2.2Western blot法检测细胞中KIF3B及EMT相关蛋白表达 提取MDA-MB-231细胞和MDAMB-468细胞蛋白,用BCA 法检测蛋白浓度,加入蛋白上样缓冲液煮沸。行SDS-PAGE 凝胶电泳分离蛋白,300 m A 转膜2 h将蛋白转至PVDF膜上,室温下用50 g/L 脱脂奶粉封闭2 h,分别加入一抗KIF3B(1∶500)、E-cadherin(1∶1 000)、MMP-2(1∶1 000)、MMP-9(1∶1 000)和β-actin(1∶4 000)4 ℃孵育过夜,TBST 洗膜3次,加入相应二抗(1∶4 000)室温孵育2 h,重复TBST 洗膜步骤,最后加入ECL后曝光显影并分析条带灰度值。目的蛋白相对表达量以目的条带灰度值/β-actin条带灰度值表示。比较不同细胞KIF3B表达效率,取KIF3B 高表达细胞MDA-MB-231用于后续沉默实验。重复上述步骤,提取对数生长期的MOCK 组、sh-KIF3B组和sh-NC组细胞蛋白,检测KIF3B沉默效率。
1.2.3Transwell实验检测细胞迁移及侵袭能力取对数生长期的sh-KIF3B组和sh-NC 组细胞,用胰蛋白酶消化后重悬于无血清DMEM 培养基,调整细胞密度为1×108/L,在Transwell小室上室(均匀铺稀释过的50 mL Matrigel基质胶,Matrigel基质胶∶无血清培养基=1∶8)均匀加入200μL细胞悬液,下室加入600μL 含体积分数0.15胎牛血清的培养基。当观察到下室有细胞穿过后,取出上室,吸出培养基并用PBS冲洗,用棉棒轻轻擦去上室未穿过的细胞,多聚甲醛固定15 min,5 g/L结晶紫染色30 min,流水冲洗干净,晾干后200倍光镜下随机选取5个视野观察并计数。
1.2.4MTT 实验检测细胞增殖 将处于对数生长期的sh-KIF3B组和sh-NC 组细胞以每孔3×103个接种于96孔板,每组分别接种6个复孔,将细胞置于37 ℃、含体积分数0.05 CO2的培养箱中培养,分别于培养1、2、3、4、5 d后,向各孔中加入20μL MTT(PBS配制,5 g/L)溶液并于培养箱孵育2 h,弃去上清液,每孔中加入DMSO 溶液150μL,低速震荡10 min,使用全功能微孔板检测仪检测各孔490 nm 波长处的吸光度(A)值,分析数据并绘制细胞生长曲线。
1.2.5流式细胞术检测细胞周期 取对数生长期的sh-KIF3B组和sh-NC 组细胞胰蛋白酶消化后离心,用预冷的PBS洗涤3次,加入体积分数0.70乙醇4 ℃固定过夜,再次使用PBS溶液洗涤3次后加入200μL PBS和2μL RNaseA(终浓度为20 mg/L)重悬细胞,37 ℃孵育30 min,再加入500μL PI染液(终浓度为50 mg/L),避光孵育30 min,最后使用流式细胞仪检测细胞周期分布。
1.2.6MTT 实验检测细胞活性 将对数生长期的sh-KIF3B组和sh-NC组细胞,以每孔1×104个接种于96孔板,待细胞贴壁后,再分别加入阿霉素使其浓度达到0.10、0.25、0.50、1.00、2.00、5.00μmol/L,同时设置空白组,每组设置6个复孔,继续培养48 h后,向各孔中加入20μL MTT(PBS配制,5 g/L)溶液并于培养箱孵育2 h,弃去上清液,每孔加入DMSO 溶液150μL,低速震荡10 min,用全功能微孔板检测仪检测各孔490 nm 波长处吸光度(A)值。计算各给药组的细胞存活率。细胞存活率(%)=(实验组A 值-空白组A 值)/(对照组A 值-空白组A 值)×100%。
以上所有实验均独立重复3次。
1.3 统计学分析
应用SPSS 25.0软件进行统计学分析。正态分布计量数据以表示,两组间比较采用t检验,多组间比较采用单因素方差分析及析因设计的方差分析。以P<0.05表示差异有统计学意义。
2 结果
2.1 TNBC细胞系中KIF3B蛋白表达及沉默效率
Western blot法检测结果显示,KIF3B 蛋白在MDA-MB-231中呈高表达,而在MDA-MB-468 细胞中呈低表达,两种细胞KIF3B蛋白表达比较差异有统计学意义(t=19.92,P<0.01)。将MDA-MB-231细胞用于沉默KIF3B基因,分别转染sh-NC质粒和sh-KIF3B沉默质粒。Western blot法检测结果显示,sh-KIF3B组KIF3B蛋白表达较MOCK组和sh-NC 组明显减少,差异有统计学意义(F=284.56,P<0.01)。表明KIF3B基因成功沉默。见图1。

图1 Western blot检测TNBC细胞系中KIF3B蛋白表达及沉默效率
2.2 沉默KIF3B 基因对TNBC细胞迁移、侵袭能力的影响
Transwell迁移实验显示,沉默MDA-MB-231细胞KIF3B基因后,sh-KIF3B组迁移细胞数目(269.4±21.4)明显低于sh-NC组(754.2±29.8),差异有统计学意义(t=29.54,P<0.01)。侵袭实验显示,沉默MDA-MB-231细胞KIF3B基因后,sh-NC组侵袭细胞数目为(1 120.0±53.5)个,sh-KIF3B组为(452.7±33.5)个,两组比较差异有显著意义(t=18.32,P<0.01)。见图2。

图2 沉默KIF3B 基因后细胞迁移、侵袭能力变化
2.3 沉默KIF3B 对TNBC细胞增殖能力的影响
MTT 实验结果表明,沉默KIF3B对TNBC细胞增殖能力影响的组别与时间之间存在交互效应(F组别×时间=49.601,P<0.01)。MDA-MB-231细胞转染sh-KIF3B质粒后,同一时间下sh-KIF3B组细胞增殖能力明显低于sh-NC 组,差异有统计学意义(F=7.56~270.09,P<0.01)。见表1。
表1 KIF3B 沉默后细胞增殖能力变化(n=6,)
2.4 沉默KIF3B 对TNBC细胞周期的影响
流式细胞术结果显示,sh-NC 组和sh-KIF3B组G0/G1期细胞比例分别为(78.29±1.99)%和(71.55±1.39)%,G2/M 期细胞比例分别为(4.72±0.32)%和(10.13±0.38)%。与sh-NC 组相比,sh-KIF3B组细胞G0/G1期比例显著减少,而G2/M 期比例则显著增多,差异均有统计学意义(t=4.82、19.05,P<0.01)。见图3。
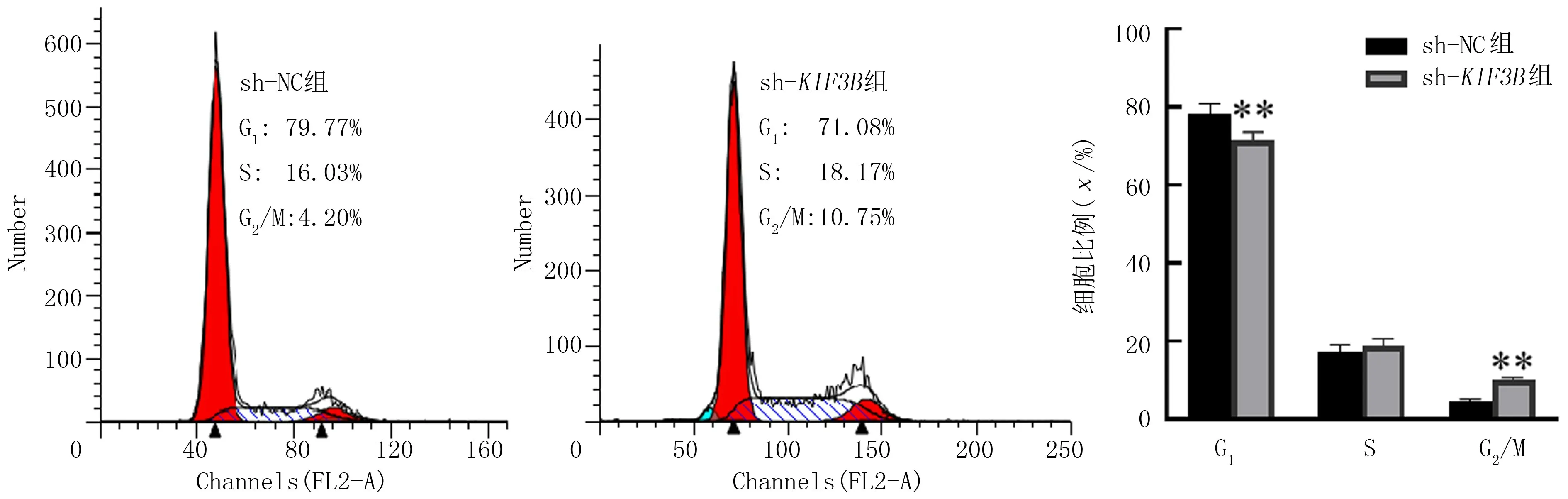
图3 流式细胞术检测KIF3B 沉默后细胞周期变化
2.5 沉默KIF3B 对TNBC 细胞阿霉素敏感性的影响
MTT 实验结果显示,沉默KIF3B后TNBC细胞对阿霉素敏感性影响的组别与浓度存在交互效应(F组别×浓度=15.201,P<0.01)。在相同浓度阿霉素作用下,sh-KIF3B组细胞存活率较低,表明沉默KIF3B基因后MDA-MB-231 细胞对阿霉素敏感性明显上升,差异有显著意义(F=26.37~167.11,P<0.01)。见表2。
表2 KIF3B 沉默对细胞阿霉素敏感性影响(n=6,χ/%,)

表2 KIF3B 沉默对细胞阿霉素敏感性影响(n=6,χ/%,)
2.6 沉默KIF3B 对EMT 相关蛋白表达的影响
sh-NC组和sh-KIF3B组细胞EMT 相关蛋白E-cadherin、MMP-2 和MMP-9 的相对表达量见图4。与sh-NC 组相比较,sh-KIF3B组E-cadherin表达升高,差异有统计学意义(t=19.71,P<0.01);MMP-2和MMP-9表达降低(t=26.57、16.11,P<0.01)。

图4 沉默KIF3B 对EMT相关蛋白表达的影响
3 讨 论
TNBC具有预后差、复发率高、转移率高和死亡率高等特点,已成为近年来乳癌研究和关注的焦点。由于缺乏相应治疗靶点,TNBC 病人无法从内分泌治疗或抗HER2治疗中获益。因此,无论是早期还是晚期的TNBC病人,化疗是目前最主要的治疗方法,并且与其他亚型的乳癌病人相比,TNBC病人对化疗有更高的反应率。大量研究结果显示,TNBC对蒽环类和紫杉醇药物治疗敏感,目前临床上针对TNBC的新辅助化疗方案主要以蒽环类和紫杉醇药物为基础[12-13]。但除了传统化疗外,TNBC 的治疗手段非常有限,因此迫切需要寻找一个新的TNBC治疗靶点。
KIFs的功能已广为人知,其与神经退行性疾病、糖尿病和肾病等疾病的发生密切相关[14-16]。作为KIF3亚家族的成员,KIF3B参与许多生理过程,包括有丝分裂、减数分裂和大分子的运输。在有丝分裂期间,KIF3B 扮演着囊泡运输和膜扩张的角色,KIF3B还可以调节细胞迁移、细胞周期,促进细胞增殖和存活[4]。KIF3B亚基突变使多囊肾病小鼠产生致命表型[17-19]。在远端肾小管酸中毒中,KIF3B和人肾阴离子交换剂1(k AE1)在人肾组织中共表达,并且KIF3B可能参与了HEK293T 细胞中k AE1的积累[16]。KIF3B也在大鼠肾脏缺血/再灌注损伤和急性脊髓损伤中起着重要作用[20-21]。KIF3B也是皮质神经元可塑性的负调节剂[22]。大量研究表明,驱动蛋白广泛参与各种肿瘤的发生,其表达水平与许多肿瘤的发生直接相关[23-25]。有研究显示,在肝癌、精原细胞瘤、口腔鳞状细胞癌、胰腺癌、前列腺癌及胃癌等组织中均存在KIF3B 高表达[5-9,11]。在结直肠癌中过表达KIF3B 可以逆转LEF-AS1敲降引起的细胞增殖、迁移和侵袭抑制并促进细胞的凋亡[10]。hsa_circ_0032462可以调节骨肉瘤细胞中KIF3B 水平,而KIF3B 可逆转hsa_circ_0032462过表达诱导的骨肉瘤细胞增殖以及转移[26]。然而,目前尚无敲降KIF3B影响TNBC 细胞生物学特性和阿霉素化疗敏感性的报道。
本文Transwell实验结果显示,sh-KIF3B组细胞迁移和侵袭数量明显减少,证明沉默MDAMB-231细胞KIF3B基因可以下调细胞迁移和侵袭能力;MTT 实验结果表明,沉默KIF3B基因后细胞增殖能力下降,且在相同浓度阿霉素处理下KIF3B沉默组细胞存活率较低,表明沉默KIF3B可以抑制细胞增殖,并提高细胞对阿霉素的敏感性;流式细胞术结果显示,KIF3B基因沉默后,G0/G1期细胞比例显著下降,而G2/M 期细胞比例显著升高,表明沉默KIF3B诱导了细胞周期阻滞。EMT是肿瘤发生发展过程中的重要现象,也是肿瘤细胞发生浸润迁移和继发性转移的重要机制之一[27]。EMT 在乳癌增殖和转移中也有着重要意义[28]。本研究检测了KIF3B基因沉默后EMT 相关蛋白表达变化,结果显示沉默KIF3B基因后MMP-2 和MMP-9表达降低,而E-cadherin表达升高,差异有显著性。表明沉默KIF3B可以通过EMT 途径调节TNBC细胞的迁移和侵袭。
综上所述,沉默TNBC 细胞中KIF3B基因可以抑制细胞迁移、侵袭和增殖能力,阻滞细胞周期,降低MMP-2 和MMP-9 表达,提高E-cadherin 表达。KIF3B基因沉默还可以与阿霉素协同作用,改善治疗效果。因此,KIF3B有望成为新的TNBC 治疗靶点。
