褪黑素对AFB1所致大鼠心肌损伤作用及机制
2021-07-22闫慧徐庆科高洪瑞潘洋郝岩李健
闫慧,徐庆科,高洪瑞,潘洋,郝岩,李健
(青岛大学附属医院心内科,山东 青岛 266003)
黄曲霉毒素主要由黄曲霉和寄生曲霉等真菌产生[1]。作为迄今为止人类所知的毒性最强的食品污染物之一,黄曲霉毒素B1(AFB1)进入人体后,可诱导组织损伤[2]。AFB1诱导组织损伤的机制十分复杂,其中氧化应激被认为是其产生毒性的重要基础[3]。氧化应激是凋亡的重要调节信号[4]。凋亡又称为程序性细胞死亡,是一种细胞自主性自身破坏的死亡形式,可引起细胞形态改变、DNA 断裂和凋亡小体形成[5-6]。WANG 等[7]研究表明,AFB1 可诱导产生过量的活性氧(ROS),触发氧化应激并诱导心肌细胞凋亡。因此,有必要找到安全有效的天然抗氧化剂,以预防或减轻AFB1诱导的心肌损伤。褪黑素(MT)是一种由松果体分泌的神经内分泌激素,具有调节生物节律、抗氧化的作用[8-9]。MT 可以很容易地进入细胞和亚细胞区室,从而在减轻氧化应激方面优于其他抗氧化剂[10]。近年来的研究表明,MT 对由氧化应激水平升高诱发的多种心脏疾病均具有治疗作用,如心肌缺血/再灌注性损伤、糖尿病性心肌病等[11-12]。但关于MT 干预黄曲霉毒素诱发的心肌损伤少见报道。因此,本研究构建AFB1所致大鼠心肌损伤模型,并给予MT 干预,探讨MT 对AFB1心肌毒性的改善作用及其机制。
1 材料与方法
1.1 主要材料
成年雄性健康SD大鼠,体质量约150 g,由北京维通利华实验动物技术有限公司提供,许可证号为SCXK(鲁)20140007。MT 为Sigma公司产品;AFB1购于上海诚竺生物科技有限公司;抗半胱氨酸天冬氨酸蛋白酶3(caspase-3)抗体和抗β-action抗体均由美国Abcam 公司提供;超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、丙二醛(MDA)以及TUNEL试剂盒购于上海碧云天生物技术有限公司;乳酸脱氢酶(LDH)和肌酸激酶-MB(CK-MB)试剂盒为南京建成生物工程研究所产品;DAB染色液由北京中杉金桥生物技术有限公司提供;BCA 试剂盒购于北京索莱宝科技有限公司。
1.2 实验方法
1.2.1动物分组及处理 适应性喂养1周后,将大鼠将随机分为对照组(A 组)、AFB1 组(B 组)和AFB1+MT 组(C 组),每 组5 只。AFB1+MT 组大鼠给予MT 溶液(5 mg/kg,溶于乙醇生理盐水中)每天1次灌胃,与此同时对照组和AFB1组大鼠给予等量的乙醇生理盐水灌胃。MT 给药后半小时,AFB1组和AFB1+MT 组大鼠给予AFB1溶液(0.3 mg/kg)灌胃,对照组大鼠给予等量的含有二甲基亚砜的蒸馏水灌胃。连续灌胃6周。
1.2.2标本采集 连续6周胃插管给药后,腹腔注射戊巴比妥钠(50 mg/kg)麻醉大鼠,腹主动脉取血并迅速取出心脏组织。大鼠心脏被分为3等份,分别接受如下处理:①立即制备心脏组织匀浆液,检测SOD、CAT 和MDA 的水平;②在液氮中速冻并保存于-80 ℃冰箱中待进行蛋白质提取和分析;③用40 g/L甲醛固定备分析细胞凋亡。
1.2.3血清LDH、CK-MB 水平的测定 从大鼠的腹主动脉采集血样,先在室温下静置30 min,再以3 000 r/min在4 ℃下离心10 min分离血清。根据试剂盒的说明,采用免疫抑制法测定血清CK-MB水平,采用微板法测定血清LDH 水平。实验重复3次,取平均值。
1.2.4心脏组织MDA 含量和SOD、CAT 活性的测定 称取新鲜大鼠心脏组织,制备100 g/L 匀浆液,在4 ℃下以12 000 r/min离心10 min。吸取上清液转入新的EP管中,按照试剂盒说明书,利用各自的底物进行酶促反应并测量吸光度,计算心脏组织中MDA、SOD 和CAT 的表达水平。实验重复3次,取平均值。
1.2.5Western blot检测caspase-3 的表达 将100 mg的冷冻大鼠心脏组织置于1 L 含蛋白酶抑制剂的RIPA 裂解缓冲液中充分裂解,在4 ℃下以12 000 r/min离心20 min,收集上清液,提取组织总蛋白,采用BCA 法测蛋白浓度。应用125 g/L的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离总蛋白(60 mg),转膜,封闭,加入兔源一抗(caspase-3,1∶500;β-actin,1∶10 000),于4 ℃下孵育过夜,洗涤3次后在室温下再加入HRP 标记的山羊抗兔IgG(1∶5 000)孵育2 h。最后用TBST 洗涤3次,通过增强化学发光(ECL)法使目标条带显色,并使用Image J软件分析其灰度值。目标蛋白的相对表达水平=目标蛋白条带的灰度值/β-action条带的灰度值。实验重复3次,取平均值。
1.2.6TUNEL染色检测细胞凋亡 每个样本随机取5张切片,用体积分数0.03的过氧化氢封闭后,按试剂盒说明书对心脏石蜡切片进行TUNEL 染色,以PBST 洗片,DAB 染色。在光镜下观察凋亡的心肌细胞(细胞核呈黄棕色者),应用Image-Pro Plus 6.0 软件对细胞进行计数。计算凋亡率(凋亡细胞与每个区域中总细胞的百分比)。
1.3 统计学分析
用SPSS 13.0软件对数据进行统计分析。所得结果以表示,多组比较采用单因素方差分析,组间两两比较采用LSD-t检验;两个变量之间的相关性评估采用Pearson相关分析。以P<0.05表示差异具有统计学意义。
2 结果
2.1 各组大鼠心脏损伤血清指标的比较
各组大鼠血清CK-MB、LDH 水平存在明显差异(F=16.60、17.75,P<0.01)。与对照组相比,AFB1组大鼠血清中心肌损伤标志物CK-MB 和LDH 的水平明显升高(t=5.14、5.91,P<0.01),而AFB1+MT 组大鼠的血清CK-MB、LDH 水 平较AFB1组显著降低(t=3.06、3.61,P<0.01)。见表1。
表1 各组大鼠心肌损伤血清指标的比较(n=5,z/U·L-1,)

表1 各组大鼠心肌损伤血清指标的比较(n=5,z/U·L-1,)
与A 组相比,*t=5.14、5.91,P<0.01;与B组相比,#t=3.06、3.61,P<0.01。
2.2 各组大鼠心脏组织MDA 含量及SOD、CAT活性的比较
与对照组相比较,AFB1组大鼠心脏组织匀浆液中MDA 含量显著升高,抗氧化酶SOD 和CAT的活性显著降低;与AFB1组相比,AFB1+MT 组大鼠MDA 含量明显下降,SOD 和CAT 的活性明显升高,组间比较差异均有统计学意义(F=5.63~17.12,t=2.44~5.50,P<0.05)。见表2。
表2 各组大鼠心肌氧化应激指标的比较(n=5,)
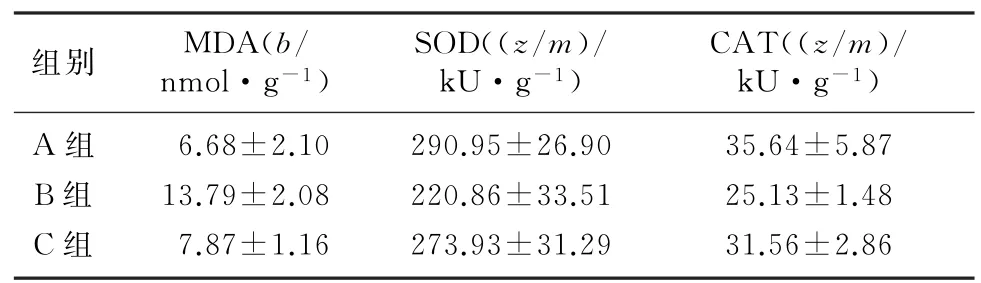
表2 各组大鼠心肌氧化应激指标的比较(n=5,)
2.3 各组大鼠心脏组织caspase-3蛋白表达比较
Western blot检测结果显示,对照组、AFB1组和AFB1+MT 组心脏组织caspase-3 蛋白相对表达水平分别为1.00±0.25、3.45±0.70、2.07±0.76。AFB1组大鼠心脏组织caspase-3蛋白的表达水平较对照组显著增加(F=11.94,t=4.87,P<0.01),AFB1+MT 组大鼠心脏组织caspase-3蛋白的表达显著低于AFB1组(t=2.74,P<0.05)。见图1。
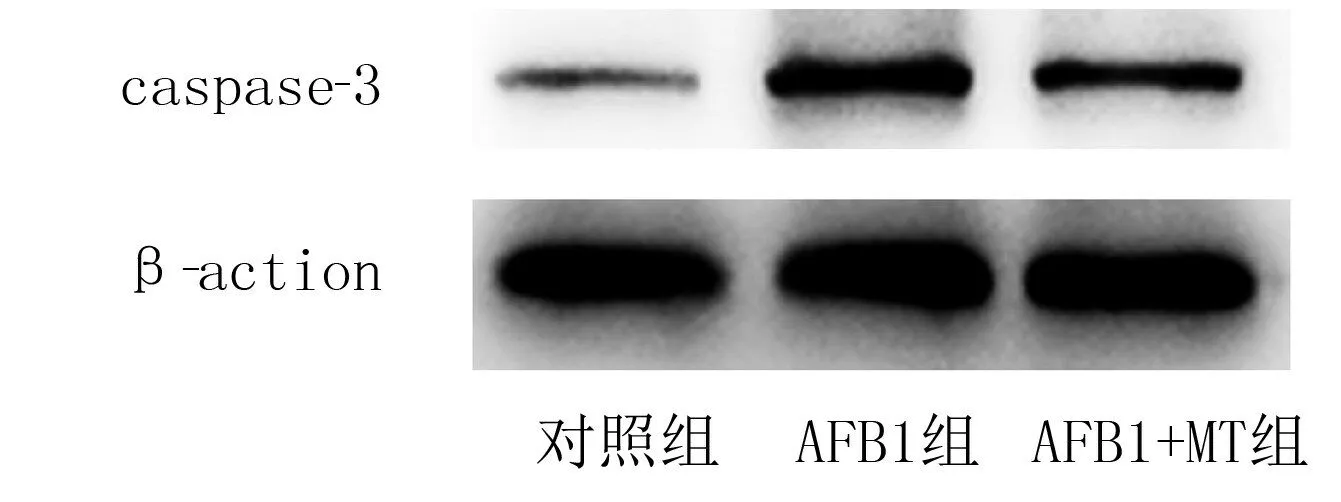
图1 各组大鼠心脏组织caspase-3蛋白表达的Western blot检测
2.4 各组大鼠心肌细胞凋亡率的比较
TUNEL染色结果显示,与对照组相比,AFB1组大鼠心肌细胞凋亡明显增加(F=8.98,t=4.16,P<0.01),但MT 预处理使心肌细胞的凋亡受到了抑制(t=2.29,P<0.05)。见图2。
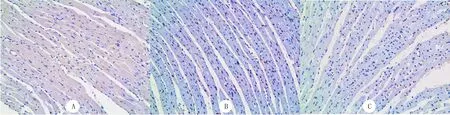
图2 各组大鼠心脏组织TUNEL染色
2.5 大鼠心脏组织中caspase-3与氧化应激指标的相关性
Pearson相关分析显示,AFB1+MT 组大鼠心脏组织中caspase-3的表达水平与MDA 含量呈显著正相关(r=0.857,P<0.05),而与SOD 和CAT的酶活性呈显著负相关(r=-0.845、-0.732,P<0.05)。
3 讨 论
AFB1是已知最危险的真菌毒素,摄入这种毒素能够引起心脏损伤[13-14]。本研究采用AFB1溶液(0.3 mg·kg-1·d-1)灌胃构建大鼠心肌损伤模型,显示AFB1组大鼠血清中心肌损伤标志物CK-MB和LDH 的水平明显升高,说明大鼠心肌损伤模型制备成功;与AFB1 组相比,MT 给药后AFB1+MT 组血清CK-MB、LDH 水平显著降低。本研究结果首次证明,MT 的应用可以有效地挽救暴露于AFB1所致的心肌损伤。为明确MT 对AFB1引起的大鼠心肌损伤的保护作用及机制,本研究进一步检测了各组大鼠的心脏氧化应激指标和心肌细胞凋亡程度。
相关研究表明,AFB1可诱导细胞产生大量的ROS,进一步破坏膜质和DNA 的结构,并抑制其修复而引起氧化应激[15-16]。正常情况下机体的氧化和抗氧化能力处于平衡状态,任何增强氧化作用或降低抗氧化能力的因素均可打破这一平衡,致细胞内ROS过量积累,进而引起细胞氧化损伤[17-18]。其中,脂质过氧化被认为是氧化损伤的主要指标之一,主要表现为MDA 含量的增加。MT 是目前已知的最为强效的抗氧化剂之一[19]。对大鼠肝脏的研究结果显示,MT 可以显著恢复谷胱甘肽过氧化物酶(GPx)、SOD 和谷胱甘肽转移酶(GST)等抗氧化酶的活性,有效减轻AFB1诱导的肝脏氧化损伤[20-21]。这些抗氧化酶共同参与机体抗氧化防御系统的形成,其中,SOD 可催化氧自由基生成H2O2,进一步在GPx和CAT 的催化下分解为水和氧[22-23]。本研究结果显示,经AFB1处理后,大鼠心脏组织匀浆液中MDA 的含量显著升高,抗氧化酶SOD 和CAT的活性显著降低,与以往的报道一致[13];AFB1+MT 组与AFB1组相比,MDA 含量明显下降,组织抗氧化酶活性明显升高,组间比较差异均有统计学意义,表明MT 通过增强组织抗氧化能力来减轻AFB1诱导的心脏氧化损伤。
我们的前期研究证实,AFB1引起的心脏损伤与心肌细胞的凋亡有关[24]。细胞凋亡过程需要多种半胱氨酸天冬氨酸蛋白酶的参与,其中,caspase-3是凋亡执行过程中最主要的蛋白,并在AFB1暴露的心肌细胞中异常表达,最终导致细胞的死亡[7,24]。氧化应激被认为是凋亡的重要调节信号[25]。线粒体功能障碍与氧化应激诱导的凋亡过程密切相关,线粒体通透性的增加导致细胞色素C 的释放增多,胞质中游离的细胞色素C 可通过激活caspase-9而激活下游的caspase-3,最终导致凋亡的发生[26-28]。因此,氧化应激的抑制可能对AFB1诱导的心肌细胞凋亡具有保护作用。MEKI等[21]研究表明,MT通过改善氧化应激,下调caspase-3蛋白的表达,减轻AFB1诱导的肝细胞凋亡,从而保护肝脏组织免受AFB1的毒性损伤。目前,关于MT 对AFB1细胞毒性的保护作用的研究尚仅限于消化和生殖系统[29-30],而其与心脏有关的报道很少。
本研究TUNEL 染色显示,AFB1可使大鼠心肌细胞凋亡率明显增加,而给予MT 预处理则显著抑制了AFB1 诱导的心肌细胞凋亡;Western blot检测结果也显示,MT 可以显著降低AFB1诱导的caspase-3的活化,而caspase-3 是凋亡过程中的关键调控蛋白,说明MT 可能是通过下调caspase-3蛋白的表达来减轻AFB1的心肌毒性。进一步的相关分析显示,大鼠心脏组织中caspase-3的表达水平与MDA 含量呈正相关,而与SOD 和CAT 的酶活性呈负相关。这些研究结果表明,MT 保护大鼠心脏免受AFB1的毒性损伤,其机制可能与抑制氧化应激、下调caspase-3的表达,进而减少心肌细胞的异常凋亡有关。
综上所述,氧化应激是AFB1心肌毒性的主要表现之一,最终导致心肌细胞的凋亡。作为人类可自身分泌的内源性激素,MT 具有强大的抗氧化能力,且安全无毒性。本研究结果表明,MT 可以减轻AFB1诱导的心脏损伤,该作用可能是通过改善心肌抗氧化能力、抑制caspase-3蛋白的表达、降低心肌细胞凋亡实现的,这为AFB1心脏毒性的治疗提供了新的方法。
